磁性纳米粒子的制备及环糊精葡萄糖基转移酶的固定化*
2020-08-03郭姣梅郝建华李晓涵孙晶晶
郭姣梅,郝建华,李晓涵,王 伟,孙晶晶,宋 凯
(1. 中国水产科学研究院黄海水产研究所,青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室, 农业农村部极地渔业开发重点实验室,山东 青岛 266071; 2. 上海海洋大学 食品学院,上海 201306)
0 引 言
环糊精葡萄糖基转移酶(cyclodextrin glucanotransferase, CGTase,EC 2.4.1.19)属于α-淀粉酶第13号家族的重要成员,能够催化水解反应、环化反应、耦合反应和歧化反应。CGTase作为一种生物催化剂,主要用来催化淀粉转化为α,β,γ-环糊精(CD),CD因其具有外部疏水,内部亲水的独特理化性质,不仅用于食品行业[1-2],在生物技术[3]、化妆品[4]、化学工业[5]、医药[6]、环境保护[7]等诸多领域也有着非常广泛的应用,其工业化生产将具有重要意义。CGTase也广泛应用于VC衍生物2-O-α-D-葡萄糖基-L-抗坏血酸(AA-2G)的生产。AA-2G被认为是最稳定、性能最佳的VC替代品。使用游离CGTase转化合成CD或AA-2G,反应结束后,游离的CGTase不易回收,且反应成本较高。CGTase固定化能明显提高其稳定性和使用次数,降低反应成本。G. G. Gimenez[8]等通过表面锚定和共价结合法将CGTase固定在二氧化硅上,并将固定化酶用于CD的生产。Zhang J[9]等报道了在聚乙烯亚胺存在下,将重组CGTase固定在聚多巴胺-Fe3O4纳米颗粒上的研究,结果表明,固定化CGTase能高效生产β-环糊精。
磁性纳米粒子作为一种吸附材料,具有高矫顽力、超顺磁性和良好的生物相容性,以及粒径小、比表面积大、吸附力强、易于磁液分离等优点,故磁性纳米材料在药物输送[10-11]、细胞分离[12]、固定化酶[13]、磁流体热疗和磁共振成像[14, 15]、癌症诊断[16]等各个生物技术领域均有广阔的应用前景。然而, Fe3O4磁性纳米粒子在空气中易氧化,易团聚,亲水性差,这极大的限制了磁性纳米粒子在生物技术领域的应用。为增强其稳定性及生物相容性,有必要对Fe3O4磁性纳米粒子进行表面改性。二氧化硅无毒无害、亲水性好、具有良好的生物相容性,易于实现表面功能化,做为四氧化三铁纳米粒子的表面修饰材料受到广泛关注[17-18]。
本研究采用化学共沉淀法制备Fe3O4纳米粒子,在制备过程中加入聚乙二醇防止其团聚,以正硅酸四乙酯(TEOS)为硅源包覆Fe3O4粒子,再将氨基偶联剂3-氨丙基三乙氧基硅烷(APTES)通过化学键结合到包硅磁性材料上,得到氨基硅烷化的磁性纳米粒子,并用于CGTase的固定化研究。
1 实 验
1.1 材料和试剂
氯化铁(FeCl3·6H2O),硫酸亚铁(FeSO4·7H2O),氨水(NH3·H2O),正硅酸四乙酯(TEOS),乙醇,以上均为分析纯,国药集团化学试剂有限公司,高纯氮,聚乙二醇(PEG4000),3-氨丙基三乙氧基硅烷(APTES),分析纯,aladdin(阿拉丁),甲苯,分析纯,莱阳经济技术开发区精细化工厂;试验用水均为去离子水。
1.2 实验方法
1.2.1 磁性Fe3O4纳米粒子的制备
参照琚彩霞等[19]方法,并略作改动,采用化学共沉淀法,称取4.86 g FeCl3·6H2O和2.78 g FeSO4·7H2O溶于100 mL去离子水中,为防止磁性纳米团聚,再加一定量的PEG4000,超声30 min除去体系中的氧气,氮气保护下升温至70 ℃,磁力搅拌下加入一定量的氨水,溶液逐渐变为黑色,反应30 min后,用去离子水和无水乙醇反复洗涤,干燥,即得磁性Fe3O4纳米粒子。
反应原理:Fe2++2Fe3++8OH-1:→Fe3O4+4H2O。
1.2.2 磁性Fe3O4@SiO2纳米粒子的制备
参照李进红等[20]的方法,并稍微改动,取2 g磁性Fe3O4纳米粒子溶于160 mL无水乙醇,40 mL去离子水,超声处理30 min,磁力搅拌下加入5 mL氨水,再加缓慢加入5 mL正硅酸乙酯(TEOS),40 ℃磁性搅拌8 h,磁性吸附,分别用无水乙醇和水反复洗涤,干燥,即得磁性Fe3O4@SiO2。
1.2.3 硅烷化Fe3O4@SiO2-NH2纳米粒子的制备
取1 g磁性Fe3O4@SiO2,溶于100 mL甲苯中,超声处理30 min,逐滴加入4 mL 3-氨丙基三乙氧基硅烷(APTES),磁力搅拌24 h,磁性吸附,分别用无水乙醇和水反复洗涤,干燥,即得磁性Fe3O4@SiO2-NH2。
1.2.4 表征方法
采用日本JEOL公司JEM-2100F型透射电镜和德国Carl Zeiss公司Merlin compact型扫描电镜对样品进行形貌结构观察;采用德国Bruker公司TENSOR2型傅里叶变换红外光谱仪对样品进行表面性质的表征;采用德国Bruker公司D8型X射线粉末衍射仪对磁性纳米粒子进行晶形结构表征,CuKα射线(λ=0.15418 nm),管电压40 kV,管电流40 mA,扫描速率10°/min,扫描范围5~80°;采用美国Lake Shore公司的VSM 7307型振动样品磁强计在室温下对样品进行磁性能表征(磁滞曲线和饱和磁化强度);采用美国TA公司TAQ600型热重分析仪对样品进行热稳定性表征,气氛为N2,温度范围在0~1 000℃,升温速率为10 ℃/min;采用瑞士帝肯公司Infinite M200Pro型酶标仪测定吸光度
1.2.5 CGTase的固定化
准确称取10 mg磁性纳米粒子,分别加入一定浓度的CGTase酶液,酶液由一定pH值的缓冲液配制,在设定的温度、设定转速的摇床中固定化一定的时间。固定化结束后,把固定化好的CGTase用磁铁分离,将上清液吸出,用一定的缓冲液反复洗涤至上清液酶蛋白含量为零。
(1)固定化酶的热稳定性
将游离酶和固定化酶分别置于4、10、20、30、40、50、60 ℃恒温水浴条件下处理2 h,测定其酶活,以最高酶活力为100%,探究不同温度对固定化酶和游离酶活力的影响。
(2)固定化酶的pH稳定性
将游离酶和固定化酶分别置于50 mmol/L不同pH 4~12的缓冲液中处理2 h,测定其酶活,以最高酶活力为100%,探究不同pH对固定化酶和游离酶活力的影响。
(3)固定化酶的储存稳定性
将游离酶和固定化酶分别在4 ℃放置0、5、10、15、20、25、30 d,将第一次测得的酶活记为100%,探究其储存稳定性。
2 结果与分析
2.1 形貌表征
2.1.1 透射电子显微镜(TEM)
分别对Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2-NH2的粒径和形貌进行透射电镜表征,如图1(a,b,c)所示,共沉淀法制得的磁性Fe3O4纳米粒子平均粒径为18 nm,形貌为球形且大小均匀。Fe3O4粒子被SiO2包覆后,其周围有壳,使Fe3O4@SiO2粒径增大,粒径约22 nm。Fe3O4@SiO2氨基化后,粒径无明显变化。

图1 Fe3O4, Fe3O4@SiO2和Fe3O4@SiO2-NH2的透射电镜图Fig 1 TEM images of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-NH2
2.1.2 扫描电子显微镜(SEM)
分别对Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2-NH2的粒径和形貌进行扫描电镜表征,如图2(a,b,c)所示,3种纳米粒子的扫描电镜图形状较规则,均呈球状。但未经修饰的Fe3O4由于表面能高,团聚较明显。

图2 (a)Fe3O4 ,(b)Fe3O4@SiO2和(c)Fe3O4@SiO2-NH2的扫描电镜图Fig 2 SEM images of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-NH2
2.2 红外光谱分析
样品Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2-NH2等纳米粒子的红外光谱见图3(a,b,c),Fe3O4纳米粒子在580 cm-1处有吸收峰,是Fe-O特征伸缩振动吸收峰。Fe3O4﹫SiO2纳米粒子在797和1 090 cm-1处分别为Si-O-Si的对称和不对称伸缩振动吸收峰,956和466 cm-1分别为Si-OH和Si-O-Si的弯曲振动吸收峰,这表明Fe3O4纳米粒子表面已生成了SiO2。Fe3O4﹫SiO2-NH2纳米粒子在2 929 cm-1处为C—H反对称伸缩振动吸收峰,1 490 cm-1为—CH2弯曲振动吸收峰,1 560处为N—H变形振动吸收峰,这表明Fe3O4﹫SiO2纳米粒子表面已成功引入氨基。

图3 Fe3O4, Fe3O4@SiO2和Fe3O4@SiO2-NH2的FT-IR谱图Fig 3 FT-IR spectra of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-NH2
2.3 磁性纳米粒子的X衍射分析
样品Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2-NH2等纳米粒子的XRD见图4(a,b,c),由图可知,Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2-NH2的衍射峰出现的位置2θ在30.07°、35.42°、43.05°、53.41°、56.93°、62.52°的衍射角依次对应于反式尖晶石结构Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)晶面,这与Fe3O4标准卡片中相应的特征峰一致。这说明,在对Fe3O4磁性纳米粒子进行表面改性时,Fe3O4晶体的结构并未改变,峰形窄且尖锐,结晶完整,此外,Fe3O4@SiO2,Fe3O4@SiO2-NH2磁性纳米粒子在2θ为20°~25°附近出现了衍射峰,强度不大,这与无定形二氧化硅的衍峰形一致。
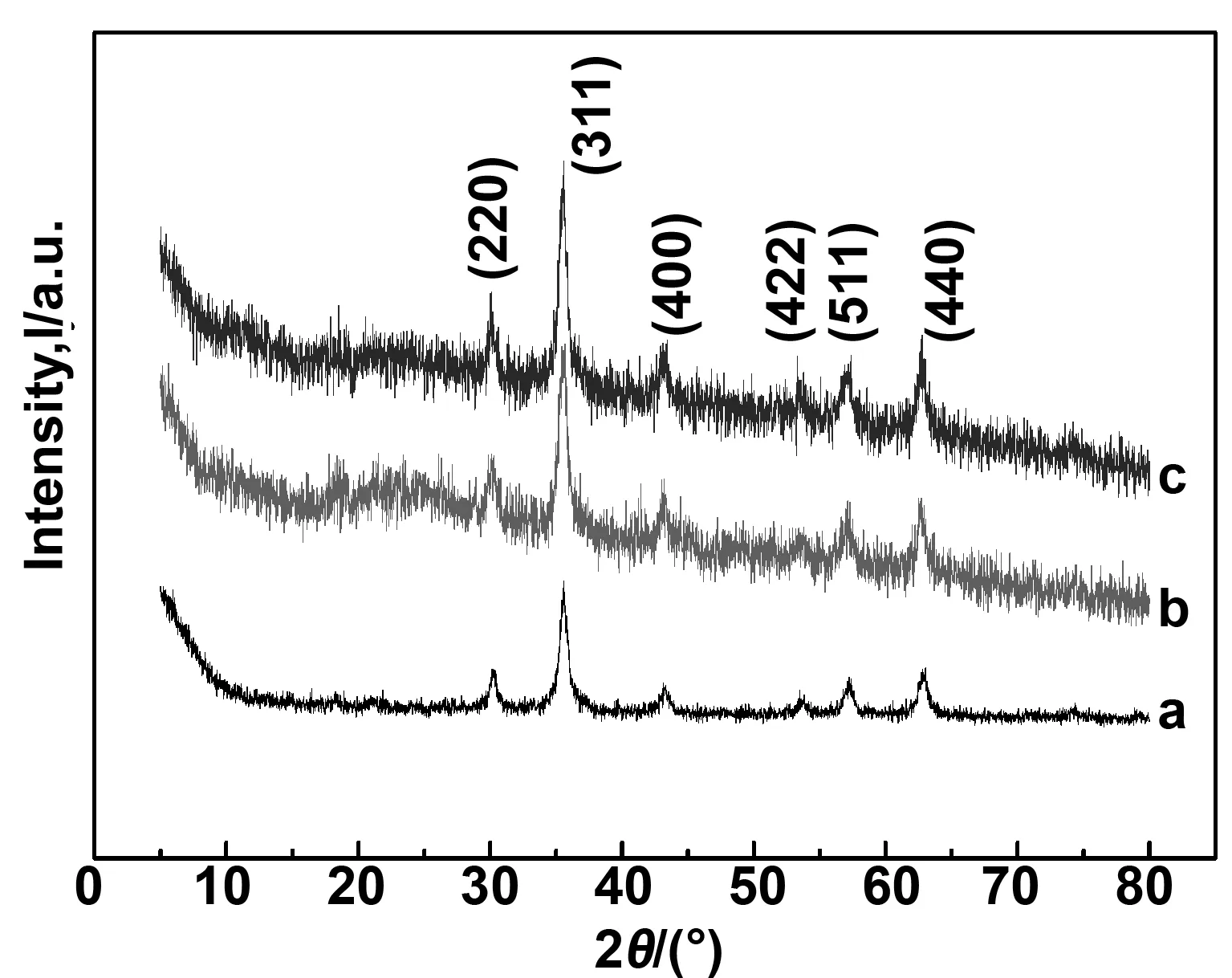
图4 Fe3O4, Fe3O4@SiO2和Fe3O4@SiO2-NH2的XRD谱图Fig 4 XRD spectra of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-NH2
2.4 磁性纳米粒子的磁性能分析
Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2-NH2等纳米粒子的磁滞回线见图5(a、b、c)。由图可知,这3种纳米粒子剩余磁化强度和矫顽力均为零,且室温下均表现出良好的超顺磁性。Fe3O4纳米粒子的饱和磁化强度为132.06 Am2/kg,与TEOS作用后,得到的Fe3O4@SiO2纳米粒子的饱和磁化强度为60.67 Am2/kg, APTES与Fe3O4@SiO2纳米粒子反应后,得到Fe3O4@SiO2-NH2纳米粒子的饱和磁化强度为40.22 Am2/kg。3种磁性粒子饱和磁化强度依次降低是因为磁性粒子表面包覆了非磁性物质,粒子磁性成分降低。

图5 Fe3O4, Fe3O4@SiO2和Fe3O4@SiO2-NH2的磁响应曲线Fig 5 Magnetic response curves of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-NH2

图6 Fe3O4@SiO2-NH2纳米粒子经磁场分离的示意图Fig 6 Schematic diagram of magnetic field separation of Fe3O4@SiO2-NH2 nanoparticles without and with external magnetic field
2.5 热重分析
Fe3O4,Fe3O4@SiO2,Fe3O4@SiO2-NH2等纳米粒子的热重分析见图7(a、b、c),3种纳米粒子测定温度均在室温下测定。由图7可知,Fe3O4纳米粒子热稳定性良好,与TEOS作用后,得到的Fe3O4@SiO2纳米粒子失重约2.3%,用APTES与Fe3O4@SiO2纳米粒子反应后,得到Fe3O4@SiO2-NH2纳米粒子失重约11%,修饰上的氨基含量约为3.5%。

图7 Fe3O4, Fe3O4@SiO2和Fe3O4@SiO2-NH2的失重曲线Fig 7 Weight loss curves of Fe3O4, Fe3O4@SiO2 and Fe3O4@SiO2-NH2
2.6 固定化酶的热稳定性
结果如图8,随着温度的不断升高,固定化酶与游离酶的酶活均下降,但固定化酶的稳定性优于游离酶,在60 ℃时,游离CGTase的酶活保留率仅为13.43%,而固定化CGTase在60 ℃保存2 h后,酶活保留率可达23.4%,这说明CGTase经Fe3O4@SiO2-NH2磁性纳米粒子固定化后,热稳定性得到了提高。

图8 温度对固定化酶和游离酶稳定性的影响Fig 8 Effect of temperature on the stability of immobilized and free enzymes
2.7 固定化酶的pH稳定性
把固定化酶和游离酶置于pH 4-12条件下2 h,测定酶活力,研究pH对酶活力的影响。由图9可得,在pH为9时,游离CGTase和固定化CGTase均有最高的稳定性,且固定化CGTase对酸碱的耐受性优于游离酶,在pH为4~9时,随着pH的不断升高,固定化酶与游离酶的酶活均增大,在pH为9~12时,随着pH的不断升高,固定化酶与游离酶的酶活均下降。这说明CGTase经Fe3O4@SiO2-NH2磁性纳米粒子固定化后,对酸碱的耐受性也得到了提高。
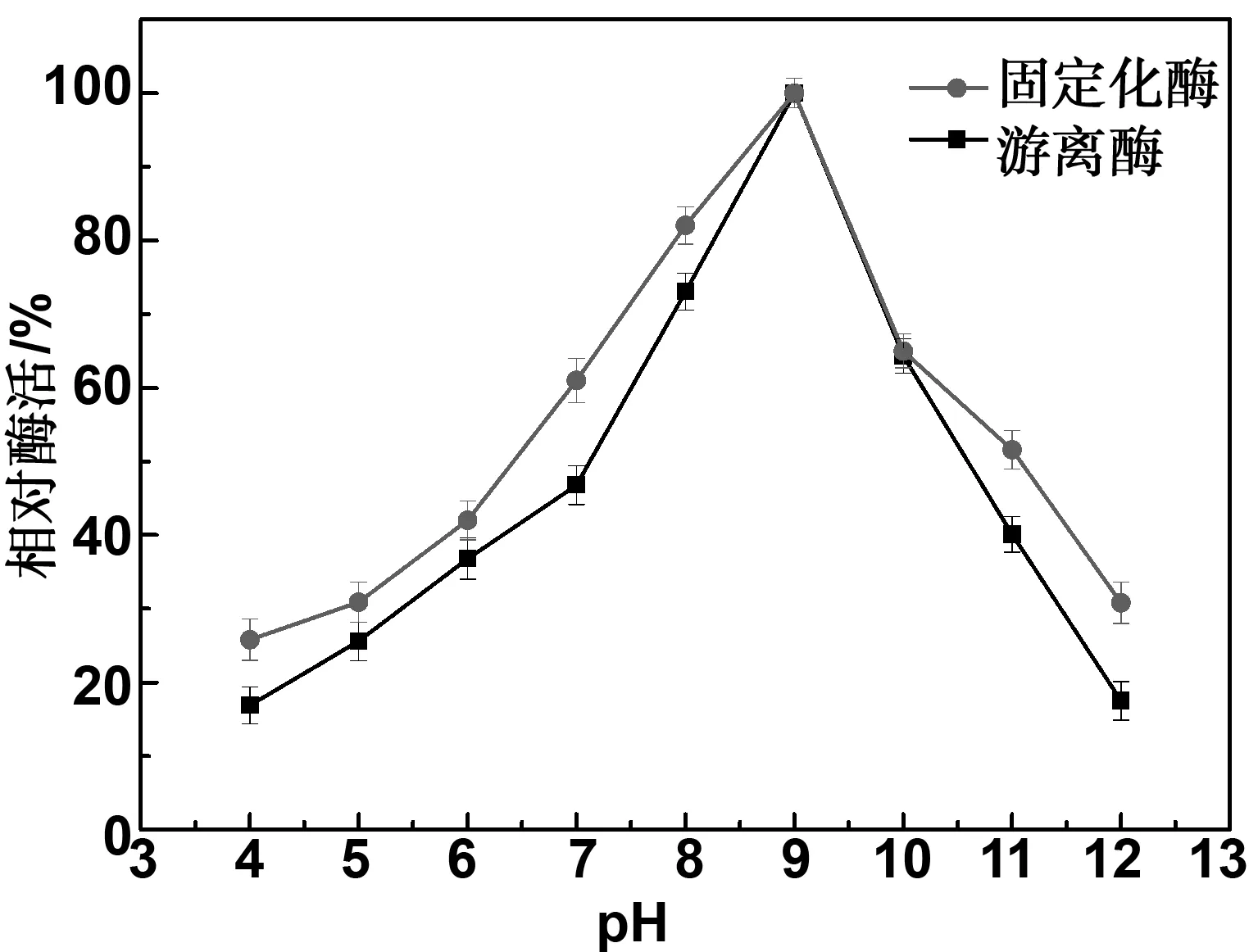
图9 pH对固定化酶和游离酶稳定性的影响Fig 9 Effect of pH on the stability of immobilized and free enzymes
2.8 固定化酶的储存稳定性
将游离CGTase和固定化CGTase在4 ℃下放置,每隔5天测定一次酶活,由图10可知,固定化酶和游离酶的酶活保留率均随着时间的延长而降低,固定化CGTase放置30 d后,保留了61%的初始酶活,而游离CGTased的酶活保留率为50%相比于游离酶,固定化酶的酶活保留率降低的趋势更缓慢。这说明,固定化CGTase与游离CGTase相比,储存稳定性明显提高。
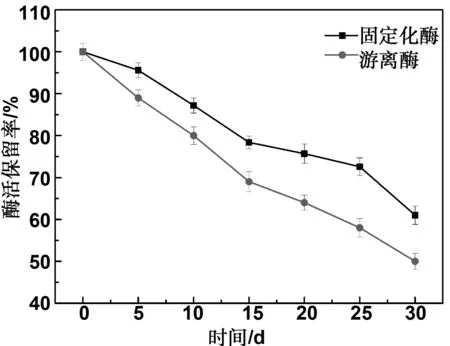
图10 固定化酶与游离酶的储存稳定性Fig 10 Storage stability of immobilized and free enzymes
3 结 论
采用共沉淀法制备Fe3O4纳米粒子,并依次用TEOS、APTES对其进行表面修饰,得到氨基硅烷化磁性纳米粒子Fe3O4@SiO2-NH2。采用TEM、SEM、FTIR、XRD、VSM和TGA对磁性纳米粒子进行表征可得,Fe3O4@SiO2-NH2纳米粒子粒径约为22 nm,结晶度高,稳定性好,且具有良好的超顺磁性。利用Fe3O4@SiO2-NH2纳米粒子固定化CGTase可得,固定化酶的热稳定性,对酸碱的耐受性和储存稳定性均优于游离酶。
