马脂肪间充质干细胞的分离培养与生物学特性试验
2020-08-03罗惠娜王丙云王彩莹黄国健陈胜锋陈志胜罗冬章詹小舒刘璨颖白银山
罗惠娜 , 雷 彬 , 王丙云 , 王彩莹 , 黄国健 , 陈胜锋 ,陈志胜 , 罗冬章 , 詹小舒 , 刘璨颖 , 白银山
(1. 佛山科学技术学院生命科学与工程学院 , 广东 佛山 528231 ; 2.广东省黄村体育训练中心 , 广东 广州 510663)
干细胞(Stem cells, SCs)是一类具有自我更新能力和多向分化潜能的原始未分化细胞。间充质干细胞(Mesenchymal stem cells, MSCs)作为干细胞家族中重要成员,也具有多向分化潜能,可分化为脂肪细胞、骨细胞、软骨细胞、神经细胞等其他细胞,是再生疗法的成体干细胞中非常有前途的种子细胞[1-2]。在治疗运动系统及退行性疾病方面发挥着巨大的潜能[3]。在马兽医学中,MSCs适用于治疗马肌腱韧带拉伤和关节炎等损伤[4-8]。
肌腱和韧带拉伤、骨关节炎是人类和赛马临床常见的运动性疾病。迄今为止尚未发现理想的治疗方法。在过去的十几年中,潜在的再生疗法,特别是干细胞疗法引起了人们极大的兴趣。脂肪间充质干细胞(Adipose derived mesenchymal stem cells, AD-MSCs)是指来源于脂肪组织的MSCs。相比于骨髓来源的MSCs,具有来源丰富、操作简便、容易获得、体外增殖能力强等特征[9],是治疗运动系统及退行性疾病的理想种子细胞。但目前缺乏标准化的分离、培养和鉴定马AD-MSCs的方法。现阶段,建立马AD-MSCs培养体系,将会对运动赛马等动物及人类干细胞的临床转化应用奠定基础。本试验主要研究了马AD-MSCs的分离方法、培养体系和生物学特性,为下一步疾病的治疗提供理想的种子细胞。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 由广州奥体马术场提供的中年纯血骟马。
1.1.2 主要试剂与设备 DMEM基础培养基(Hyclone公司);胎牛血清FBS (BI公司);0.25%胰蛋白酶(Hyclone公司);0.1% Ⅰ型胶原酶(Sigma公司);干细胞成脂诱导分化完全培养基(Cyagen公司);干细胞成骨诱导分化完全培养基(Cyagen公司);RNA提取试剂盒(TaKaRa公司);反转录试剂盒(TaKaRa公司);CD90-PE、CD45-FITC购自Abcam;CD105-FITC购自Invitrogen;CD44-FITC购自R&D。
超净工作台(苏州苏净公司);荧光显微镜(Olympus公司);超速低温离心机(Beckman公司);PCR仪(Thermofisher公司);流式细胞仪(BD公司)。
1.2 试验方法
1.2.1 脂肪采集 对试验马匹进行镇静处理,颈部采集脂肪组织后进行常规外科缝合。将采集的脂肪组织放入含10%双抗的PBS缓冲液中,低温送回实验室进行下一步试验。
1.2.2 原代马AD-MSCs的分离、培养 PBS缓冲溶液清洗脂肪组织表面的血细胞2~3次,转移至培养皿中;用无菌器械将组织块剪碎至1 mm3,0.1%Ⅰ型胶原酶消化2 h至无明显大颗粒,100目细胞筛过滤,将滤液转移至15 mL离心管,1 000 r/min离心5 min,弃去上清;然后用含10%FBS的DMEM完全培养基重悬沉淀,调整细胞密度至1×106个细胞/mL,转移至60 mm培养皿置于37 ℃、5%CO2培养箱中培养。24 h后首次半量更换培养基除去大部分血细胞,以后每隔3 d更换1次培养基。倒置显微镜下观察细胞形态和生长情况,此时细胞即为P0代马AD-MSCs。
1.2.3 细胞传代培养及生长特性观察 待细胞长至80%~90%汇合时,弃去上清液,用PBS清洗细胞1~2次。0.25%胰蛋白酶消化,用含10%FBS的培养基终止消化。离心、弃上清、进行传代扩增培养。显微镜下观察细胞生长状态及活性,并拍照记录。
1.2.4 细胞生长曲线制作及群体倍增时间的测定 绘制细胞生长曲线:依次取P2、P5、P8代马AD-MSCs,调整细胞密度至5×104个细胞/mL,接种于24孔板中, 置于37 ℃、含5%CO2的培养箱中进行培养。随后每天随机抽取5个孔消化,按细胞、台盼蓝体积分数比1∶1混匀, 采用Counstar细胞计数仪计数。每孔计数3次取平均值,持续8 d。绘制P3、P6、P9代细胞的生长曲线。横坐标代表培养天数(d),纵坐标代表细胞数。
细胞群体倍增时间的计算:根据生长曲线的对数增殖期计算群体倍增时间。Patterson公式为DT=t×[lg2/(lgNt-lgNo)]),t为培养时间,No为首次记下的细胞数,Nt为t时间后的细胞数。
1.2.5 马AD-MSCs的生物学特性研究
(1)细胞形态学观察 倒置显微镜下观察原代及传代培养细胞的形态。
(2)马AD-MSCs表面标志物测定 消化P3代马AD-MSCs,调整细胞密度为1×106个细胞/mL。转移至1.5 mL离心管中,PBS清洗后离心,弃上清。分别加入一抗稀释液,标记的抗体有:CD105-FITC、CD45-FITC、CD90-PE、CD44-FITC。避光孵育30 min后离心弃去上清,加100 μL PBS重悬,流式细胞仪分析马AD-MSCs表面标志物。
(3)总RNA提取, cDNA合成和PCR基因检测 引物设计如表1,检测CD90、CD44、CD73和CD105等间充质干细胞表面标志物的相关基因。取P5代传代细胞,TaKaRa试剂盒提取总RNA, RNA浓度由分光光度计A260 nm测定。反转录成cDNA,-20 ℃保存备用。并将cDNA全组基因作为模板进行PCR体系扩增,电泳检测扩增产物。

表1 MSCs相关基因的引物序列
(4)马AD-MSCs的成骨诱导分化试验 取生长状态良好的P3代细胞,调整细胞密度为1×105个细胞/mL,接种至24孔板。试验分为对照组和试验组,每组3个重复。培养24 h后弃去原培液,PBS清洗2遍,试验组加入成骨诱导分化完全培养基,对照组则加入含10%FBS的DMEM完全培养基。3 d换1次液,直至试验组出现钙结节。然后用10%多聚甲醛固定30 min,经碱性磷酸酶染色10 min,PBS清洗后显微镜下观察并拍照记录。
(5)马AD-MSCs的成脂诱导分化试验 取生长状态良好的 P3代脂肪细胞,调整细胞密度为 1×105个细胞/mL,接种 24孔培养板上。试验分为对照组和试验组,每组3个重复。试验组按照说明书交替加入成脂诱导分化A液和B液,对照组则加入含10%FBS的DMEM完全培养基。培养3~5个循环后,10%多聚甲醛固定30 min,油红O染色10 min,PBS清洗后显微镜拍照记录。
2 结果
2.1 马AD-MSCs形态学观察 采用Ⅰ型胶原酶消化法得到原代培养的细胞呈圆形,胞体透亮。此时细胞杂乱,大量红细胞覆盖在表面,通过半数更换培养基除去大多数杂细胞。培养至72 h细胞开始贴壁,此时细胞形态多样,见图1A;培养至5 d时,细胞大量贴壁,细胞呈长梭形,胞质较大,折光性强,见图1C;培养至7 d,细胞达70%~80%汇合即可传代,传代细胞出现均匀分布的纺锤形,呈典型的漩涡状,见图1E;细胞传代至P9代仍能保持稳定增长,保持细胞形态不变,见图1F。
2.2 马AD-MSCs生长曲线及群体倍增时间的测定 如图2所示,P3、P6、P9代马AD-MSCs的生长曲线均呈典型的S型,第3天进入对数生长期,P3、P6代细胞第6天进入平台期,P9代细胞第8天进入平台期。P9代增值能力开始下降。绘制的生长曲线符合Logistic生长曲线规律。图3所示为细胞群体倍增时间图。随着细胞代数的增加,群体倍增时间也递增。
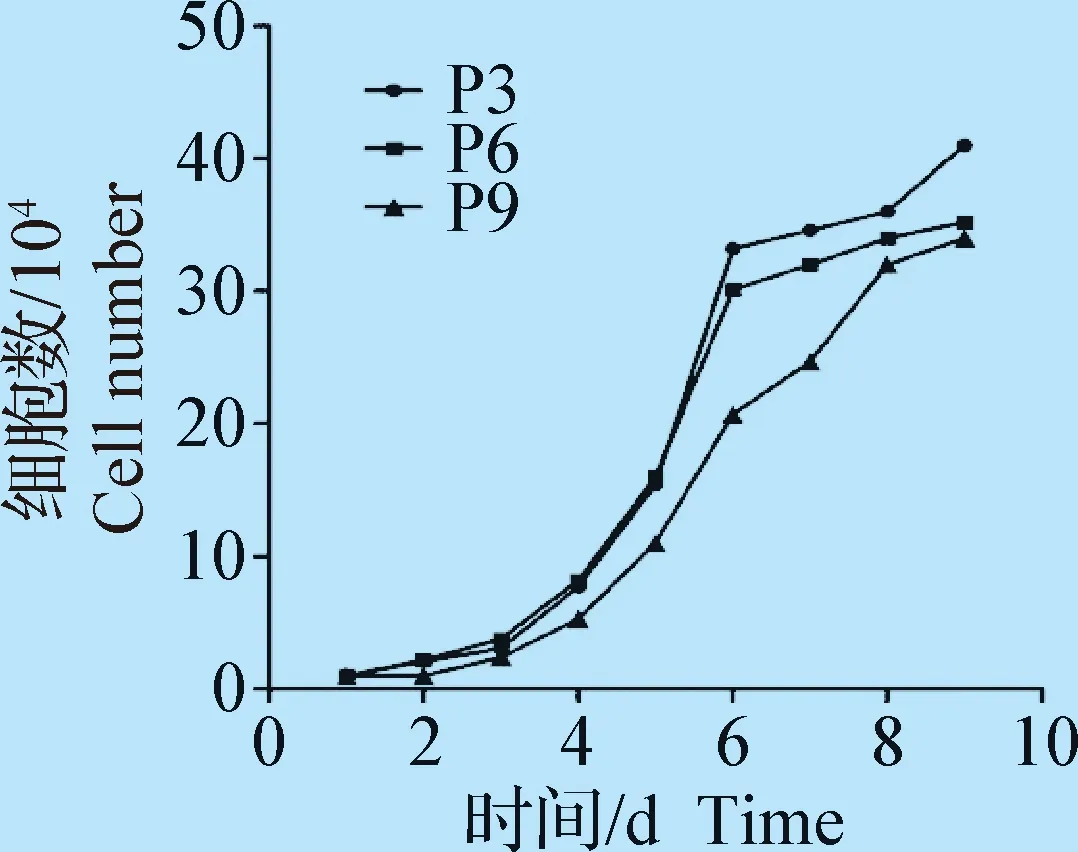
图2 马AD-MSCs生长曲线

图3 群体倍增时间
2.3 马AD-MSCs表面标志物检测 P3代马AD-MSCs高表达间充质干细胞表面标志物CD105、CD44和CD90,不表达造血系细胞表面标志物CD45,见中插彩版图4。
2.4 马AD-MSCs表面标志物基因检测 MSCs相关基因PCR鉴定结果如图5所示,细胞高表达CD105、CD90、CD73和CD44基因。该结果符合间充质干细胞特性。
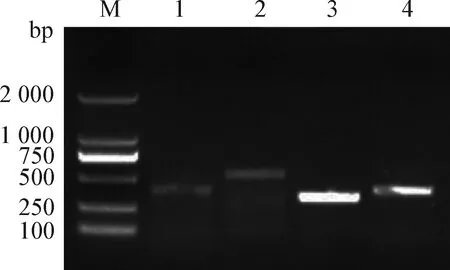
图5 PCR结果
2.5 AD-MSCs成骨诱导分化试验 取生长状态良好的P3代细胞进行成骨诱导分化鉴定,对照组细胞形态未发生明显变化,10 d后铺满整个培养皿,未出现钙结节。试验组加入成骨诱导培养液7 d后,细胞形态发生明显变化,呈现鳞片状、细胞堆积连接成片;诱导培养10 d出现钙结节,运用茜素红进行矿化结节染色。显微镜下观察试验组可见细胞融合重叠生长,整个视野形成大面积明显的红色致密结节。表明细胞形成矿化结节,对照组茜素红染色呈阴性,见中插彩版图6。
2.6 AD-MSCs成脂诱导分化试验 取生长状态良好的P3代细胞进行成脂诱导分化,对照组细胞形态未发生明显变化,试验组细胞加入诱导分化培养液后14 d,大部分细胞呈卵圆形,胞质内出现许多大小不一的脂质颗粒出现;21 d后脂滴逐渐增多。油红O 染色结果显示,试验组脂质颗粒被染成红色。表明马AD-MSCs有脂向分化的能力,对照组油红O染色呈阴性,见中插彩版图7。
3 讨论
MSCs是一种起源于中胚层,具有自我更新能力及诱导分化为脂肪细胞、骨细胞、软骨细胞及其他胚层细胞潜能的成体干细胞。相比于其他组织来源的MSCs,ADMSCs具有来源丰富、易获得、增殖能力强的特点,并具有趋化归巢到损伤组织、旁分泌和免疫调节等功能,应而广泛应用于再生医学和组织工程领域中[10]。目前,国内未见到有关马的AD-MSCs的分离、培养、鉴定及其在治疗马运动系统、退行性疾病方面的应用的报道。因此,建立马的AD-MSCs的分离方法、培养体系具有重要意义,能为马属动物相关疾病的治疗提供同源性的治疗用干细胞,并对干细胞运用的安全性、有效性提供理论依据。
目前主要采用组织块培养法、胰酶胶原酶法进行AD-MSCs分离培养。本试验采用Ⅰ型胶原酶消化法从脂肪组织分离得到马的AD-MSCs。在显微镜下可见纺锤形,呈典型的旋涡状生长。经多次传代后,细胞形态均能保持一致。相比其他培养方法,Ⅰ型胶原酶消化法更加温和,操作更简便,分离得到的细胞活性更好,能够传代次数更多[11]。通过细胞计数法观察P3、P6、P9传代细胞生长曲线及群体倍增时间,绘制的生长曲线符合Logistic生长曲线规律。P3~P6代细胞增值能力基本相同,P9代增值能力略低于P3~P6代细胞。
本试验结合使用 RT-PCR 和流式细胞术检测MSCs标志物,P3代马AD-MSCs高表达细胞表面标记分子CD44、CD105、CD90,不表达造血干细胞表面标记CD45;PCR扩增得到相应MSCs特定基因片段,与Sherman等[12]的研究结果相一致。在特定诱导环境和条件下,马AD-MSCs可向脂肪、肌肉、向骨、软骨、神经、血管等多种方向分化[13-14]。本试验分别对马AD-MSCs进行了成骨和成脂诱导分化,检测了马AD-MSCs的多向分化能力。成骨诱导培养基主要成分为β-甘油磷酸、地塞米松和抗坏血酸,其中地塞米松和抗坏血酸可促进骨成熟和细胞外基质中胶原的合成;β-甘油磷酸钠可促进细胞内钙盐沉积和钙化形成。茜素红染液可将钙盐沉积染成深红色得以在显微镜下观察。成脂诱导分化液中主要诱导因子有胰岛素、IBMX、罗格列酮、地塞米松,能够很好的促进间充质干细胞向脂肪方向诱导分化。这些结果均符合国际MSCs标准定义:即贴壁性,表达CD44、CD90、CD105等表面分子,不表达造血细胞表面标志物;在特定条件下可诱导分化为骨细胞和脂肪细胞[15]。
综上所述,本试验建立的该原代分离培养及鉴定方法简便快捷,可得到大量的马AD-MSCs。结果可靠、重复性和可操作性强,为间充质干细胞的临床应用提供稳定的来源。
