浸润性乳腺癌淋巴管侵犯的诺模图预测模型的建立
2020-08-03张东友
韩 云,张东友
(湖北省武汉市第一医院放射科,湖北 武汉 430022)
乳腺癌在女性恶性肿瘤中高居首位,其恶性程度较高,绝大多数以浸润性乳腺癌(invasive breast cancer,IBC)为主[1]。淋巴管侵犯(lymphatic invasion,LVI)是造成IBC不良预后的重要危险因素。既往研究[2-4]表明:乳腺癌LVI阳性术后复发及远处转移概率显著提升。同时,LVI也是制订乳腺癌治疗策略的重要参考依据:对LVI阳性的IBC患者而言,手术切除后浸润性癌残留的风险性大[5],此类患者难以实施保乳术,应推荐乳腺癌根治术,并在必要时扩大手术切缘,以减少术后复发或转移等不良预后的可能性[6]。目前,乳腺癌LVI的诊断仍依赖于术前穿刺或术后病理标本。术前病理穿刺由于穿刺组织不足以及穿刺位置的偏倚,漏诊率较高,除非阳性诊断,否则对临床并无太大指导意义,具有滞后性。因此,寻找一种术前诊断IBC合并LVI的工具成为亟待解决问题。MRI在乳腺癌的诊断中应用较广,能够预测乳腺癌的分子亚型[7]、组织学分级[8]及化疗药物的敏感性[9],是反映乳腺癌生物学行为及预后的重要影像学方案。本研究对乳腺癌术前MRI各征象及临床病理特征进行比较,建立能够可靠预测IBC合并LVI的诺模图,以期为临床提供更多的循证医学依据。
1 资料与方法
1.1 一般资料 回顾性分析我院2015年1月至2019年1月确诊的61例IBC的临床及影像学资料,均为女性,年龄39~67岁,平均(52.0±5.6)岁。纳入标准:患者均行手术切除治疗,并获得术后病理结果;MRI扫描前未行手术、化疗等乳腺癌相关性治疗;MRI扫描与手术间隔时间≤2周。排除标准:合并其他恶性肿瘤;MRI资料或临床病理资料不全者。
1.2 仪器与方法 采用Siemens veoio 3.0 T超导MRI扫描仪,8通道乳腺专业线圈。扫描序列及参数:轴位T1WI:TR 842 ms,TE 15.3 ms,矩阵500×237,视野19 cm×19 cm,层厚1 mm,无间隔,NSA 1;轴位T2WI fs:TR 8 465 ms,TE 62 ms,矩阵288×219,视野19 cm×19 cm,层厚1 mm,无间隔,NSA 1;DWI:TR 5 800 ms,TE 100 ms,矩阵128×128,视野19 cm×19 cm,层厚2 mm,层距1 mm,NSA 1;动态增强扫描(DCE-MRI)注射对比剂马根维显(拜耳),流率2~3 mL/s,剂量0.2 mL/kg体质量,TR 495 ms,TE 10 ms,矩阵320×320,视野19 cm×19 cm,层厚1.2 mm,层距1 mm,NSA 1。
1.3 图像分析 由2名具有10年以上胸部影像学诊断经验的高年资放射科医师在未知病理的情况下对术前MRI图像进行分析,包括:①肿瘤直径;②ADC值,在后处理工作站自动生成的ADC图上避开坏死、囊变及出血、钙化区域,在病灶实性部分勾画ROI,连续测量3次取其均值;③腺体类型,分为致密型、均衡型、疏松型、脂肪型;④乳腺背景实质强化,分为轻度-少量、中度-显著;⑤瘤周水肿,参照文献[10-12]报道,在肿瘤周围T1WI呈等或稍低信号(图1a),T2WI呈等或高信号片状异常信号带(图1b);⑥瘤内高信号,参照文献[13]报道,即肿瘤内部可发现T1WI低信号、T2WI高信号区域(图1c);⑦TIC,将TIC分为流入型、平台型及流出型[14];⑧环形强化,参照文献[15]报道,即肿瘤周围乳腺纤维腺组织在常规T1WI未见强化,而在DCE-MRI可见中度至显著环形强化(图1d)。当观察征象不一致时,由2位医师经讨论协商后达成一致。
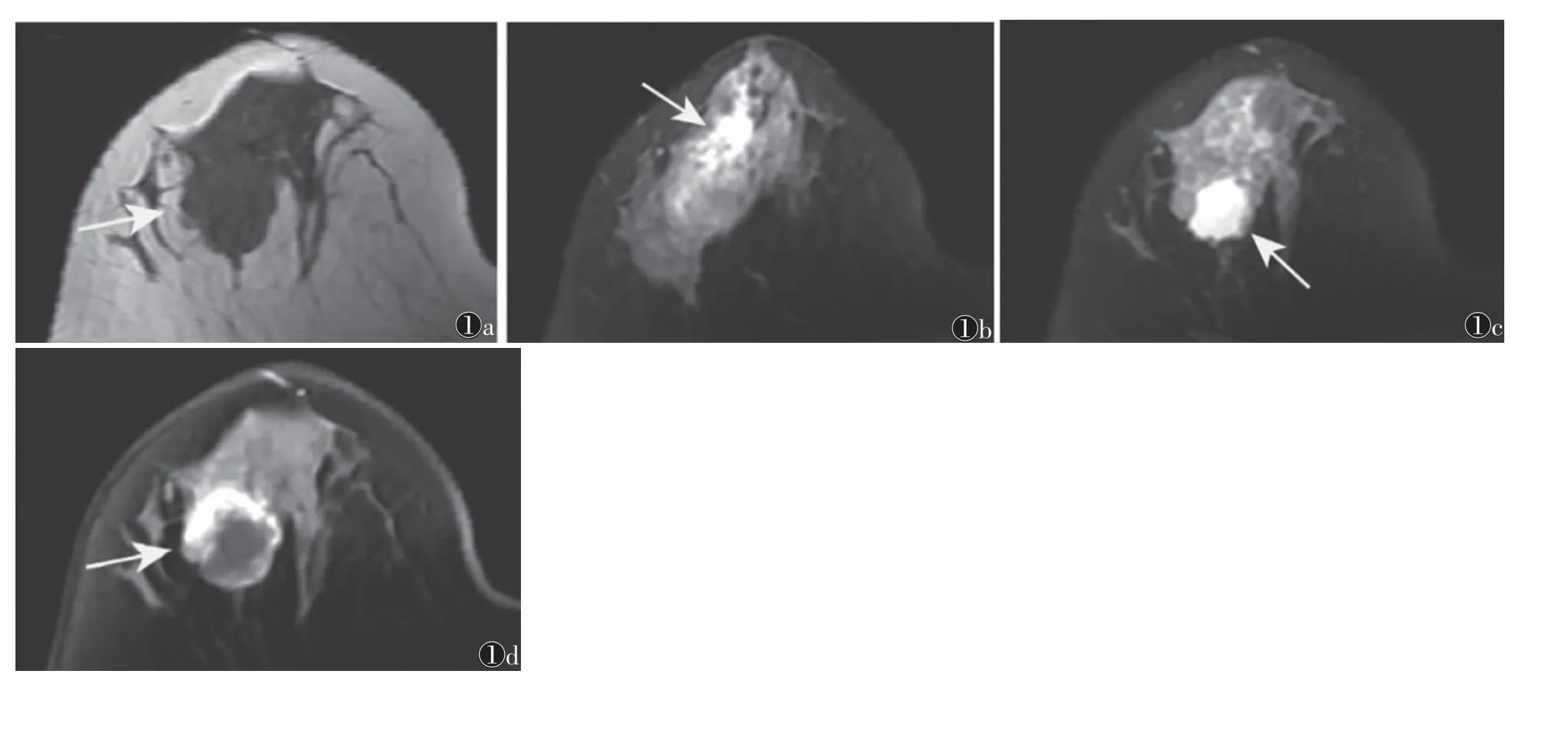
图1 女,45岁,浸润性导管癌图1a T1WI可见等信号团块影(箭)图1b T2WI可见瘤灶周围稍高信号片状水肿带(箭)图1c T2WI可见瘤灶内高信号区域(箭)图1d 动态增强扫描瘤灶周围可见环形强化区域(箭)
1.4 统计学分析 采用SPSS 19.0软件进行统计学处理。计量资料以表示,计数资料用率(%)表示。单因素分析:计量资料比较采用独立样本t检验,计数资料比较采用χ2检验。多因素分析:以Logistic回归分析IBC患者LVI的独立危险因素。
1.5 诺模图的构建、评估 使用R软件包(3.3.3)。依据Logistic回归结果建立诺模图,评估每类独立危险因素预测IBC患者LVI的可能性,整合后的各预测指标转化为0~100分刻度值表示,100分表示该预测指标的危险性最高。进一步以Boostrap法对模型进行内部抽样验证,计算一致性系数(consistency index,C-index),以C-index和校准曲线评估模型的校准度:其中,C-index区间值在0.5~1.0,越接近1.0说明该诊断模型的校准度越好;校准曲线显示模型预测值与实际观察值的散点落在靠近45°斜线附近时,说明模型预测值与实际观察值结果越接近。以诺模图预测模型的ROC曲线评估该模型的区分度,得出相应的AUC、敏感度及特异度。
2 结果
2.1 LVI阳性与阴性IBC患者各资料的单因素分析(表1) 61例中,LVI阳性率36.07%(22/61)。与LVI阴性比较,LVI阳性IBC患者淋巴结转移更多,ADC值更低,瘤周水肿、瘤内高信号及环形强化所占比例更高(均P<0.05);余术前临床病理及MRI资料差异均无统计学意义(均P>0.05)。
2.2 LVI阳性与阴性IBC患者各资料的多因素分析(表2) Logistic回归多因素分析结果显示:转移淋巴结(OR=4.601,P=0.042)、ADC值(OR=0.006,P=0.038)、瘤周水肿(OR=5.496,P=0.031)是IBC患者LVI阳性的独立危险因素。
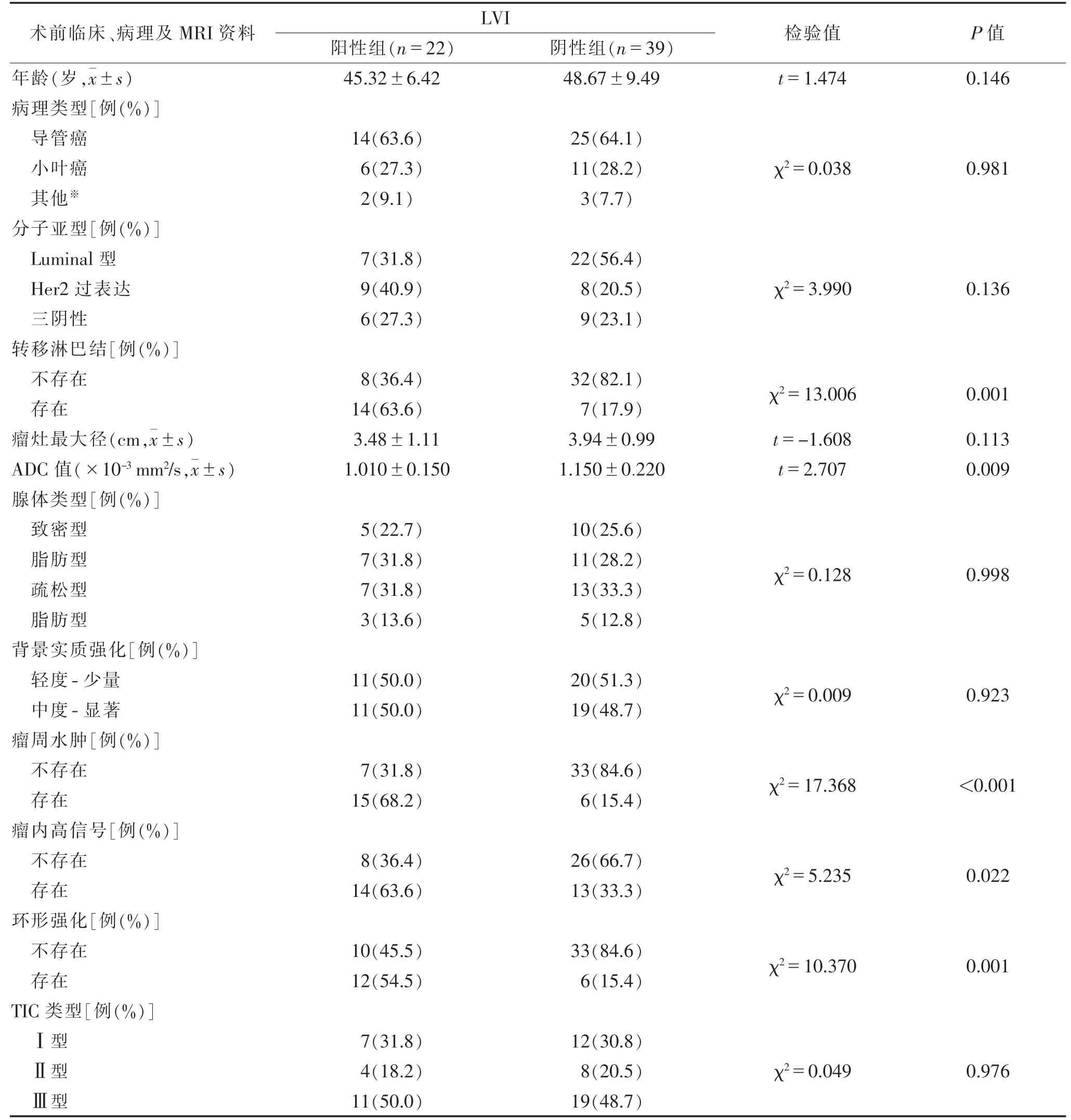
表1 IBC的LVI与术前临床、病理及MRI征象的关系
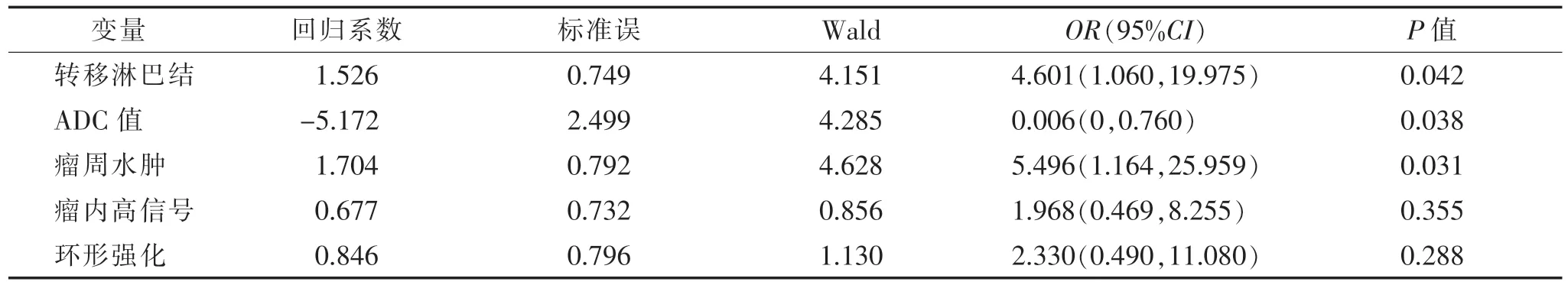
表2 LVI阳性与阴性IBC患者各资料的多因素分析
2.3 诺模图预测模型的构建及评估
2.3.1 诺模图的建立 基于Logistic回归多因素分析结果,将计数资料(ADC值)转化为二分类变量,依据其诊断LVI的最佳诊断阈值设为1.120×10-3mm2/s。将转移淋巴结、ADC值及瘤周水肿3个预测指标构建成诺模图(图2)。在该诺模图中,ADC值是预测IBC患者LVI的最大贡献因子(100分),其余依次为瘤周水肿(95.0分)及转移淋巴结(37.5分),总分值为0~260分,预测概率为0.01~0.95。
2.3.2 校准曲线(图3) 该模型通过Boostrap法行1 000次内部抽样验证后,得到C-index为0.909,模型预测值与实际观察值的平均绝对误差为0.048,提示该诺模图型具有较高的校准度。
2.3.3 诺模图预测模型的ROC曲线(图4) 该模型的AUC为0.909,诊断敏感度、特异度分别为81.80%、87.20%,提示该预测模型的诊断效能较高,具有较高的临床区分度。
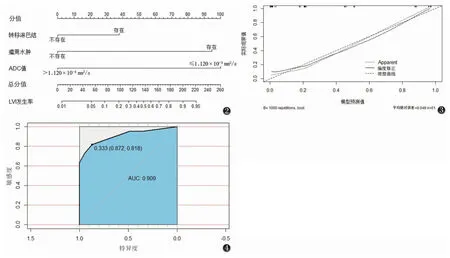
图2 预测浸润性乳腺癌(IBC)患者合并淋巴管侵犯(LVI)的诺模图图3 诺模预测模型的校准曲线图4 诺模预测模型的ROC曲线
3 讨论
IBC患者合并LVI,其恶性生物学行为显著提升,常伴随不良预后,有较高的T分期、且多存在淋巴结转移[16-17]。MRI对预测IBC患者LVI具有较高的应用价值。CHEON等[12]研究发现:IBC瘤灶周围出现长T1长T2的瘤周水肿带是LVI阳性的重要影像学特点,且瘤周水肿与LVI阳性同为IBC术后复发的独立危险因素。MORI等[18-19]研究指出:IBC合并LVI阳性的ADC值低于LVI阴性者。目前,针对乳腺癌LVI的诊断主要集中在单一的临床病理学指标或影像学表现,不同文献报道侧重点不同,其结果亦不尽一致。鉴于此,本研究对目前主流学术观点进行综合分析,通过构建诺模图预测模型,以期为乳腺癌LVI的诊断提供简便、直观、可视化的参考依据。
诺模图又称列线图,建立在多因素回归分析的基础上,根据回归模型中各个影响因素对结局变量的贡献程度(回归系数的大小),对每个影响因素的每个取值水平进行赋分,再将各个评分相加得到总评分,最后通过总评分与结局事件发生概率之间的函数转换关系,进一步计算出该个体结局事件的预测值,从而简化、直观、可视化表达预测模型中各变量之间的相互关系,使预测模型的结果更具可读性[20]。本研究发现:转移淋巴结、ADC值及瘤周水肿是诊断IBC患者合并LVI阳性的预测因子。既往研究[16-17]指出,乳腺癌的淋巴结转移主要以淋巴管途径为主,因此肿瘤发生LVI是癌细胞离开原发灶,继而发生远处转移淋巴结的先决条件。MRI显示瘤周水肿是评估IBC合并的一项重要半定量参数。IBC瘤周水肿出现的机制在于[10-12]:当肿瘤发生LVI时,由于新生幼稚血管通透性较大,以及癌细胞堵塞远端脉管造成的梗阻,易导致瘤周组织水肿带的形成,表现为T2WI片状高信号区。KOYAMA等[21]认为,恶性肿瘤发生LVI等恶性生物学行为时,伴随着瘤周间隙透明质酸含量升高,能够延长MRI T2WI的弛豫时间,形成T2WI的高信号区。此外,ADC值也是评估乳腺癌LVI的重要定量参数。相关研究[18-19]表明:ADC值能够反映水分子的扩散受限程度,ADC值较低说明水分子扩散受限更显著,表现为恶性肿瘤核质比更高、细胞致密性更大,故而存在较高的恶性程度,更易造成LVI,与本研究结果一致。
综上所述,本研究构建了IBC合并LVI的诺模图预测模型,将转移淋巴结、ADC值及瘤周水肿多个预测指标进行整合,按比例绘制成相应的具有刻度的直线表示的计算图表,对临床具有直观、简洁及可视化的参考意义,且该诺模图具备较优越的临床区分度与校准度。本研究的局限性在于:为单中心、回顾性分析,可能存在选择偏倚;入组例数较少,有待进一步扩充分析。
