从临床到影像认识早产儿支气管肺发育不良
2020-08-03李宁,柳澄
李 宁,柳 澄
(山东省医学影像学研究所,山东 济南 250021)
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是一种以肺泡和肺微血管发育不良为特征的慢性呼吸系统疾病,最常见于早产儿,尤其是极低出生体质量儿(very low birth weight,VLBW)。肺发育不成熟、急性肺损伤及损伤后的异常修复是其关键致病因素。经过50余年医学的发展,BPD的定义已由原来基于氧疗和机械通气所致肺损伤的经典型BPD转变为更侧重于肺发育不成熟基础上的新型BPD。作为一个连续变化的病理生理过程,先进的影像技术在揭示BPD的基本病理改变和长期预后评估中具有潜在价值。笔者从BPD定义演变、发病机制、病理基础、影像诊断及鉴别诊断等方面进行阐述,旨在为重新认识BPD及影像学在该病中的应用价值提供帮助。
1 BPD的定义及演变
BPD自提出以来其定义和诊断标准经过了不断的修改更新,其中影响较大、应用较广的主要包括以下3个阶段的定义。
1.1 BPD定义提出 1967年NORTHWAY等[1]首次报道并命名BPD,提出该病继发于严重呼吸窘迫综合征(respiratory distress syndrome,RDS)且接受长时间、高浓度机械通气治疗的早产儿,死亡率较高,X线胸片呈现逐渐加重的特征性改变,因此推断其为氧中毒、正压通气和气管内插管引起的肺损害的修复过程,新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)是原发疾病。随后,有学者[2]在NORTHWAY定义基础上加入了初步的量化标准,即产后28 d或矫正胎龄36周仍需氧维持的患儿。此后十几年,新生儿领域均采用这些定义对类似疾病进行诊断和研究。
1.2 新型BPD定义的提出 自20世纪八九十年代开始,围产期诊疗水平不断提高,伴随产前糖皮质激素、出生后肺表面活性物质及保护性通气策略的应用,BPD呈现出与以往不同的临床表现,包括VLBW比例增加,出生时仅有轻度或无呼吸系统疾病,而出生后数天或1~2周内逐渐出现氧或辅助通气依赖,不一定需机械通气或高浓度氧,X线胸片可无特征性改变等。因此,2000年6月美国国家儿童健康和人类发展研究所(National Institute of Child Health and Human Development,NICHD)等机构对BPD的概念和机制进行研究并制定了新的定义和诊断标准[3],即任何氧依赖超过28 d的新生儿即可明确诊断,并根据出院时需氧分数值的高低分为轻、中、重度。该定义中胸部影像表现不再作为BPD的诊断依据,而NRDS不再是BPD的唯一原发病因。此后发生BPD习惯被称为新型BPD而之前的BPD被称为经典型BPD。NICHD共识发表之后,多种不同的临床诊断标准及定义不断被提出并应用,其主要的差异集中在氧依赖时间及浓度上,这种仅依赖于临床治疗指标的定义,缺乏对肺组织病理、影像及肺功能改变的评估,有极大的主观性,不利于对疾病本身病理基础及发病机制的研究。
1.3 BPD诊断标准新共识 自NICHD共识发布以来,BPD的定义及临床诊断标准一直未能统一,主要原因在于缺乏病变组织学的客观证据,包括不再强调X线表现等影像学证据的应用,极易混淆具有类似临床表现的不同疾病,影响了临床对相似病变的干预。2018年NICHD研讨会对BPD进行了重新定义并达成了BPD诊断标准新共识[4],包括:①早产儿(胎龄<32周)伴持续性器质性肺病;②经影像学证实存在肺实质病变;③在矫正胎龄36周时超过连续3 d需一定方式的呼吸支持或氧疗才能维持动脉氧饱和度在90%~95%及以上者,根据氧依赖程度分为Ⅰ、Ⅱ、Ⅲ度。该共识考虑了目前极端早产儿这一特殊群体及新的无创通气模式,重新回到了经典的组织学表现,重新强调了影像学的价值,并强调BPD存在持续性肺实质病变的特征。这对从本质上了解BPD的致病因素及发生发展机制具有重要意义,并有利于建立统一完整的流行病学数据。
2 发病机制及病理基础
BPD是一种多因素疾病,其发展经历了早期的经典型BPD及20世纪八九十年代以来的新型BPD,两者在发病机制和病理组织改变上存在一定差异[5]。
2.1 经典型BPD发生于胎龄较大的早产儿,出生后感染、气压伤、氧中毒是主要致病因素,经过一系列氧化应激损伤、机械性损伤及肺组织的异常修复、血管重建等,最终引起广泛性肺组织损伤并触发一系列炎性反应进而导致肺纤维化的发生[1]。其主要病理改变包括严重的肺泡、气道损伤,一方面损伤后肺泡萎陷引起肺不张,另一方面肺泡的过度扩张、破裂形成囊泡及肺气肿;气道鳞状上皮化生、平滑肌过度增生导致弥漫性支气管管腔狭窄;多种炎症反应、肺组织异常修复等,严重者可导致肺纤维化。
2.2 新型BPD多发生于出生体质量<1 000 g或胎龄<28周的极不成熟早产儿,患儿出生时肺发育尚处于小管期末期或原始肺泡期,肺泡及肺微血管发育不成熟,极易受细菌、病毒,甚至氧气浓度的影响,进而促发一系列炎症反应、阻止肺泡化进程,从而导致肺泡及肺微血管的形态异常。临床工作中部分持续吸氧、接受辅助通气的早产儿并未发生BPD;而部分患儿即使将氧中毒、气压伤、感染等因素降至最小亦不能避免BPD,甚至不能影响其发生率,由此提出BPD存在遗传易感性。目前,普遍认为BPD是基因易感性婴儿处于易感窗期间受到宫内或出生后感染影响,改变了肺发育的进程所致[6]。其病理改变以肺泡和肺血管发育停滞为主要特征,表现为肺泡数目减少、体积增大、结构简单化和囊泡化,部分患儿存在肺血管病变及临床肺高压表现,而气道上皮、肺血管受损及纤维化较轻。但受护理水平及损伤程度的影响,新型BPD亦可进展为经典型BPD[6-7]。
3 影像学表现
尽管儿童胸部检查仍以X线为主,然而其在评估BPD患儿时有明显的局限性,尤其是无法真实反映早期和轻度BPD的病变特征。胸部高分辨率CT可准确显示以肺小叶为单位的肺结构改变。
BPD的HRCT表现可概括为密度降低和密度增高2种改变。密度降低包括2类:①低密度灶/区:呈片状或小叶性,相应区域肺血管分布稀疏,可双肺多发、范围不一,双侧不对称(图1,2)。在新型BPD定义之前,外源性表面活性物质和糖皮质激素还未应用于临床,低密度改变主要被认为是因气道狭窄导致的阻塞性肺气肿和肺组织过度充气引起的代偿性肺气肿,为BPD后遗症期的主要表现之一[8]。MAHUT等[9-10]分别对2组出生于1995年之后的BPD患儿进行肺部CT征象与肺功能相关研究后发现,大部分低密度改变与肺气肿无关,推测其可能是由于肺泡数目减少、体积增大、结构简单化和肺泡基底膜血管发育不良造成,或者反映了肺气肿前肺的变化,并推测这种改变是进行性的。这类患儿需进一步随访,以确定其肺部改变能否改善或加剧。②囊泡征,BPD患儿肺泡及肺血管发育不成熟,极易受内外源性因素影响而发生形态改变,其中肺泡受损扩张、破裂融合,可导致肺泡囊泡化。HRCT图像上囊泡征的病理基础即为肺泡的囊泡化。囊泡征可散在分布,也可区域性弥漫性分布,散在分布时多表现为大小不等的囊样改变,区域性弥漫性分布则表现为蜂窝状改变。囊泡征多见于中重度BPD慢性期或后遗症期(图3,4)。
密度增高包括3类:肺内线状、斑片状密度增高与胸膜下三角形密度增高,这2类可相互延续(图1,3,4),且数量均与机械通气时间长短及围产期护理水平相关,并与功能残气量呈负相关,提示肺泡受损萎陷、肺不张和肺纤维化的发生。伴随肺损害修复,肺组织进一步纤维化,可呈现与成人肺纤维化类似的网格状改变(图3,4)[9]。另一类是磨玻璃密度,常提示早期肺内渗出性改变,可与低密度区相间分布,呈马赛克分布,亦可因后期肺间质异常修复增厚形成(图3,4)。另外,早期经典型BPD由于机械损伤或氧化损伤造成的支气管壁厚、管腔狭窄在新型BPD中已不常见,也反映了围产期诊疗水平的提高。
早产儿胸部CT表现为不均匀低密度、线性或胸膜下三角形高密度对BPD诊断具有提示意义,而肺内网格、囊泡征对中重度或慢性期BPD具有影像确诊意义[11-12]。值得注意的是,伴随围产期护理及诊疗水平的提高,临床上症状轻微、影像表现不典型的BPD越来越多,但目前尚缺乏BPD早期HRCT表现及长期随访结果的系统性资料。
4 鉴别诊断
BPD具有一个连续变化的病理生理过程,其确诊依赖于一定的临床指标,在病变初期或进展过程中仍需与其他呼吸系统疾病相鉴别。
4.1 NRDS又称新生化肺透明膜病。BPD初期影像征象与NRDS类似,表现为肺野透光度降低,肺内广泛分布细颗粒影,严重者呈白肺表现,但NRDS患儿在临床应用肺表面活性物质后,肺部影像表现改善迅速,而BPD肺部病变为持续性、进展性。
4.2 Wilson-Mikity综合征(WMS) 又称肺发育不成熟,是一种少见的婴幼儿呼吸道疾病,亦多见于早产、低出生体质量儿,病程后期也可见囊泡影。但WMS无氧依赖史且预后较好。可根据病史和影像随访对WMS与BPD进行鉴别诊断。
4.3 湿肺、肺出血 以磨玻璃密度的肺泡内渗出和网状、线样增厚的间质积液为特征,可见局限性肺气肿造成的透亮区,但病程短、影像表现变化快,可与BPD进行鉴别诊断。
4.4 闭塞性细支气管炎(bronchiolitis obliterans,BO) 是多种因素导致的细支气管狭窄或阻塞的一种少见且不可逆性阻塞性肺疾病,儿童以感染后BO(post-infectious BO,PIBO)常见。BPD中肺泡萎陷与过度充气扩张相间分布时可呈马赛克表现,类似于PIBO的“马赛克灌注”,但后者多继发于严重的下呼吸道感染,以细支气管壁厚、部分或完全闭塞为特征,肺内网格状改变不多见,且无早产及氧依赖史。
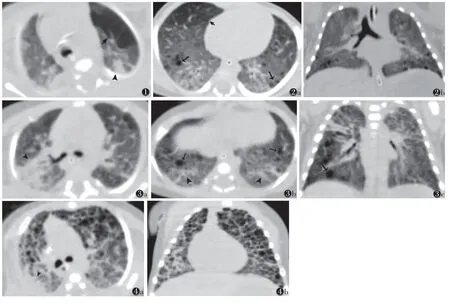
图1 男,出生时胎龄27+5周,体质量1 260 g,诊断为支气管肺发育不良,生后57 d CT示双肺密度不均,见胸膜下密度增高灶(箭头),左肺上叶见片状低密度区(短箭)图2 男,出生时胎龄27+6周,体质量1 170 g,诊断为支气管肺发育不良(轻度),生后47 d横断面(图2a)和冠状面(图2b) 胸部CT示双肺密度不均,见片状低密度区(短箭),肺野内散在小囊泡,以双肺下叶为主(长箭)图3 男,出生时胎龄26周,体质量640 g,诊断支气管肺发育不良(中度),生后60 d横断面(图3a,3b)和冠状面(图3c)胸部CT示双肺密度不均匀,广泛分布条片状密度增高(箭头),肺内见片状低密度区及散在分布大小不等囊泡(长箭)图4 男,出生时胎龄26+4周,体质量990 g,诊断为支气管肺发育不良(重度),生后45 d横断面(图4a)及冠状面(图4b)肺部CT示双肺呈网格状改变,散在大小不等囊泡,右肺上叶胸膜下实变(箭头)
4.5 先天性肺囊腺瘤样畸形(congenital cystic adenomatoid malformation,CCAM)是指肺局部发育不全、终末细支气管过度生长形成的肺组织囊性改变和腺瘤样改变混合的一种先天性畸形,目前统一归入先天性肺气道畸形中,常于围产期发现,病变多局限于1个肺叶或肺段,呈大囊、小囊、囊实性等多种表现,可表现为薄壁或伴实性成分。多因继发肺部感染表现出临床征象,易与BPD鉴别。
总之,BPD是在肺发育不成熟基础上多种产前产后因素共同作用导致肺泡和肺微血管发育受阻的一种慢性肺部疾病。围产期诊疗及护理水平的提高可改善BPD的预后,尤其是肺纤维化的程度,但无法改变因早产造成的肺发育停滞。目前新生儿肺部检查仍以常规X线为主,缺乏对BPD特征性CT征象的描述,尤其是BPD发病初期的影像征象。伴随新型BPD发病率不断上升,开展HRCT在BPD早期诊断及预后评估中的应用具有重要意义。
