基于色差计技术区分不同原藻产地干紫菜(条斑紫菜)*
2020-08-02尚浩江胡传明
尚浩江,胡传明**,周 伟,2
(1.江苏省海洋水产研究所,江苏南通 226007;2.江苏省农业种质资源保护与利用平台,江苏南京 210014)
0 引言
条斑紫菜(Pyropiayezoensis)隶属于红藻门(Rhodophyta)红毛菜科(Bangiaceae),叶状藻体呈紫黑或紫褐色。基部为圆形或心脏形,边缘有皱褶,细胞排列整齐,雌雄同株[1]。条斑紫菜作为东亚和东南亚重要的海产品已经有几千年的历史[2],它富含蛋白质、不饱和脂肪酸、呈味氨基酸与膳食纤维,营养丰富,是世界上最具经济价值的栽培海藻之一[3]。干紫菜(条斑紫菜)是由条斑紫菜原藻加工而成,是调味紫菜、烤紫菜等食品的初加工品,也是紫菜专业交易市场唯一的交易品。
目前受全球气候变暖的影响,我国条斑紫菜栽培区向北扩展,栽培主产区由江苏南通沿岸海域北移至江苏北部、山东和渤海湾沿岸海域。紫菜栽培区的北移使得紫菜栽培面积增大,紫菜产量增加,但同时也带来了一些问题,如部分干紫菜加工企业不按实际原藻栽培海域填写“原藻产地”这一重要信息。不但如此,随着近年来中国进口韩国紫菜原藻数量和比例的逐年增加[4],甚至有的紫菜加工企业将韩国产地的紫菜与江苏产出的紫菜混淆。运用现行的干紫菜质量评价方法[5],很难通过肉眼鉴别出干紫菜的原藻产地,这严重影响了专业紫菜交易市场的秩序。
干紫菜是由紫菜原藻加工而来的。由于紫菜的加工工艺属标准化加工[6],加工过程没有发生熟化,从紫菜原藻加工为干紫菜的过程中颜色变化较小,因此干紫菜的颜色主要由紫菜原藻决定。紫菜原藻颜色是由藻体内叶绿素、藻红蛋白、藻蓝蛋白、类胡萝卜素等物质决定的[7],这些物质在藻体内含量与环境因素有很大关系,如贫瘠海域条斑紫菜的色素含量低,大部分呈淡黄棕色,与肥沃海区的藻体颜色有显著差别[8]。因此,原藻产地是影响干紫菜品质的重要因素。
干紫菜颜色差异的分析可以通过色差计技术实现。色差计是通过标准光源与观察角度,对反射光谱数据进行采集,从而计算出相应的色度与色差值,相对全面地反映物体表面的色彩与光泽。色差计技术主要是通过International Commission on Illumination (CIE)制定的L*a*b*色空间原理来反映物体的颜色及色差。目前色差计技术和L*a*b*原理在农业和食品领域中已有较多的研究及应用,如用于确定肉类颜色对消费者购物趋向的影响[9];分析生产因素和肌肉性状对羊肉L*a*b*值的影响[10];测定苹果受损部位和氧化部位的颜色与果肉硬度、冲击高度以及苹果品种的相关性[11];预测乌姆桑椹果实在加工过程中花青素的降解情况[12];对库尔勒香梨果实进行分级并确定适宜采摘时间[13];确定蚕豆外皮、子叶颜色与总游离酚类物质、总单宁和原花青素含量的关系[14];测定小麦面粉的色泽[15]等。但是目前未见运用色差计技术进行干紫菜色差研究的相关报道。
本研究运用色差计技术结合多元变量分析对不同原藻产地干紫菜进行分析,探索不同原藻产地干紫菜的颜色差异,探讨光谱反射率的特征差异,拟为不同原藻产地干紫菜的科学鉴定提供技术支撑,为干紫菜的颜色分类奠定科学基础。
1 材料与方法
1.1 材料
干紫菜(条斑紫菜)分别于2018年2月1日购自江苏省如东县天一紫菜交易市场,2018年2月2日购自江苏省海安县紫菜交易市场,干紫菜尺寸为210 mm×190 mm。干紫菜的原藻产地分别为江苏南部的竹根沙(zgs)、蒋家沙(jjs)、高泥(gn)、东沙海区(ds)和山东威海海区(wh)。干紫菜样品共62份,每份样品20张,样品密封后放入-20℃冰箱保存备用。
1.2 方法
1.2.1 L*、a*、b*色度值测量
采用柯尼卡CM-700D色差计对62份干紫菜样品进行测量,采用Spectra Magic NX软件计算L*、a*、b*色度值。测量前先对色差计进行校零和白板校正,且测量过程中保持周围光强、温度和湿度一致,确保测量结果的准确性[16]。测量方式为每份干紫菜随机抽取6张,相互重叠防止漏光,每张干紫菜随机抽取6个点进行测量。测量采用ø3 mm的目标罩,选择10°角标准观察者(CIE1964),光源为D65标准光源,采用SCI模式(包含镜面反射光),采集得到反射光谱360—740 nm波长处的吸收值(即在360-740 nm的光谱反射率),
L*=116(Y/Y0)1/3-16,
a*=500[(X/X0)1/3-(Y/Y0)1/3],Y/Y0>0.01,
b*=200[(Y/Y0)1/3-(Z/Z0)1/3] 。

1.2.2 数据处理
将L*、a*、b*色度值按样品进行算术平均数处理,用t检验对江苏南部产区和威海产区样品的L*、a*、b*平均色度值进行分析。提取干紫菜360—740 nm的光谱反射率,用SIMCA 14.1软件进行主成分分析(Principal Components Analysis,PCA),绘制得分图与荷载图,分析得分图中数据的集散程度;对光谱反射率进行par数据缩放处理,并进行正交偏最小二乘法-判别分析(Orthogonal Partial Least Squares Discrimination Analysis,OPLS-DA),生成S-plot图(S-plot图提供了OPLS和OPLS-DA预测组件加载的可视化,用于可视化X变量与预测得分t[1]之间的协方差和相关结构,其可以通过SIMCA直接生成)。其中P1与P(ccor)1轴分别代表强度(模型化协方差)和可靠性(模型化相关性),离散较大的变量视为标志性变量[17],建立预测模型并进行200次模型验证,进而得到Variable Importance for the Projection (VIP)预测值(一般认为VIP值在1以上为标志性差异)。
2 结果与分析
2.1 不同原藻产区干紫菜的颜色差异
在色差数据表达中,总色差值ΔE数值越大说明色差越大,一般情况下ΔE在1.5时目视可以分辨。而通过计算得出原藻产于江苏南部海区与威海海区的干紫菜总色差值ΔE为1.39,说明2个海区之间的干紫菜用肉眼难以分辨出差别。
如图1所示,江苏南部蒋家沙、东沙、竹根沙和高泥4个产区的a*值和b*值均高于威海产区。t检验结果显示江苏南部产区和威海产区紫菜样品中L*、a*、b*的P值分别为0.17,0.01,0.01 (若P<0.05存在显著性差异,若P<0.01则存在极显著性差异),即江苏南部产区的干紫菜在a*、b*值上与威海产区的干紫菜存在显著性差异,说明威海产区的干紫菜颜色相较于江苏南部产区的干紫菜颜色更深,更偏向于蓝色和绿色。

图1 不同原藻产区的干紫菜L*、a*、b*平均值Fig.1 Average L*,a*,b* value of dried laver in algae production area
2.2 不同原藻产区干紫菜的光谱反射率差异性
如图2所示,各产区的样品在360—500 nm的差别较小,在500—670 nm有较大差别,其中高泥产区的样品反射率较大,威海产区的样品反射率较小。而所有样品在700—740 nm处反射率变化趋势保持一致,且威海样品的值最小,高泥样品的值最高。
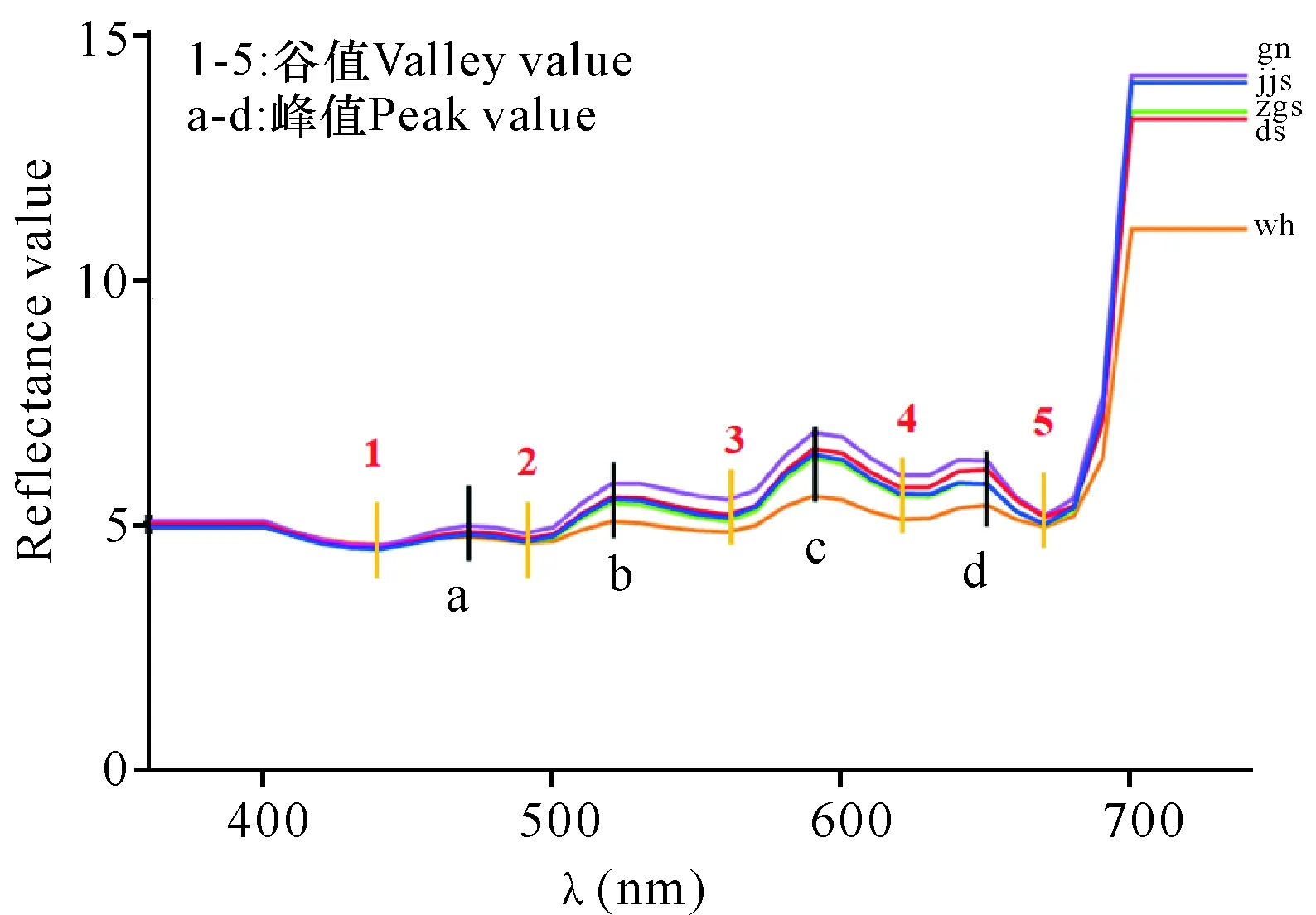
图2 不同原藻产区的干紫菜平均光谱反射率Fig. 2 Average spectral reflectance of dried laver in different origins
将62份样品按原藻产地分为江苏南部产区和威海产区,对这些样品在360—740 nm波长下的光谱反射率进行PCA分析,选取主成分贡献率最大的2个主成分,荷载图中每一个载荷量表示主成分与对应变量的相关系数,如果是负值,说明是负相关。如图3所示,其第1主成分贡献率为63.3%,第2主成分贡献率为27%,这2个主成分的累计贡献率达到95%。威海产区样品的光谱反射率大多位于在第1主成分的负半轴和第2主成分的正半轴,有1份样品位于第1主成分正半轴和第2主成分正半轴;而江苏南部产区仅有4份样品位于第1主成分的负半轴和第2主成分的正半轴。2个产区的样品能够相对地区分开。

图3 不同原藻产区干紫菜光谱反射率的主成分得分图与荷载图Fig.3 Principal components score diagram and load diagram of the reflectance of dried laver from different algae production area
荷载图中显示360—500 nm和660 nm位于第2主成分的正半轴,对第2主成分有正影响;510—650 nm和680—740 nm位于第2主成分的负半轴,对第2主成分有负影响,即在这个区间存在较大差异。而360—740 nm都在第1主成分的正半轴上,无法得出在第1主成分上的差异性。通过OPLS-DA分析,数据经过par缩放后得到S-plot图(图4),可以发现,700—740 nm波长落于坐标轴左下方,与其他波长有较大分离,为区分干紫菜光谱反射率的标志性变量。通过建立预测模型,经过200次验证,R2(X)与Q2分别为0.62,0.60,表示预测效果较好。如图5所示,700—740 nm波长的VIP值大于2,580—610 nm、640 nm和690 nm波长的VIP值大于1,即江苏南部产区与威海产区干紫菜的光谱反射率在波长700—740 nm存在显著差异,在580—610 nm、640 nm和690 nm波长下有较大差异。因此可认为700—740 nm、580—610 nm、640 nm和690 nm波长为区分2个原藻产区干紫菜的特征差异波长。

图4 不同原藻产区干紫菜光谱反射率OPLA-DA分析S-plot图Fig.4 OPLA-DA analysis S-plot of reflectance of dried laver in different algae production area
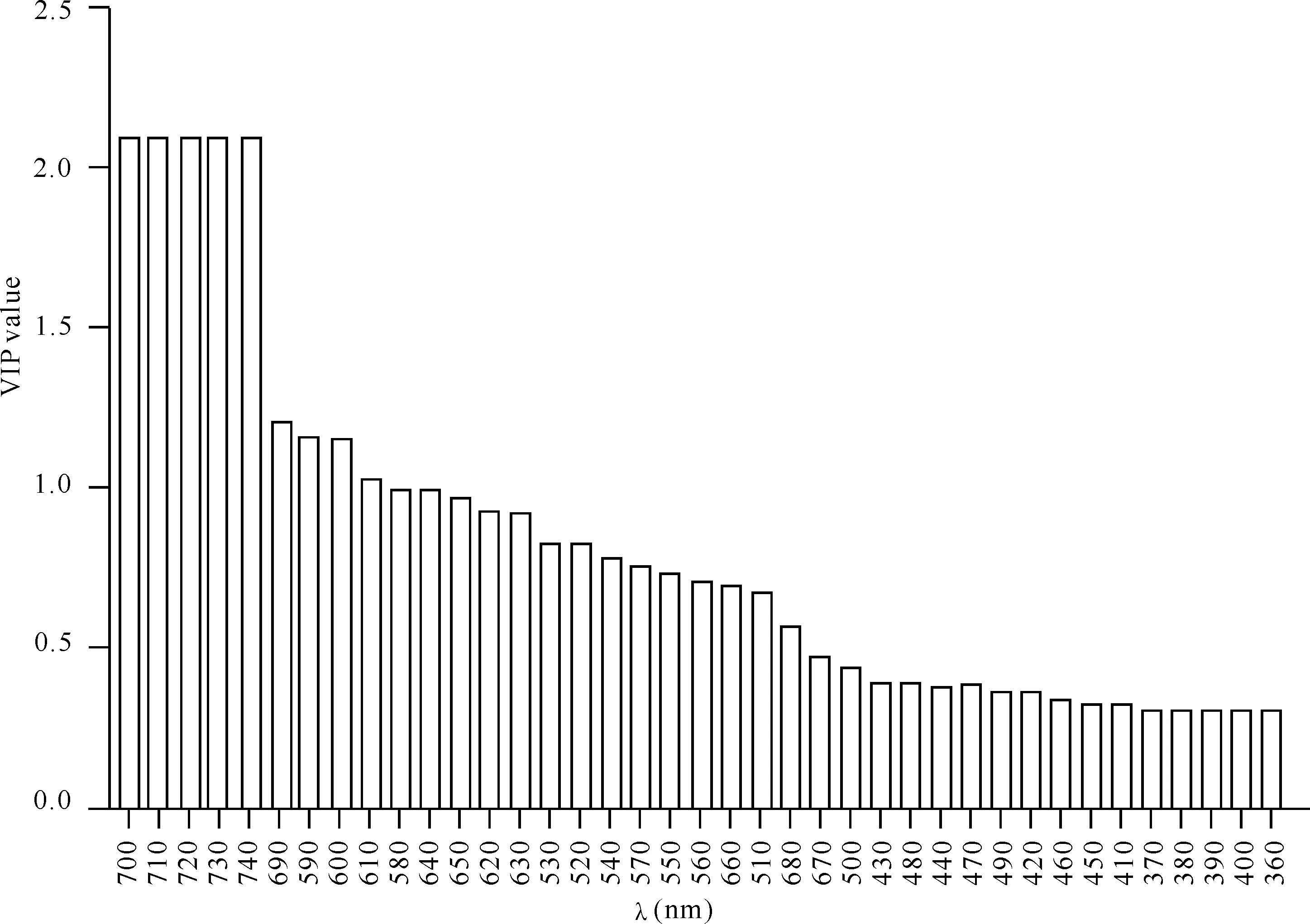
图5 不同原藻产区干紫菜反射光谱率VIP预测分析图Fig.5 VIP predictive analysis chart of reflectance of dried laver in different original Pyropia production areas
3 讨论
随着全球气候变暖,我国农产品种植北界发生了不同程度的北移[18],条斑紫菜栽培区由江苏沿岸逐渐向北扩展。江苏连云港海区的条斑紫菜栽培面积逐年增加,截至2019年已达2.3万hm2;山东威海海区也开始大面积栽培条斑紫菜;渤海湾海区条斑紫菜的栽培试验也取得了成功[19]。随着条斑紫菜栽培区北移的发展,利用色差计技术将不同原藻产地的干紫菜进行区分,对保护特定栽培区的紫菜产品较为重要和必要。
颜色是干紫菜品质评价中重要的参考指标之一[5],紫菜的颜色是紫菜细胞中含有的各种色素表现出来的结果,所含色素比例不同,其外观颜色也有所不同,而干紫菜的颜色是由各种色素的反射光形成的[1]。紫菜藻体所含色素比例会受其栽培海区的光照强度、温度、海水营养丰度、盐度、pH值和海水浊度等因素的影响[19-21]。通过比较2个海域的环境因素,发现冬季江苏南部海区秋季海水表层温度为(8.62±2.30)℃,高于威海海区的(7.15±0.27)℃(2015年)[22];江苏南部海区秋季海水表层的NO3-N浓度均值为306 μg/L,NH4-N为62.2 μg/L,PO4-P为17.1 μg/L(2014年),而威海海区秋季海水NO3-N浓度达171 μg/L、NH4-N为50.5 μg/L、PO4-P为9.2 μg/L (2014年)[23-24],江苏南部海区的海水营养丰度高于威海海区。因此,推测温度和营养盐造成2个海区的干紫菜颜色差异。
为探究不同原藻产区干紫菜的光谱反射率所表示的含义,我们将图2与文献[25-26]的条斑紫菜吸收光谱图以及高洪峰[27]研究的紫菜藻胆蛋白吸收光谱图进行比较,发现图2中a、b、c、d这4个峰值的波长与条斑紫菜吸收光谱的谷值波长基本吻合。图2中1,2,3,4,5处谷值的波长与条斑紫菜吸收光谱的5个峰值波长相对应,而这5个峰值主要由叶绿素α和β-胡萝卜素,藻红蛋白和β-胡萝卜素,藻红蛋白,藻蓝蛋白,叶绿素α吸收所致[27-28],这进一步验证了不同海区条斑紫菜所含色素比例的差异性。
与吸收光谱测量技术相比,反射光谱测量技术的优点在于数据采集速度快,通过采集到的反射光谱率可以立即计算出所测物的色度值与色差值,相对全面地反映物体表面的色彩与光泽。相较于分光光度计,色差计有手持式和便携式,更便于携带和户外操作;其缺点是测量精度低(目前主流色差计以10 nm为刻度单位,而分光光度计可以精确到1 nm以下),将色差计技术与多元变量分析结合可以弥补这一不足。
对于反射光谱率主成分得分图中有2个置信区外的数据,通过寻找原样品后发现这2份样品杂质较多,杂质的影响造成了测量的误差,导致数据点落于置信区外,说明通过色差计技术还可以检测出含有杂质的干紫菜。
4 结论
本研究采用色差计技术结合多元变量分析的方法分析了不同原藻产地干紫菜在色差上的差别,发现在相同光源照射条件下,原藻产地为江苏南部海区的干紫菜样品的a*值和b*值均高于威海海区的样品,且存在显著性差异,即威海海区的干紫菜相较于江苏南部海区的干紫菜颜色更显蓝绿色。同时,原藻产地为江苏南部产区的干紫菜光谱反射率在500—740 nm波长下均大于威海海区样品,且在700—740 nm的反射波长下存在标志性差异。
