环丙沙星胁迫猪粪生物转化中抗性基因微生物响应分析
2020-08-01夏湘勤唐朱睿黄彩红席北斗
夏湘勤, 唐朱睿, 黄彩红*, 席北斗, 郭 威
1.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012
2.中国环境科学研究院, 国家环境保护地下水污染过程模拟与控制重点实验室, 北京 100012
3.桂林理工大学环境科学与工程学院, 广西 桂林 541006
抗性基因(Antibiotic Resistance Genes, ARGs)是导致微生物拥有抗生素抗性的元凶,特别是存在于致病菌中时,会造成严重环境健康风险. 据WHO (World Health Organization, 世界卫生组织)2018年发布的数据显示,无论发达国家还是发展中国家抗生素耐药菌发病率均居高不下[1]. 在欧盟地区,每年因耐药菌感染造成超过 25 000×104人死亡,并造成经济损失超过15×108美元[2]. 在美国,每年至少200×104人的疾病和 23 000 人的死亡是由于抗生素抗性所导致[3]. 而此次新型冠状病毒肺炎疫情期间,医疗卫生体系中大量药物使用,也可能会加剧ARGs在环境中的累积和传播. 这些ARGs能够转移至与人类相关的微生物,如转移至某些烈性致病菌(如鼠疫病原菌等),将会对人类健康造成威胁. 因此,微生物耐药性是一种“不定时炸弹”,一旦暴发后果不堪设想. WHO已宣布在全球范围部署防控ARGs,并将微生物耐药性列为21世纪人类面临的最大挑战之一[4].
我国是世界上最大的抗生素生产国和使用国,仅2013年,生产了16.20×104t抗生素,其中48%被用于医学使用,其余部分则用于畜禽养殖业[5]. 而氟喹诺酮类抗生素(Fluoroquinolones, FQs)作为一种广谱抗菌抗生素广泛用于畜禽养殖,其中以环丙沙星(Ciprofloxacin, CIP)为典型代表[6]. 我国畜禽粪便中环丙沙星平均残留浓度在0.49~45.6 mgkg之间[6-7]. 然而,大多数抗生素不能被动物完全代谢,其摄入剂量的30%~90%以原型药物和代谢产物形式排出[8]. 因此,畜禽粪便中残存抗生素会通过选择性压力诱导ARGs的产生,使其成为潜在的耐药菌和ARGs储藏库[9-10]. 2015年我国畜禽粪污产生量约为1.91×109t,其中猪粪产生量为6.5×108t,猪粪在总畜禽粪污中占比最高[10],且猪粪中ARGs丰度要高于其他畜禽粪污[11],表明猪粪中ARGs的环境风险更大.
好氧堆肥作为无害化和资源化再利用有机固废的一种重要技术手段,其产品广泛用于农业、园艺和土壤修复[12]. 好氧堆肥能够有效削减抗生素进而减少残留抗生素进入土壤环境,而ARGs具有可复制性、可在微生物间水平转移等生物学特点,使得ARGs的削减在堆肥过程中变化规律不尽相同. 笔者所在课题组研究了生活垃圾好氧堆肥过程中ARGs的丰度变化趋势及影响因素,发现在堆肥高温期ARGs丰度显著升高,腐熟阶段降低. 同时,经过堆肥处理能够削减致病菌的丰度,这些致病菌种包括一些潜在宿主微生物[13]. 猪粪中往往会残留一定量的抗生素,可能会胁迫产生ARGs,鉴于猪粪产生量大,且当前我国畜禽粪便资源化技术与管理中尚没有对ARGs等累积型新兴污染物的控制标准. 因而,有必要开展猪粪堆肥过程中ARGs丰度特征与影响因素研究. 基于此,该研究选取猪粪作为研究对象,选择环丙沙星作为典型抗生素类型,以关键微生物解析为重点,研究残留环丙沙星猪粪堆肥过程中ARGs丰度变化特征及其与微生物响应关系,为猪粪无害化促进资源化利用提供科学支撑.
1 材料与方法
1.1 堆肥与样品采集
猪粪物料取自北京东华山村沼气站(猪粪中环丙沙星本底值的平均浓度为0.89 mgkg),锯末取自附近木材厂,环丙沙星(C17H18FN3O3)购自上海MACKLIN公司,堆肥物料的理化性质见表1. 两台自动化堆肥设备购自日本静冈机械有限公司,高0.4 m,直径0.33 m,总容积0.034 m3,设有渗滤液收集装置、供气计量系统及温度调节装置.

表1 堆肥初始物料理化性质
采用特制有机玻璃隔板将堆肥装置分为4个反应区,即4个堆体,每个堆体中添加猪粪和锯末共8 kg. 猪粪和锯末按4∶5的质量比混合,使得CN为25∶1 左右,含水率为57.84%~60.00%,保证连续通风状态,通风量为4 Lmin. 4个反应区环丙沙星添加量分别为0 mgkg(CK)、25 mgkg(A25)、50 mgkg(A50)、100 mgkg(A100). 堆肥温度区间为22~58 ℃,高温期(>50 ℃)四个堆体均持续保持5~7 d. 好氧堆肥周期为46 d,分别于第0、3、7、14、26、46天进行样品采集,均在堆体不同深度(表层以下5、10、15 cm处)取样,过20目(0.9 mm)筛并充分混合后,分装至自封袋(约50 g),干冰储存,用于后续试验开展.
1.2 DNA提取和实时荧光定量PCR
采用FastDNA SPIN Kit for Soil试剂盒提取样品总DNA,于-80 ℃下保存待分析. 预试验后,选择4个质粒介导喹诺酮类药物耐药基因(Plasmid-mediated Quinolone Resistance Genes, PMQR)和1个可移动遗传元件(Mobile genetic elements, MGEs)作为目标基因,即(qnrS、qnrD、gyrA、parC)和一个整合子(intl1),进行实时荧光定量PCR (qPCR)检测,设3次重复. PCR扩增条件可参考文献[13],引物设计如表2所示. qPCR定量分析后的绝对丰度用copiesg表示.
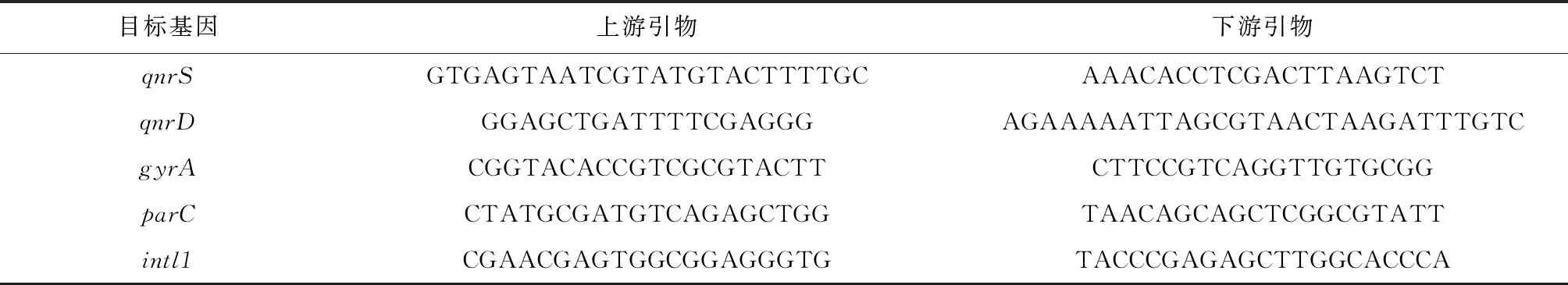
表2 目标ARGs和引物设计[14-16]
1.3 16S rDNA基因测序
将DNA样本送上海美吉生物制药科技有限公司进行16S rDNA基因测序. 测序平台为Illumina MiSeq,构建MiSeq PE300库. 用引物338F (ACTCCT ACGGGAGGCAGCAG)和806R (GGACTACHVGGGT WTCTAAT)对细菌进行PCR扩增. 琼脂糖凝胶电泳检测DNA完整性,OD260 nm和OD280 nm均高于1.55,满足后续试验条件. 使用正式的PCR测试TransGen AP221-02: TransStart Fastpfu DNA聚合酶,20 μL反应系统包括10 ng模板DNA、0.8 μL正向引物(5 μmolL)、0.8 μL反向引物(5 μmolL)等. PCR热循环条件:95 ℃,持续3 min;35个循环,95 ℃ 30 s、55 ℃ 40 s、72 ℃ 45 s;72 ℃下延长10 min. PCR产物经2%琼脂糖凝胶电泳检测,按97%的相似度,对所有序列进行OTU分区并进行生物信息统计分析.
1.4 数据统计与分析
利用SPSS 25.0软件和Origin 6.0软件对ARGs、MGEs和细菌群落的丰度及其相关性进行分析. ARGs丰度变化及微生物群落变化图用Excel 2016软件和R语言(pheatmap包)绘制. 根据ARGs、MGEs和微生物间的Pearson相关系数(P<0.05),采用Cytoscape 3.7.1软件对其进行网络分析.
2 结果与讨论
2.1 ARGs与可移动遗传元件丰度变化
依据堆体(CK、A25、A50、A100) 46 d内的温度变化,将堆肥的3个典型阶段划分如下,即升温期(第0~2天)、高温期(第3~10天)和腐熟期(第11~45天). 其中,腐熟期也是堆肥的降温阶段,进一步分为降温前期(第11~27天)和降温后期(第28~46天). 所取堆肥样品共24个,均检测出4个喹诺酮类抗性基因(qnrS、qnrD、gyrA、parC)和一个移动遗传元件(整合子intl1).
2.1.1喹诺酮类ARGs的丰度变化
堆体ARGs总丰度变化如图1所示,经堆肥处理后,仅A50堆体中喹诺酮类ARGs总丰度升高,由初期的1.17×106copiesg升至4.37×106copiesg,增加了2.73倍;其他3个堆体(CK、A25、A100)中喹诺酮类ARGs总丰度均被削减,分别降低了95%、81%和98%. 在堆肥腐熟产品中,喹诺酮类ARGs总丰度大小依次为A50>CK>A100>A25. 其中,CK的喹诺酮类ARGs先在高温期第7天升高至峰值,随后降低,最后在腐熟期第46天略升高. 处理组A25和A100堆体的喹诺酮类ARGs总丰度变化趋势相似,均在高温期第7天降至最低水平,随后在腐熟期略升高. 从堆肥第0天到高温期第7天,对比4个堆体中ARGs变化丰度发现,CK组中喹诺酮类ARGs丰度升高,其他3个堆体(A25、A50、A100)中丰度则降低,分别降低了90%、85%和99%. 高温期A25、A50和A100堆体中喹诺酮类ARGs均降低,这可能是由于添加环丙沙星影响了相关微生物菌群,从而影响喹诺酮类ARGs丰度变化. ZHANG等[17]发现抗生素施加产生的选择性压力对微生物群落有显著影响,与该研究的结果类似.
各堆体中ARGs丰度变化具有差异性,结果(见图1)显示,gyrA的绝对丰度最高,其平均丰度在1.34×105~4.21×105copiesg之间,qnrS平均丰度在5.48×104~1.58×105copiesg之间,qnrD和parC的平均丰度甚至更低,分别在1.10×104~2.99×104、3.28×104~7.29×104copiesg之间,其平均丰度大小依次为gyrA>qnrS>parC>qnrD. A50堆体中,3个基因qnrS、qnrD、gyrA丰度显著升高导致ARGs总丰度升高,而parC的丰度略有降低,对其总丰度升高趋势的影响较小. 而堆肥第0天到高温期第7天,CK组中喹诺酮类ARGs总丰度升高,是由于除qnrD丰度降低了41%外,qnrS、gyrA和parC的绝对丰度均显著升高(P<0.01),分别升高9.3、5.4和11.5倍,说明qnrS、gyrA和parC是导致CK堆体高温期ARGs总丰度升高至峰值的主要贡献基因. 目前研究[17-18]认为,堆肥过程中微生物群落结构的组成变化是影响抗生素ARGs变化的主要原因. Selvam等[14,19]研究发现在堆肥高温期过后,四环素ARGs与四环素类抗性细菌的变化都出现先升后降的趋势,表明同一类抗性细菌与ARGs的变化呈显著正相关. 由此可见,堆肥微生物群落结构可能在ARGs丰度变化过程中扮演了重要角色.
2.1.2移动遗传元件的丰度变化
移动遗传元件(MGEs)是参与ARGs水平转移的主要载体. 结果(见图1)显示,4个堆体中intl1的丰度变化较为相似,从开始到结束阶段均呈增长趋势,增长倍数分别为151.88倍(CK)、39.02倍(A25)、68.45倍(A50)、105.41倍(A100). 其中,丰度增加最大的是CK堆体,由初始绝对丰度的8.23×106copiesg增至1.25×109copiesg. 整个堆肥阶段,所有堆体中intl1的总丰度均比每个PMQR的丰度高2~4个数量级. 有研究[20]认为,可移动遗传元件作为ARGs的载体比ARGs具有更高的丰度. 研究[21-22]表明,MGEs的丰度变化类似于ARGs,且二者之间存在密切的关系. LIU等[23]在四环素废水处理系统中发现intl1与四环素类ARGs的增殖有关;DUAN等[24]发现intl1与tetW、ermF和sul1基因呈显著正相关,且sul1和intl1之间相关性最强(R=0.994). 但试验结果并未发现可移动遗传元件intl1与PMQR丰度变化有显著相关. 这可能是由于携带4个喹诺酮类ARGs的作用MGEs并不是intl1,它们之间的潜在宿主没有共性.
2.2 微生物群落演替规律
堆肥24个样品中获得 1 233 189 个高质量序列,按最小样本序列数进行抽平,序列以97%的相似度聚类到 1 468 个OTU. 稀释曲线表明,测序深度(29 371)可以检测样品中的大多数细菌群落. 目前研究[18,25]认为,细菌群落的演替可能会影响ARGs的丰度变化. 结果(见图2)显示,细菌群落组成在堆肥不同阶段表现出明显的聚集(P<0.01). 在堆肥高温期第7天微生物组成与其他阶段离散最大,说明高温期是堆肥细菌群落变化最显著的阶段.

注: D0、D3、D7、D14、D26和D46分别表示第0、3、7、14、26、46天中的4个堆体样品. 下同.
堆肥不同阶段中细菌群落的α-多样性差异大(见表3). 在高温期第7天,4个堆体中Shannon-Wiener指数和ACE指数均明显降低,是整个堆肥阶段的最低水平,即第7天的堆肥中微生物多样性最低且物种数最少. 这主要由于堆肥中嗜温性细菌无法在高温期生存,会随着温度升高而降低[26]. 抗生素对堆肥微生物群落多样性有一定的影响,到堆肥腐熟阶段,A100堆体的Shannon-Wiener指数和ACE指数均低于其他3组,说明高浓度抗生素可能会降低堆肥产品中微生物多样性. 为进一步了解PMQR与堆肥微生物多样性及生物量的相关性,将Shannon-Wiener指数、ACE指数与PMQR、MGEs丰度进行统计分析,发现CK、A25堆体中,intl1和微生物多样性呈显著相关(P<0.05). 这说明可移动遗传元件intl1的丰度变化与堆肥中细菌群落组成结构的改变有关,但是否与携带PMQR的潜在宿主有相关性还需进一步探究.

表3 猪粪堆肥4个处理组中不同阶段的细菌多样性指数
微生物作为堆肥过程中的主力军,是ARGs和MGEs丰度变化的关键因素[27]. 堆肥微生物门水平群落组成见图3,在所有堆肥样品中,占主导地位的菌门有放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、芽单胞菌门(Gemmatimonadetes)和绿弯菌门(Chloroflexi). 与已有的研究[28-29]相似,Firmicutes、Proteobacteria、Bacteroidetes和Actinobacteria在整个堆肥环境中约占76.2%,是堆肥过程中主要菌门.
为进一步解析微生物群落结构对ARGs丰度变化的影响,对堆肥不同阶段属水平群落结构进行分析. 在前25个属(见图4)中,狭义梭菌属(Clostridium_sensu_stricto_1)(占比为10.2%)、水微菌属(Aquamicrobium)(占比为9.4%)、乳杆菌属(Lactobacillus)(占比为9.4%)、交替赤杆菌属(Altererythrobacter)(占比为4.5%)、和黄杆菌属(Flavobacterium)(占比为4.0%)为优势菌属. 其中,Clostridium_sensu_stricto_1和Lactobacillus,作为Firmicutes的主要菌属,主要出现在堆肥升温期和高温期,而其他3种菌属主要分布在腐熟期. LIAO等[20]研究厨余垃圾堆肥中ARGs潜在宿主微生物发现,堆肥不同阶段微生物群落具有差异性,高温期的优势菌属为芽孢杆菌(Bacillus)、海洋芽孢杆菌(Oceanobacillu)和棒状杆菌(Corynebacterium),说明不同物料堆肥中优势菌属具有差异性.

图3 各堆肥中不同阶段门水平群落结构及分析
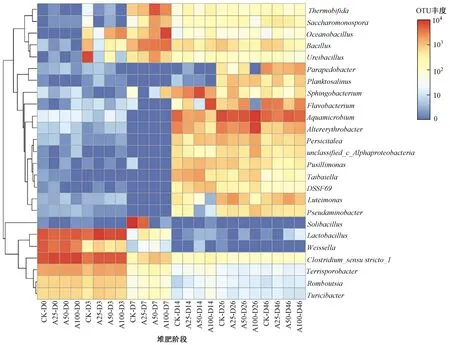
图4 各堆肥中不同阶段属水平群落结构及分析
畜禽粪便是病原微生物的主要载体,一些病原细菌(在物种水平上)携带了ARGs[30]. 尽管病原菌的相对丰度较低,仍存在一定的环境风险. 该研究中检测出的主要10种致病菌的丰度变化情况见图5. 由图5可见,随着堆肥进行,病原微生物的相对丰度(属水平)逐渐降低,而多样性增加. 这可能是由于堆肥高温期会抑制病原微生物生长,使得病原微生物总体丰度降低. 而腐熟期堆肥反应条件较温和,有利于整体微生物菌群的多样性增加,其中包括部分病原菌. 根据美国EPA标准[31],当堆肥系统满足一定条件,即40 ℃以上维持工作5 d且超过55 ℃至少持续4 h,才能实现病原体的有效灭活. 试验中4个堆体高温期的温度变化均已达到美国EPA灭活标准,但病原菌均未能完全被去除. 检测发现4个堆体中10种病原菌的初始总相对丰度为4.75%,经堆肥46 d后,CK、A25、A50和A100堆体的去除率分别为73.2%、77.7%、87.8%和79.2%. Soobhany[32]在城市有机固废堆肥试验中发现,堆肥可减少大肠杆菌数量,但不能完全灭活该微生物. 同样,Pourcher等[33]研究显示,即使温度高达66 ℃也不能完全使病原菌失活. 此外,研究发现堆肥高温期第7天,4个堆体中病原菌去除率分别为69.0%(CK)、54.6%(A25)、51.1%(A100)、45.8%(A50),致病菌的相对丰度均降低了45%以上,说明高温期是去除致病菌的主要阶段.
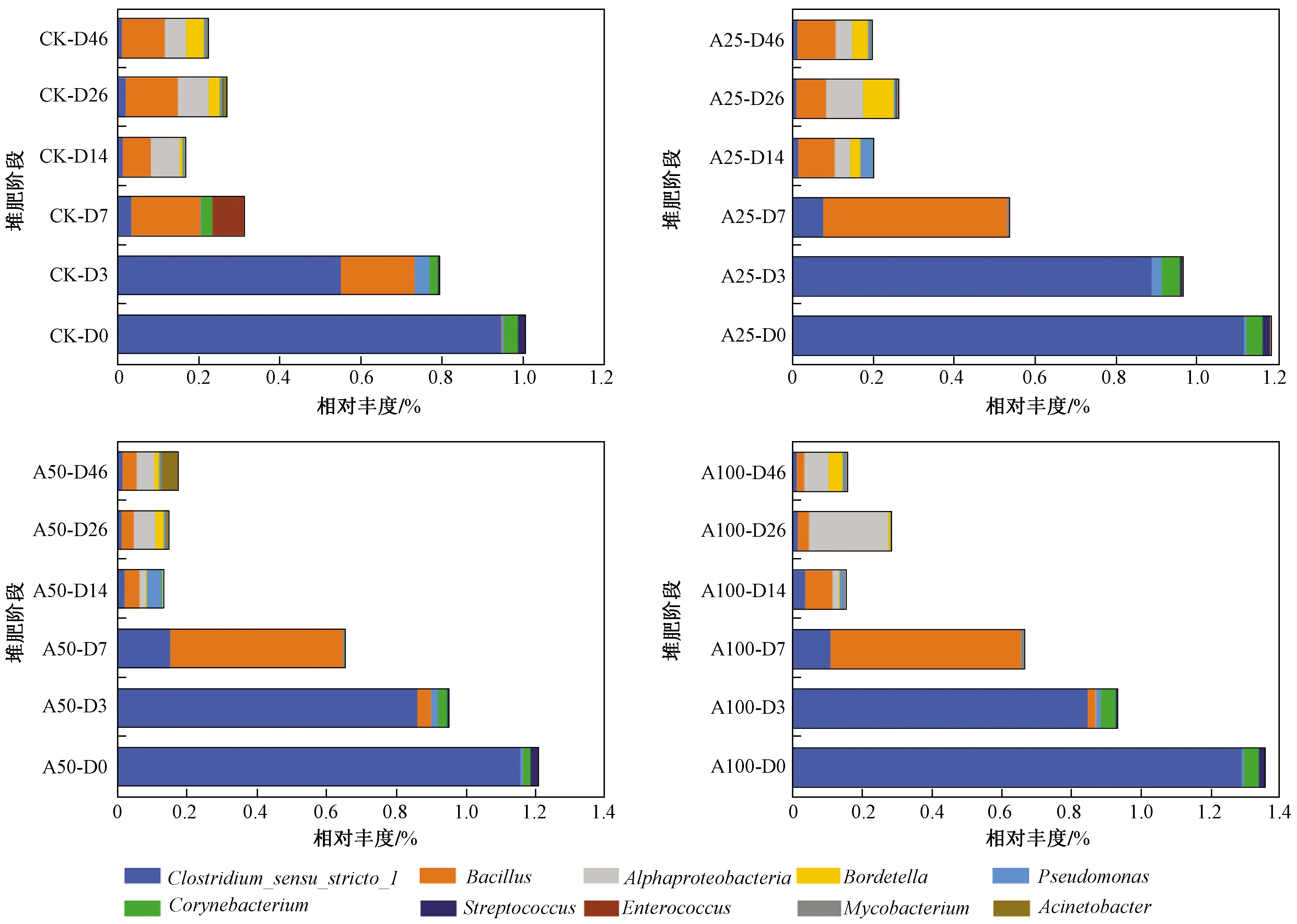
图5 堆肥过程中致病菌(属水平)的相对丰度变化
2.3 潜在宿主菌和ARGs共现分析
试验中4个堆体为相对独立的堆肥体系,而不同抗生素浓度胁迫下,堆体中宿主微生物存在差异性. 为了进一步解析ARGs的潜在宿主微生物,进行了不同堆体中潜在宿主菌的网络共现分析识别(见图6). 由图6可见,堆肥环境中与PMQR相关的潜在宿主菌一共有17种,其中8种为致病菌. 这些潜在宿主菌主要分布在厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)中,尤其是厚壁菌门、变形菌门的潜在宿主菌数量最多,丰度最高. 所有潜在宿主中,仅发现属于放线菌门的白喉杆菌(Corynebacterium)与intl1呈显著负相关(P<0.05),其他宿主菌均与PMQR、MGEs呈显著正相关(P<0.05). 已有研究[34-36]也表明,Firmicutes和Proteobacteria可能是与ARGs水平转移相关的主要菌门. 所关注的前10种致病菌中除芽孢杆菌和假单胞菌(Pseudomonas)外,其他均为潜在宿主. 其中,Streptococcus作为潜在宿主菌在4个堆体中均存在;在A25堆体的ModuleⅡ中,发现Clostridium_sensu_stricto_1不仅是4个PMQR的共同潜在宿主,也是致病菌中丰度最高的菌属,表明猪粪堆肥环境中存在ARGs向致病菌转移的环境健康风险. 因此,建议在25 mgkg环丙沙星环境中,以堆肥技术控制削减PMQR时,Clostridium_sensu_stricto_1应作为需首要关注的作用微生物. Jechalke等[37]研究表明,intl1位于质粒和转座子上,侧翼是插入序列,该序列通常与ARGs变化具有相关性. 但是,关于潜在宿主与可移动遗传元件intl1共现分析(见图6). 由图6可见:A25、A50、A100堆体中,可移动遗传元件intl1的潜在宿主菌与影响PMQR变化的潜在宿主没有共性;CK堆体中,也仅发现白喉杆菌是intl1和qnrS的共同潜在宿主. 综上,整合子intl1所在的ARGs簇可能没有携带这4种喹诺酮类ARGs,所以intl1与ARGs丰度相关性不显著.
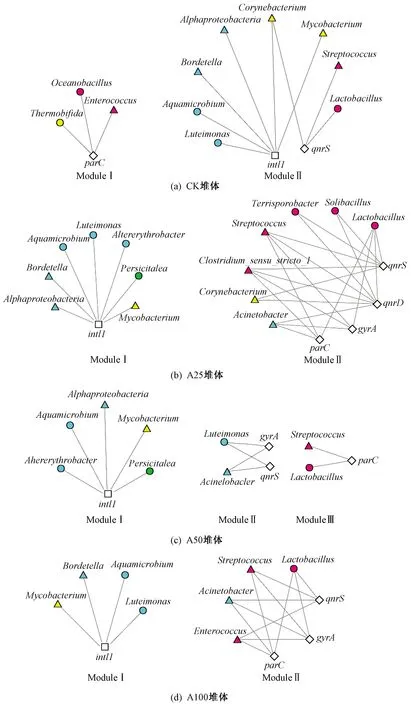
注: 三角形()表示致病菌(P.genus),圆圈()表示细菌(Genus),正方形()表示MGE,菱形()表示PMQR;粉色填充表示厚壁菌门(Firmicutes),蓝色填充表示变形菌门(Proteobacteria),绿色填充表示拟杆菌门(Bacteroidetes),黄色填充表示放线菌门(Actinobacteria).
3 结论
a) 不同浓度环丙沙星胁迫下,猪粪堆肥过程中喹诺酮类ARGs的变化规律有所不同,CK、A25和A100堆体中喹诺酮类ARGs总丰度均受到不同程度削减,A50堆体中ARGs的总丰度反而升高. 而在高温期,除了CK组,处理组中ARGs丰度显著降低(P<0.05),分别降低了90%、85%和99%,表明堆肥高温期或是削减ARGs丰度的关键阶段.
b) 对ARGs丰度变化与微生物响应进行分析,发现狭义梭菌属、水微菌属、乳杆菌属和交替赤杆菌属既是堆肥环境中优势菌属,也是喹诺酮类ARGs潜在宿主微生物,主要分布在厚壁菌门和变形菌门.
c) 经46 d好氧堆肥,4个堆体中致病菌均未被完全去除,去除率分别为87.8%(A50)、79.2%(A100)、77.7%(A25)、73.2%(CK),且丰度较高的致病菌狭义梭菌属和链球菌均是喹诺酮类ARGs的潜在宿主菌,表明猪粪堆肥环境中存在ARGs向致病菌转移的环境健康风险.
