1-磷酸鞘氨醇受体1 促进心肌梗死后单核/巨噬细胞在梗死心肌组织中浸润和聚集
2020-07-31王毓平欧军萍刘旭阳余海红李小林
王毓平,欧军萍,周 青,刘旭阳,余海红,李小林,
(1. 井冈山大学医学部,江西,吉安 343009;2. 上海市东方医院吉安医院,江西,吉安 343000)
心肌梗死(Myocardial Infarction, MI)是心血管疾病中常见的急危重症,它是一个损伤与修复并存的连续过程[1-2]。心梗早期主要表现为心肌细胞缺血坏死诱发的炎症反应,此后,单核/巨噬细胞向梗死区趋化、浸润,吞噬坏死、凋亡的细胞和基质碎片,诱导新生血管及瘢痕组织形成,促进心肌修复[3-4]。已有研究报道,通过改变单核细胞趋化动能或调节巨噬细胞在心梗区的动态平衡,可以改善梗死后的心肌修复[5]。
1-磷酸鞘氨醇(Sphingosine 1 Phosphate,S1P)是一种生物活性脂类代谢物质,细胞外S1P 通过G蛋白偶联受体(G protein coupled receptors GPCR)发挥作用[6]。S1P 受体有5 型,分别称为S1PR1~ S1PR5。这些受体广泛表达于多种组织、细胞中,如免疫、心血管、呼吸、肝脏和神经系统等[7]。有文献报道S1PR1 能促进循环系统中淋巴细胞、单核细胞等免疫细胞粘附于血管内皮并迁移至损伤组织[8];研究证实S1PR1 能促进心肌梗死后血管新生,从而改善心室重构[9-10]。作为一种细胞内信使,S1PR1 能激活细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK),磷酸化激活的ERK由胞质转位到核内,进而介导Elk-1,NF-κB 等的转录活化,从而参与细胞增殖、迁移及凋亡等多种生理过程[11-12]。然而,S1PR1 是否调控心肌梗死后单核/巨噬细胞功能并影响心梗后心肌修复至今尚未阐明。本研究以小鼠为研究对象,通过结扎左冠状动脉前降支建立小鼠心肌梗死模型,体内外试验S1PR1 对单核/巨噬细胞功能的影响及其作用机制。
1 材料和方法
1.1 实验动物
SPF 级C57BL/6 小鼠,购自上海斯莱克实验动物有限公司,全部为雌性小鼠,年龄在8~12 周龄,体重控制在20~25 g,每组5~7 只。RAW264.7 巨噬细胞系、HUVEC 内皮细胞系及293T 细胞均由同济大学东方转化医学研究中心和上海市心衰研究所惠赠,小鼠单核/巨噬细胞从实验小鼠的外周血分选获得,小鼠内皮细胞从实验小鼠心脏血管磁珠分选获得。
1.2 主要试剂
S1PR1 激动剂SEW2871 购自Cayman 公司,DMEM 培养基、胎牛血清 (Fetal bovine serum,FBS) 和胰蛋白酶购自Gibco 公司,PRMI-1640 购自Hyclone 公司, Perco 细胞分选液购自GE Healthcare,TRIzol 及PCR 试剂盒购自Qiagen公司,戊苯巴比妥钠麻醉剂、胶原酶I、胶原酶XI购自Sigma 公司,Transwell 小室购自Corning 公司。S1PR1 基因沉默和过表达质粒由吉满生物科技(上海)有限公司构建。
1.3 主要方法
1.3.1 心肌梗死模型制备和处理
实验小鼠随机分为实验组和对照组。参照文献报道的方法[13],采用左冠状动脉前降支结扎术,建立急性心梗模型(结扎处远端心肌组织变为白色为模型制备成功)。实验组腹腔注射S1PR1 激动剂SEW2871(5 mg/kg/day)[13],直至小鼠被处死,对照组腹腔注射DMSO。
1.3.2 单细胞悬液制备和流式细胞检测
戊巴比妥钠(50mg/kg)麻醉生效后,分别提取小鼠外周血、心肌、骨髓、肝脏等组织,制备成单细胞悬液,以备后续的流式细胞检测。为分析各组小鼠心梗后不同组织中单核/巨噬细胞变化,收集心梗后0、5、28 d 等三个时间点外周血、骨髓、肝脏、脾脏及心肌等组织进行流式细胞学检测。具体方法为:外周血及骨髓组织经红细胞裂解液裂解后PBS 缓冲液重悬;心肌组织在充分剪碎后以消化酶混合液裂解,70 μm 滤网过滤后,以37%Percoll 溶液梯度离心;肝脏和脾脏组织经充分碾碎、研磨后以红细胞裂解液裂解5 min,PBS 缓冲液重悬,制备成单细胞悬液,收集上述组织单细胞悬液,CD11b、F4/80 和Ly6C 三种抗体孵育后,流式细胞术检测,Flow Jo 软件统计分析单核细胞、巨噬细胞及Ly6Chi 和Ly6Clow 等细胞亚型的数量差异。
1.3.3 细胞培养和细胞转染
RAW264.7 采用 PRMI-1640 培养基(含10%FBS),HUVECs 采用内皮细胞培养基 2(Endothelial cell growth medium2,EGM2,含10%FBS),置于含5%CO2、37 ℃细胞培养箱中培养,倒置显微镜下观察细胞的生长情况,当细胞生长至70%左右时进行传代。按照试剂盒说明书操作步骤向细胞内分别加入S1PR1 基因沉默shRNA、过表达及空白对照载体,转染48 h 后,用Western blotting 检测靶基因的敲除效率。收集敲除成功的各组细胞,进行后续实验。
1.3.4 Transwell 法检测细胞迁移
采用 Transwell 小室试验检测 S1PR1 对RAW264.7 细胞迁移能力的影响。实验中,用搭载了S1PR1 和S1PR1 shRNA 的病毒感染RAW264.7,用含1%FBS 的1640 培基饥饿培养过夜,下室加含10%FBS 的培养基700~800 μL,上室以每孔1×105密度铺RAW264.7,加含1%FBS 的1640 培基150 μL。37 ℃继续培养4 h,结晶紫染色后显微镜下计数迁移细胞。每组设3 个复孔,实验重复3 次。
1.3.5 细胞共培养检测细胞粘附功能
采用RAW264.7 与HUVECs 共培养,根据实验目的不同,分为对照组、S1PR1 基因过表达组、S1PR1 基因沉默组和S1PR1 基因过表达+ U0126组,每组细胞以5 μmol/L 剂量的S1P 预处理6 h(S1PR1 基因过表达+ U0126 组在S1P 预处理,同时以50 μmol/kg 剂量的U0126 处理),用PKH26荧光染料标记RAW264.7。30 min 后观察细胞粘附率。每组设3 个复孔,实验重复3 次。
1.4 统计学处理
实验数据采用SPSS 19.0 统计软件进行分析,统计图表采用Graphpad Prism 软件绘制。两组数据采用独立样本T 检验,三组及以上数据采用单因素方差分析ANOVA,统计分析组间差异性。流式数据采用Flow Jo 软件进行分析。所有数据均以Mean ±SEM 表示,以P< 0.05 作为差异显著。
2 结果
2.1 S1PR1 促进单核/巨噬细胞在梗死心肌组织聚集
收集的单细胞悬液经Percoll 梯度离心分选出炎症细胞,通过流式细胞术分析单核/巨噬细胞及亚型的变化和组间差异(图1-A)。
实验结果显示,各组小鼠在心梗后0 天差异无统计学意义(数据未列出)。心梗后5 d,SEW2871处理组小鼠梗死心肌组织CD11b 阳性细胞总数(图1-B)、Ly6cLow 单核细胞、Ly6chigh 及Ly6cLow巨噬细胞数量均明显高于WT 对照组(1-C)。此外,免疫荧光染色结果显示,实验组心梗4 周小鼠心肌组织中每视野F4/80 阳性细胞数明显高于WT 对照组(P< 0.05),而CD11b 阳性细胞数两组间差异并不显著(1-D、E、F),n= 5。
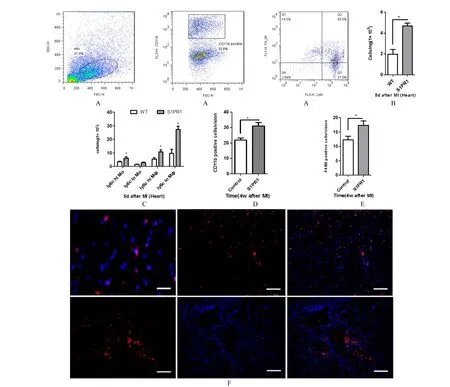
图1 Results of 流式细胞术及免疫荧光检测结果 Fig.1 Results of flow cytometry and immunofluorescence
2.2 S1PR1 促进外周血单核细胞向炎症组织趋化
FACS 分析发现,心梗后第5 d,SEW2871 处理组小鼠外周血中单核细胞总数和亚型细胞数量均显著低于对照组(P< 0.05)n= 5。(图2-A,B,C) ,而肝脏、脾脏及骨髓中差异并无统计学意义。

图2 外周血流式细胞检测结果 Fig.2 Flow cytometry results of peripheral blood
2.3 S1PR1 促进单核细胞迁移
Transwell 小室方法检测结果显示,S1PR1 过表达组迁移细胞数量明显高于对照组(P< 0.05)(图3A,B),差异有统计学意义(P< 0.05)。此外,为明确S1PR1 对单核细胞迁移功能影响的机制,采用ERK 抑制剂U0126 进行相关实验,结果显示细胞迁移数明显减少,与对照组比较有统计学差异(P< 0.05)。
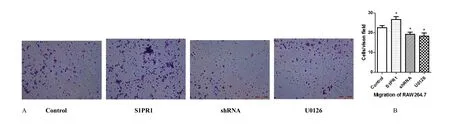
图3 transwell 小室方法检测结果 Fig.3 Results of tranwsell experiments
2.4 S1PR1 促进单核细胞的粘附
通过 S1PR1 基因过表达和基因沉默的HUVECs 与RAW264.7 共培养方法,研究S1PR1对单核/巨噬细胞粘附功能的影响,实验结果提示,S1PR1 过表达组细胞粘附率明显高于对照组,差异性显著(P< 0.05);此外,与对照组相比,U0126 处理组粘附率明显偏低(P< 0.05)(图4A,B)。
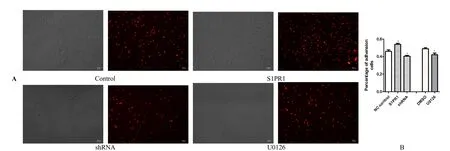
图4 细胞共培养粘附试验检测结果 Fig.4 Results of cells coculture adhesion experiments
2.5 S1PR1 上调血管内皮细胞粘附分子和趋化因子的表达
Rt-qPCR 结果显示,与对照组和基因沉默组相比,S1PR1 过表达组E-Selectin 表达水平显著升高(P< 0.001)。此外,通过磁珠分选S1PR1 激动剂和对照组小鼠的血管内皮细胞进行Rt-qPCR分析后发现,SEW2871 处理组血管内皮细胞不仅E-Selectin 表达上调,且MCP-1 的表达水平也明显升高,差异有统计学意义(P< 0.05)(图5A,B)。

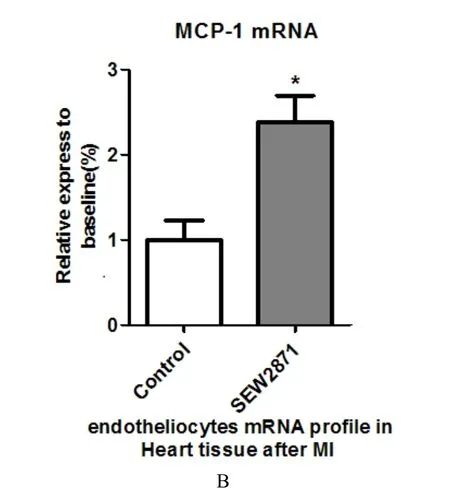
图5 E-Selectin 和 MCP-1 PCR 结果 Fig.5 PCR results of E-Selection and Mcp-1 expeiment
3 讨论
通过本研究,主要发现如下:(1) 心肌梗死后,S1PR1 激动剂SEW2871 促进单核/巨噬细胞在梗死区心肌组织浸润、聚集; (2) SEW2871 促进单核/巨噬细胞粘附和迁移;(3) ERK 信号通路阻断剂 U0126 可阻断SEW2871 的促进单核/巨噬细胞粘附和迁移作用。我们的研究结果为心肌梗死的诊断、治疗和心梗后心肌修复提供了一定的理论依据。
已有研究证实,单核/巨噬细胞在心梗后心肌修复中起着关键作用[14]。心肌梗死中、后期,梗死区心肌组织中巨噬细胞聚集增多[15],增加的修复性Ly6Clow 巨噬细胞能刺激TGF-β 和VEGF等因子的表达和促进血管新生[16]。此外,既往研究表明,巨噬细胞能吞噬坏死心肌细胞碎片、凋亡的免疫细胞等,以促进梗死区细胞再生和心肌组织重建[17]。本研究结果显示,心梗后3 d 开始,梗死区心肌组织中单核/巨噬细胞聚集增多,心梗后5 d 达到高峰,其中尤以Ly6Clow 巨噬细胞增加更为明显,研究结果与既往文献报道一致,提示此时已进入心梗后心肌修复阶段。
正常情况下,心肌组织中单核/巨噬细胞以局部增殖为主要来源,而在炎症等应激状态,则以心外组织单核/巨噬细胞迁移为主[15]。为明确浸润、聚集于梗死心肌中单核/巨噬细胞的来源以及S1PR1 在其中的可能作用,我们收集了心肌梗死后小鼠外周血、肝脏、脾脏和骨髓等组织并制备成单细胞悬液,采用流式细胞术分析细胞数量变化,结果显示,与对照组相比,S1PR1 激动剂组外周血中单核细胞数量明显减少,而肝脏、脾脏及骨髓中并无明显差异,提示S1PR1 主要通过促进外周血中单核细胞向梗死区趋化、迁移和聚集。
炎症过程中,包括血管细胞粘附分子 1(vascular cell adhesion molecule-1,VCAM-1)和E-Selectin 在内的多种细胞粘附分子在炎症细胞迁移中具有关键作用[18],一旦粘附于血管内皮细胞后,单核细胞得以穿过内皮并在趋化因子作用下向炎症组织迁移和聚集。有文献报道,S1PR1 能诱导NF-kappa B 亚单位p65 磷酸化及核转位而上调E-selectin 的表达并促进单核细胞粘附[19-20]。本研究的体内和体外实验都证实S1PR1 能上调 E-selectin mRNA 表达水平,而ERK 信号通路抑制剂U0126则能抑制上述作用,提示S1PR1 通过ERK 信号通路调控E-selectin 的表达,由于E-selectin 是血管内皮细胞表面影响白细胞粘附功能的重要粘附分子,这就在一定程度上解释了S1PR1 的促进单核/巨噬细胞粘附作用。另有报道证实,S1PR1 能增加MCP-1 的表达从而促进单核细胞与内皮细胞间的趋化、粘附作用[21]。与文献报道一致的是,我们的研究显示,实验组小鼠心梗后心肌组织中MCP-1的表达升高,提示S1PR1 可以上调MCP-1 的表达水平,而MCP-1 是重要的单核细胞趋化因子,从而促进单核/巨噬细胞向缺血心肌组织迁移。
作为MAPK 信号转导通路的一环,ERK(细胞外调节蛋白激酶)的活化是将信号从细胞膜表面受体转导至胞核的关键,并在调节细胞代谢和迁移、增殖等功能中具有重要作用[22]。本研究中,用ERK信号通路抑制剂U0126 预处理后,SEW2871 的促进单核/巨噬细胞粘附和迁移作用明显减弱,证实ERK 信号在调节单核/巨噬细胞粘附和迁移中具有重要作用。
综上所述,S1PR1 激动剂在心肌梗死后所致的炎症反应和心肌修复过程中具有重要作用。本研究以小鼠为研究对象,深入探讨了S1PR1 在心肌梗死后促进单核/巨噬细胞迁移作用及其机制,结果表明,S1PR1 可以通过调控ERK 信号通路,上调E-Selectin 和MCP-1 表达,促进外周血中单核细胞向梗死区迁移、聚集,从而使梗死心肌组织中单核/巨噬细胞聚集增多,并利于患者心肌修复。
