刺葡萄酒酒精发酵过程中氨基酸组成与果香酯类物质生成的关联分析
2020-07-31朱子健陈思雨粟俊陶永胜
朱子健,陈思雨,粟俊,陶永胜,3
刺葡萄酒酒精发酵过程中氨基酸组成与果香酯类物质生成的关联分析
朱子健1,陈思雨1,粟俊2,陶永胜1,3
(1西北农林科技大学葡萄酒学院,陕西杨凌 712100;2湖南刺葡萄研究中心,湖南洪江 418200;3陕西省葡萄与葡萄酒工程技术研究中心, 陕西杨凌 712100)
【】研究刺葡萄发酵过程中氨基酸的化学组成与果香酯类物质生成的关联,为刺葡萄酒增香酿造提供理论指导。试验以刺葡萄品种‘湘珍珠’为研究对象,以‘赤霞珠’葡萄为对照,添加酿酒酵母启动酒精发酵,每隔24 h取样,分别采用HPLC和GC-MS方法测定氨基酸和酯类物质的组成及含量,并通过Pearson相关性分析建立二者之间的数学关联。刺葡萄中除脯氨酸之外的氨基酸总体含量为‘赤霞珠’葡萄的3倍,天冬氨酸、缬氨酸、谷氨酸、γ-氨基丁酸、精氨酸含量分别达到‘赤霞珠’葡萄中对应氨基酸含量的2.4倍、2.2倍、4.2倍、7.7倍和3倍,但丙氨酸、苯丙氨酸、异亮氨酸含量仅为‘赤霞珠’葡萄中对应氨基酸含量的10%、35%和20%。刺葡萄发酵产生的乙酸酯、短链脂肪酸乙酯、中链脂肪酸乙酯含量仅为‘赤霞珠’葡萄发酵所得上述酯类物质的55%、11%和69%。Pearson相关性分析显示,刺葡萄发酵过程中丙氨酸、苯丙氨酸、异亮氨酸与乙酸酯、脂肪酸乙酯的相关性系数在0.552—0.837,较‘赤霞珠’葡萄发酵体系中相应的相关性系数显著偏低,这可能与刺葡萄酒果香酯类物质含量偏低有关。刺葡萄中含量偏低的丙氨酸、苯丙氨酸、异亮氨酸可能限制了刺葡萄酒发酵体系中果香酯类物质的积累。
葡萄酒;刺葡萄;氨基酸;果香酯类;相关性分析
0 引言
【研究意义】刺葡萄是中国特色野生葡萄,酿造而成的刺葡萄酒呈现深紫色或红宝石色,花青素和总酚含量高,具有很好的抗氧化特性[1]。研究表明,刺葡萄酒香气较弱,品种香气成分及其前体物质含量偏低,发酵形成的果香特征是刺葡萄酒的主要香气特征[2]。因此,刺葡萄酒的增香酿造应以改善发酵香气为主。酯类物质是红葡萄酒中重要的发酵香气成分[3],以乙酸酯和短-中链脂肪酸乙酯为主的果香酯类物质与葡萄酒的果香特征密切相关,通常作为葡萄酒增香酿造的目标产物[4]。葡萄酒发酵过程中果香酯类的形成与氨基酸密切相关,支链氨基酸在酵母的作用下通过Ehrlich途径脱羧、还原,生成相应的高级醇,并进一步转化生成酯和酸[5],从而影响葡萄酒发酵酯类物质的含量。通过调整发酵基质中氨基酸的组成,将有望针对性提高刺葡萄酒果香酯类物质的含量,提高发酵香气质量。但目前为止,针对刺葡萄酒发酵环境中氨基酸及果香酯类物质的研究较少。分析刺葡萄酒精发酵过程中的氨基酸组成与果香酯类物质生成的关联性,将有利于促进基于氨基酸组成调控的刺葡萄酒增香酿造研究的发展,并促进其他果酒增香酿造技术的开拓创新。【前人研究进展】此前,有关刺葡萄酒的研究主要集中在保健价值和功能性成分上,如花色苷和白藜芦醇[6-7],对刺葡萄酒香气匮乏的技术问题仍缺少针对性研究。刺葡萄酒增香酿造的研究起步较晚,本研究团队尝试通过混菌发酵优化刺葡萄酒的发酵香气,并在一定程度上提高了刺葡萄酒中果香酯类物质的含量[8],然而上述研究仍无法确定刺葡萄酒发酵香气淡弱、果香酯类含量低的内在原因。影响葡萄酒发酵香气成分的因素较多。其中,发酵葡萄汁中-氨基酸的组成对葡萄酒发酵过程中高级醇和酯类物质的生成具有重要影响[9],异亮氨酸、亮氨酸、缬氨酸、苯丙氨酸是高级醇及其相关酯类物质的重要前体[10]。Hernández-ORTE等[11]根据11种葡萄品种的氨基酸谱配制模拟葡萄汁进行发酵,发现大量挥发性香气化合物与葡萄汁氨基酸组成相关。PROCOPIO等[12]配置了34种不同氨基酸谱的模拟酒精发酵环境,通过PLS分析建立了理想发酵环境下氨基酸轮廓对主要香气成分影响的指纹图谱,发现缬氨酸、谷氨酸、脯氨酸、亮氨酸、异亮氨酸是影响香气活性成分含量的最重要解释变量。也有研究者通过相关性分析与线性拟合发现在模拟葡萄汁酒精发酵条件下氨基酸含量与挥发性香气成分含量之间存在线性关系[13]。然而,上述研究主要在模拟葡萄汁发酵环境中进行,对真实葡萄酒发酵环境中氨基酸组成及含量与果香酯类物质的关联性研究很少。大多数研究专注于在发酵前补充氨基酸,忽视了对葡萄醪及葡萄发酵过程中氨基酸组成的研究。测定葡萄醪初始状态及发酵过程中的氨基酸组成,明确氨基酸与果香酯类物质的关联,将有利于规避不必要的氨基酸补充,避免可同化氮含量过高导致的负面影响。【本研究切入点】国内对刺葡萄酒增香酿造的研究尚处于起步阶段,有必要从更多角度开发刺葡萄酒香气优化方案。【拟解决的关键问题】以刺葡萄品种‘湘珍珠’为试验对象,研究刺葡萄醪、刺葡萄酒发酵过程中氨基酸及果香酯类物质的组成和含量,并以‘赤霞珠’葡萄为发酵对照组,分析发酵过程中氨基酸组成与果香酯类物质的相关性,对比刺葡萄发酵体系与赤霞珠发酵体系之间上述相关性的差异,初步确定限制刺葡萄酒果香质量的氨基酸营养因素,为刺葡萄酒增香酿造提供理论指导。
1 材料与方法
试验于2019年在西北农林科技大学葡萄酒学院酿造与风味实验室进行。
1.1 葡萄原料与试验菌种
赤霞珠:于2018年8月采自陕西合阳葡萄基地,含糖量207.5 g∙L-1,含酸量5 g∙L-1(以酒石酸计)。
刺葡萄(湘珍珠):于2018年8月采自湖南怀化,含糖量172.5 g∙L-1,初始汁含酸量2.3 g∙L-1(以酒石酸计)。
试验菌株:酿酒酵母()ACTIFLORE F33,简称F33,购于法国Laffort公司。
1.2 仪器与试剂
HW.SY21-KP8电热恒温水浴锅(北京市长风仪器仪表公司);TGL-16M台式高速冷冻离心机(长沙高新技术开发区湘仪离心机仪器公司);ME203E电子天平(梅特勒-托利多仪器(上海)有限公司);10RTEX-5旋涡震荡仪(海门市其林贝尔仪器制造有限公司);FE28 pH计(梅特勒-托利多仪器(上海)有限公司);DW-YL270低温冰箱(中科美菱低温科技有限公司);GCMS-QP2020气相色谱-质谱联用仪(岛津公司);Waters 2695高效液相色谱仪、Waters 2996二极管阵列检测器(沃特世科技(上海)有限公司)。
分析纯化学试剂:葡萄糖、亚硫酸溶液购于天津市科密欧化学试剂有限公司;五水合硫酸铜、氢氧化钠、氯化钠、盐酸(36%—38%)购于四川西陇科学有限公司;四水合酒石酸钾钠、邻苯二甲酸氢钾、磷酸二氢钾、碳酸氢钠、无水乙酸钠、2, 4-二硝基氟苯(DNFB)。
色谱纯化学试剂及标准品:超纯水,色谱纯乙腈。L-天冬氨酸、L-色氨酸、L-异亮氨酸、L-丙氨酸、L-精氨酸、-氨基丁酸、L-蛋氨酸、L-苯丙氨酸、L-酪氨酸、L-缬氨酸购于上海源叶生物科技有限公司;L-谷氨酸、L-脯氨酸、L-亮氨酸购于北京索莱宝科技有限公司。乙酸乙酯、乙酸丁酯、乙酸异丁酯、乙酸异戊酯、乙酸己酯、乙酸辛酯、2-乙酸苯乙酯、丁酸乙酯、异戊酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯、癸酸乙酯、月桂酸乙酯、己酸甲酯、己酸异戊酯、辛酸异戊酯购于北京Sigma-Aldrich公司。
定容缓冲液:取KH2PO43.4 g于500 mL容量瓶中,加入0.1 mol∙L-1NaOH溶液145.5 mL,加超纯水定容。
1.3 试验方法
1.3.1 葡萄酒酿造 将‘赤霞珠’‘湘珍珠’葡萄进行除梗破碎,分别装入准备好的20 L透明玻璃发酵罐中,每个品种的酿造处理重复2次,每罐取样40 mL作为初始样品。加入60 mg∙L-1SO2并在4℃下浸渍24 h,随后向发酵罐中加入酿酒酵母,转移至20℃恒温箱中启动酒精发酵,每隔24 h取样,每次取样40 mL。残糖小于2 g∙L-1后结束发酵[14],并取样40 mL作为最终酒样。样品置于-20℃冰箱中保存。
1.3.2 氨基酸分析 氨基酸衍生方法:使用移液枪吸取经0.22 μm滤膜过滤后的样品或标准品溶液0.1 mL,加入1 mL离心管中,加0.05 mol∙L-1NaHCO3溶液0.1 mL后摇匀,再加入5% DNFB-乙腈溶液40 μL并摇匀。将离心管置于60℃恒温水浴锅内,水浴加热60 min后取出,置于避光环境下冷却至室温。随后加入定容缓冲液0.76 mL并摇匀,于黑暗处放置15 min后进行色谱分离[15]。
氨基酸色谱分析:色谱柱为C18分离柱(Agilent SB-C18色谱柱;Analytical 4.6 mm×250 mm;5-Micron);柱温33℃,进样量20 μL,采用四元梯度分析;流动相总流量为1 mL∙min-1;二极管阵列扫描波长:320—400 nm。流动相A为色谱纯乙腈,流动相B为超纯水,流动相C为pH 6.4的乙酸钠溶液。色谱柱洗脱程序如下:初始8% A,8% B,84% C;0—2 min:8%—15% A,8%—15% B,84%—70% C;2—4 min:15%—17% A,15%—17% B,70%—66% C;4—8 min:17%—20% A,17%—20% B,66%—60% C;8—14 min:20%—21% A,20%—22% B,60%—57% C;14—24 min:21%—28% A,22%—27% B,57%—45% C;24—27 min:28%—28% A,27%—27% B,45%—45% C;27—36 min:28%—49% A,27%—49% B,45%—2% C;36—40 min:49%—8% A,49%—8% B,2%—84% C。
定性定量方法:通过氨基酸单标溶液与混标溶液的色谱分析结果,根据标准品保留时间进行定性。将混标溶液梯度稀释后,通过外标法定量,标准曲线采用5点法绘制。
1.3.3 香气物质分析 SPME样品处理:本试验香气物质的提取采用顶空固相微萃取(HS-SPME)的方法,使用DVB/CAR/PDMS萃取纤维(50/30 µm涂层厚度,2 cm可伸缩长度)及SPME 57330-U联用手柄(Supelco, Bellefonte PA, USA)。20 mL顶空瓶中加入8 mL酒样,2.0 g氯化钠,2-辛醇(内标,400 μg∙L-1)和搅拌子在40℃水浴中平衡15 min后,再用萃取纤维在40℃下搅拌吸附30 min后取出,立即手动进样至气相色谱进样口(230℃)解析5 min。每个酒样的萃取操作重复2次。
GC-MS分析:使用气相色谱-质谱联用仪(岛津GCMS-QP2020),柱型号为DB-WAX(60 m×0.25 mm,涂层厚度0.25 µm,Agilent JandW,USA)。不分流进样,载气为高纯氦气(99.999%),载气流速为1.5 mL∙min-1。程序升温:以3℃∙min-1从40℃至130℃,再以4℃∙min-1从130℃至250℃,保持8 min。进样口温度230℃,连接杆温度220℃,离子源温度200℃,电子电源电压70 eV,质谱为电离轰击(EI)模式,全扫描质谱范围25—350 amu,扫描频率0.2 s/次。
定性定量分析:配制酯类物质标准品的模拟酒溶液,进行上述HS/SPME-GC-MS分析,采用标准品保留时间对比、保留指数对比和NIST 17质谱谱库查询进行目标酯类物质的定性。采用内标-标准曲线法对目标酯类物质进行定量,2-辛醇为内标物,具体定量方法参考Hu等[16]的方法。
1.4 数据处理
数据分析采用Pearson相关性分析(Pearson Correlation Analysis)对发酵过程中氨基酸与果香酯类物质进行关联性分析,试验数据处理主要使用SPSS 20.0(SPSS Inc., Chicago, IL, USA)软件。使用OriginPro 9.0绘制发酵过程中氨基酸含量变化趋势图。
2 结果
2.1 葡萄酒精发酵过程中氨基酸的变化
本研究通过HPLC-PAD对刺葡萄和赤霞珠葡萄醪样品和发酵汁样品中的13种氨基酸成分进行定性定量分析(表1)。刺葡萄醪总氨基酸含量显著低于‘赤霞珠’葡萄,仅为‘赤霞珠’葡萄醪中总氨基酸含量的33%,但刺葡萄醪除脯氨酸外的氨基酸总量则显著高于‘赤霞珠’,约为‘赤霞珠’葡萄醪的3倍。除脯氨酸外,刺葡萄中的丙氨酸、苯丙氨酸、异亮氨酸含量显著低于‘赤霞珠’,仅为‘赤霞珠’葡萄醪中上述氨基酸含量的10%、35%和20%。刺葡萄中天冬氨酸、缬氨酸、谷氨酸、γ-氨基丁酸、精氨酸的含量则显著高于‘赤霞珠’,分别达到‘赤霞珠’葡萄醪中上述氨基酸含量的2.4倍、2.2倍、4.2倍、7.7倍、3倍。‘赤霞珠’葡萄与刺葡萄的氨基酸组成及含量具有明显差异。亮氨酸、色氨酸和蛋氨酸在两种葡萄醪样品中均未检出。
发酵过程中氨基酸含量变化如图1所示。刺葡萄发酵体系中的天冬氨酸、谷氨酸、苯丙氨酸含量在发酵第1天有所升高。随着酒精发酵的进一步进行,除酪氨酸外,发酵酒样的氨基酸含量逐渐减少。酪氨酸的变化具有品种差异性,其含量在‘赤霞珠’发酵过程中略有下降,而在刺葡萄发酵中则有所增加。刺葡萄最终酒样中的酪氨酸含量高于‘赤霞珠’酒样。脯氨酸是两种葡萄发酵过程中含量最高的氨基酸。亮氨酸、色氨酸及蛋氨酸在两种葡萄发酵全程均未检出。
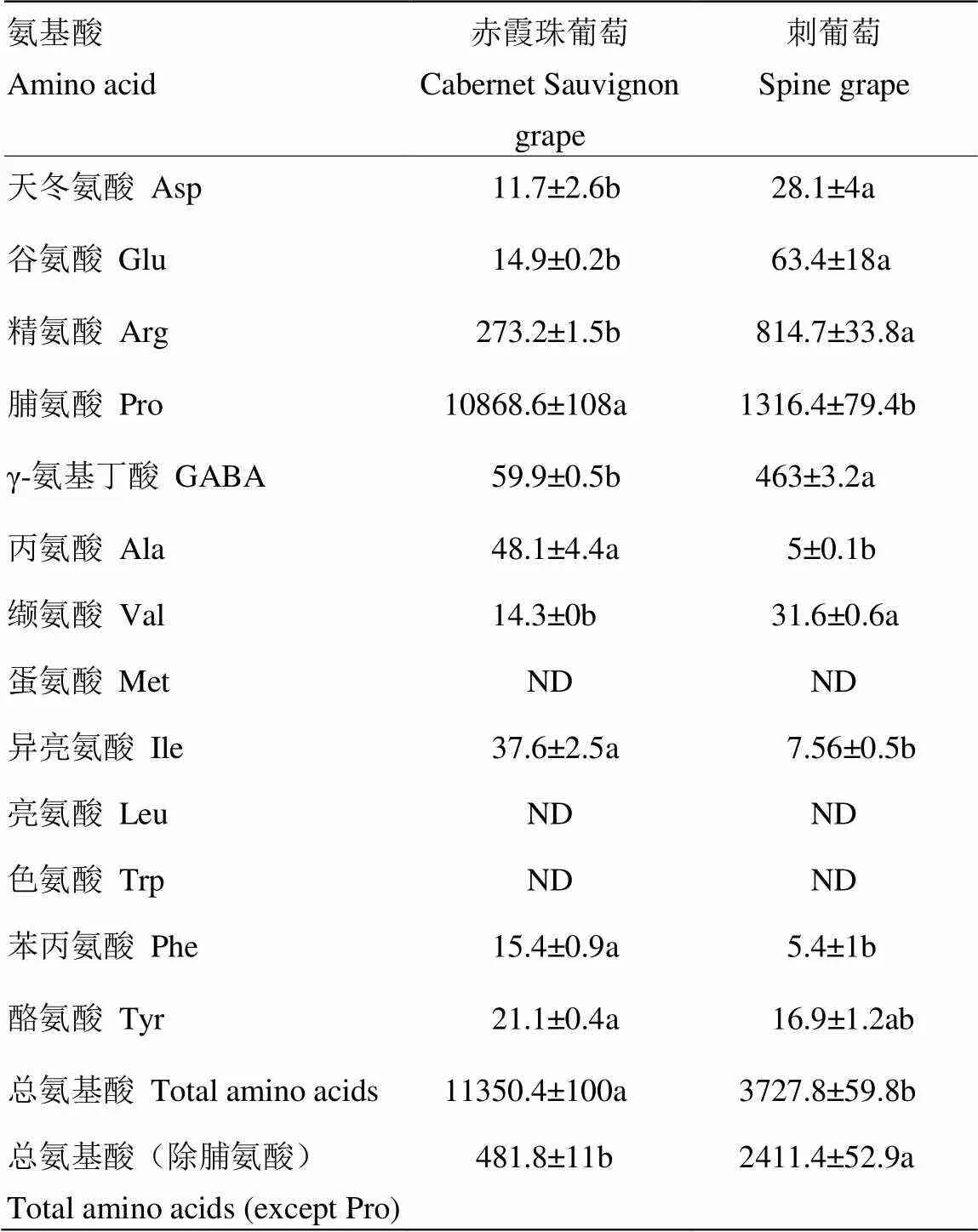
表1 葡萄醪中的氨基酸含量
数值为平均值±标准偏差,不同小写字母表示通过单因素方差分析所得样本间显著性差异结果(<0.05);“ND”表示未检出。下同
Data are mean values of two independent experiments ± standard deviation. Mean values displaying different letters within each row are significantly different according to the One-way ANOVA at 95% confidence level. “ND” means “Not detected”. The same as below
2.2 葡萄酒精发酵过程中果香酯类物质的变化
经HS/SPME-GC-MS对发酵葡萄酒样品中香气成分的定性定量分析,本研究在刺葡萄酒和赤霞珠葡萄酒发酵体系中共检出17种酯类物质,包括7种乙酸酯、2种短链脂肪酸乙酯(SCFAEE,C2—C5)、5种中链脂肪酸乙酯(MCFAEE,C6—C13)和3种其他酯类物质,其中6种酯类物质的OAV>1(OAV:气味活性值,OAV=香气化合物浓度/该香气化合物气味阈值),包括乙酸乙酯、乙酸异戊酯、丁酸乙酯、异戊酸乙酯、己酸乙酯、辛酸乙酯。刺葡萄和‘赤霞珠’发酵体系中果香酯类含量变化分别见表2、表3。在刺葡萄发酵体系中,乙酸酯、短链脂肪酸乙酯和中链脂肪酸乙酯含量始终低于‘赤霞珠’,在最终酒样内的含量分别为16 233、132.4和711.9 μg∙L-1,仅为‘赤霞珠’最终酒样中乙酸酯、短链脂肪酸乙酯和中链脂肪酸乙酯含量的55%、11%和69%。其他酯类含量在刺葡萄发酵过程中呈先增加后减少的变化趋势,在发酵第5天、第7天和第10天时含量高于‘赤霞珠’,而在发酵结束时,刺葡萄酒中其他酯类含量略低于‘赤霞珠’葡萄酒。从总体上看,刺葡萄酒中的果香酯类(乙酸酯、短链脂肪酸乙酯和中链脂肪酸乙酯)含量显著低于‘赤霞珠’葡萄酒,尤其是对葡萄酒果香特征具有突出贡献的中链脂肪酸乙酯含量远远低于‘赤霞珠’葡萄酒。
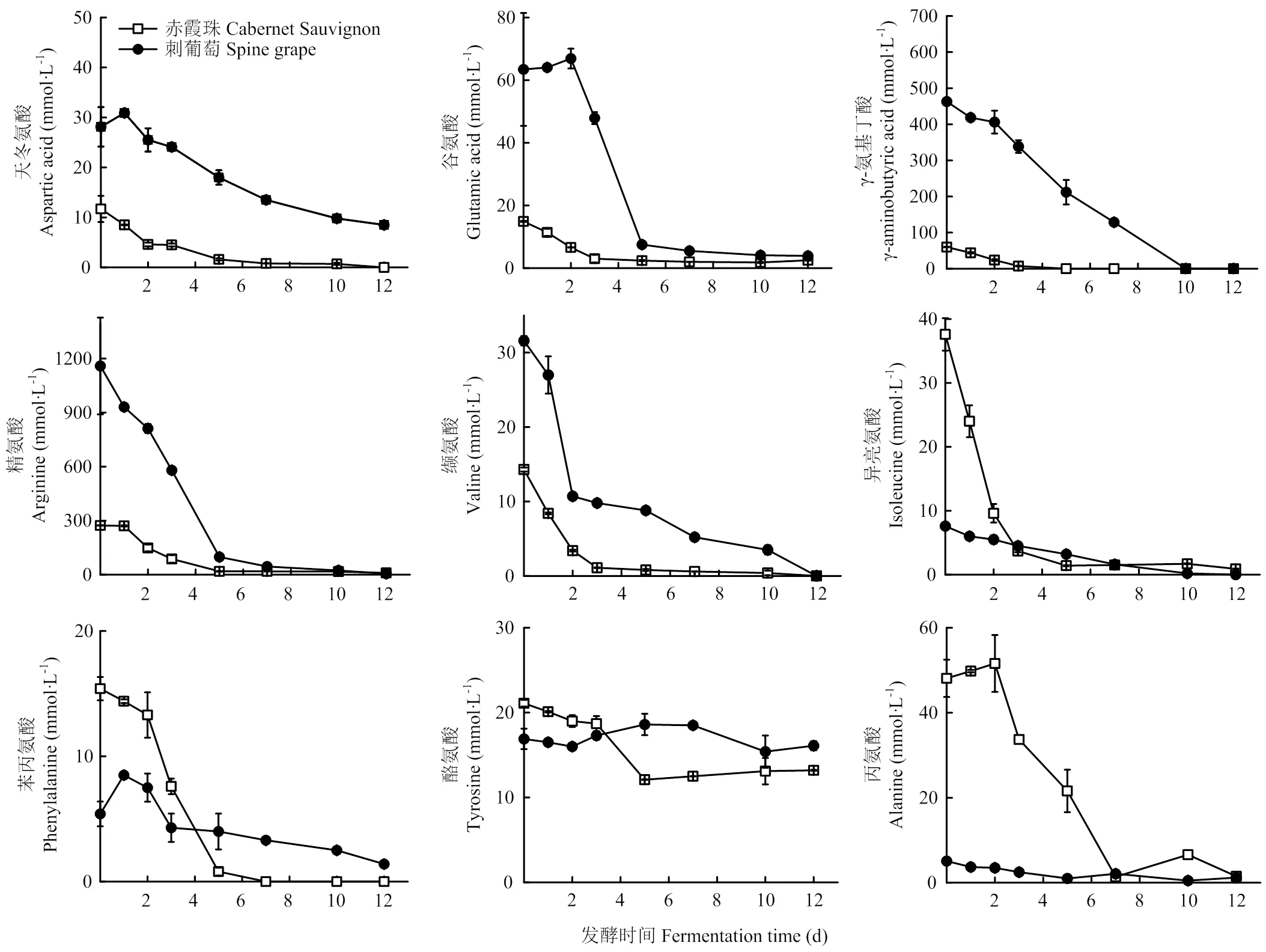
图1 酒精发酵过程中氨基酸含量的变化
2.3 葡萄发酵过程中氨基酸与果香酯类的相关性分析
由于酪氨酸在发酵过程中的变化具有品种特异性,且在刺葡萄发酵中具有增加趋势,因此无法判断其消耗情况,不将其列入相关性分析对象。为确定发酵过程中的氨基酸含量变化是否与果香酯类物质含量变化具有明显关联性,以及两种葡萄发酵过程中上述关联性是否存在差异,本试验对葡萄发酵过程中氨基酸含量与果香酯类含量进行了Pearson相关性分析,如表4所示。发酵过程中大多数氨基酸与果香酯类变化趋势相反,因此结果以负相关为主。总氨基酸含量(除脯氨酸)与果香酯类物质的相关性分析表明,葡萄酒发酵过程中总氨基酸与乙酸酯、短链脂肪酸乙酯和中链脂肪酸乙酯的相关性系数较高,但与其他酯类物质的相关性系数较低。对比刺葡萄与‘赤霞珠’对照组中总氨基酸含量与果香酯类含量的Pearson相关性系数可见,‘赤霞珠’中的总氨基酸含量(除脯氨酸)与乙酸酯、短链和中链脂肪酸乙酯含量具有极强相关性,分别达到0.919、0.875和0.825;刺葡萄发酵组的总氨基酸与乙酸酯(0.873)、短链脂肪酸乙酯(0.864)、中链脂肪酸乙酯(0.750)的相关性系数低于‘赤霞珠’葡萄发酵组的上述相关性系数。
通过8种氨基酸含量与果香酯类物质含量的相关性分析可见,在‘赤霞珠’发酵体系中,天冬氨酸、谷氨酸、精氨酸、γ-氨基丁酸、缬氨酸与乙酸酯、短链和中链脂肪酸乙酯具有强相关性或极强相关性,相关性系数范围为0.689—0.910;丙氨酸、苯丙氨酸、异亮氨酸与上述果香酯类的相关性系范围为0.705—0.978,与果香酯类物质具有强相关性或极强相关性,其中苯丙氨酸与乙酸酯相关性系数最高,丙氨酸与短链脂肪酸乙酯相关性系数最高。在刺葡萄发酵体系的相关性分析中,天冬氨酸、谷氨酸、精氨酸、-氨基丁酸、缬氨酸与乙酸酯、短链和中链脂肪酸乙酯具有强相关性或极强相关性,相关性系数在0.669—0.976;丙氨酸、苯丙氨酸、异亮氨酸与上述果香酯类物质的相关性系数在0.552—0.837。
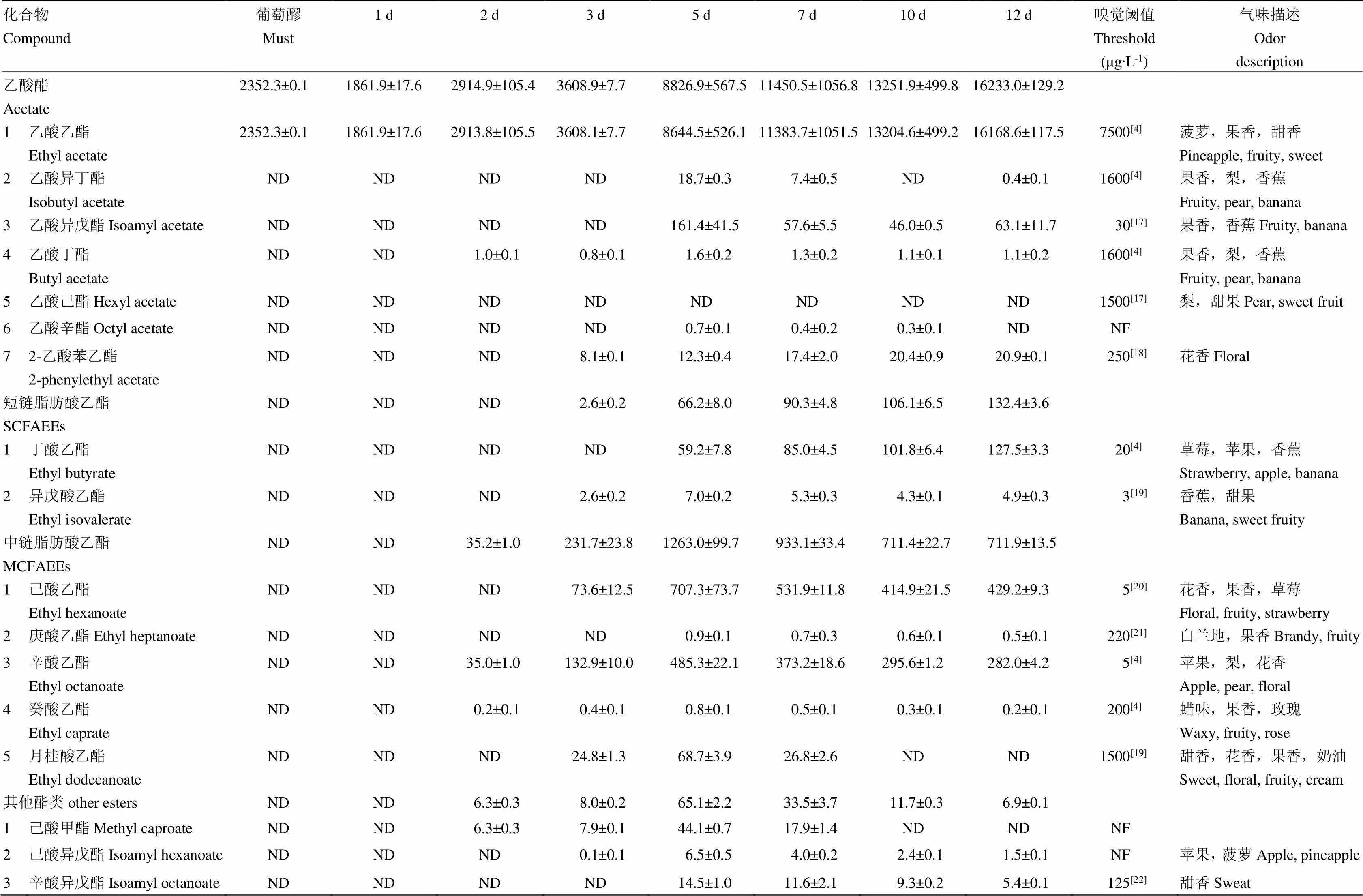
表2 刺葡萄酒精发酵过程中酯类物质的含量
表中数据为两组独立平行试验的平均值±标准偏差。“NF”表示未找到。下同 Data are mean values of two independent experiments ± standard deviation. “NF” means “Not Found”. The same as below
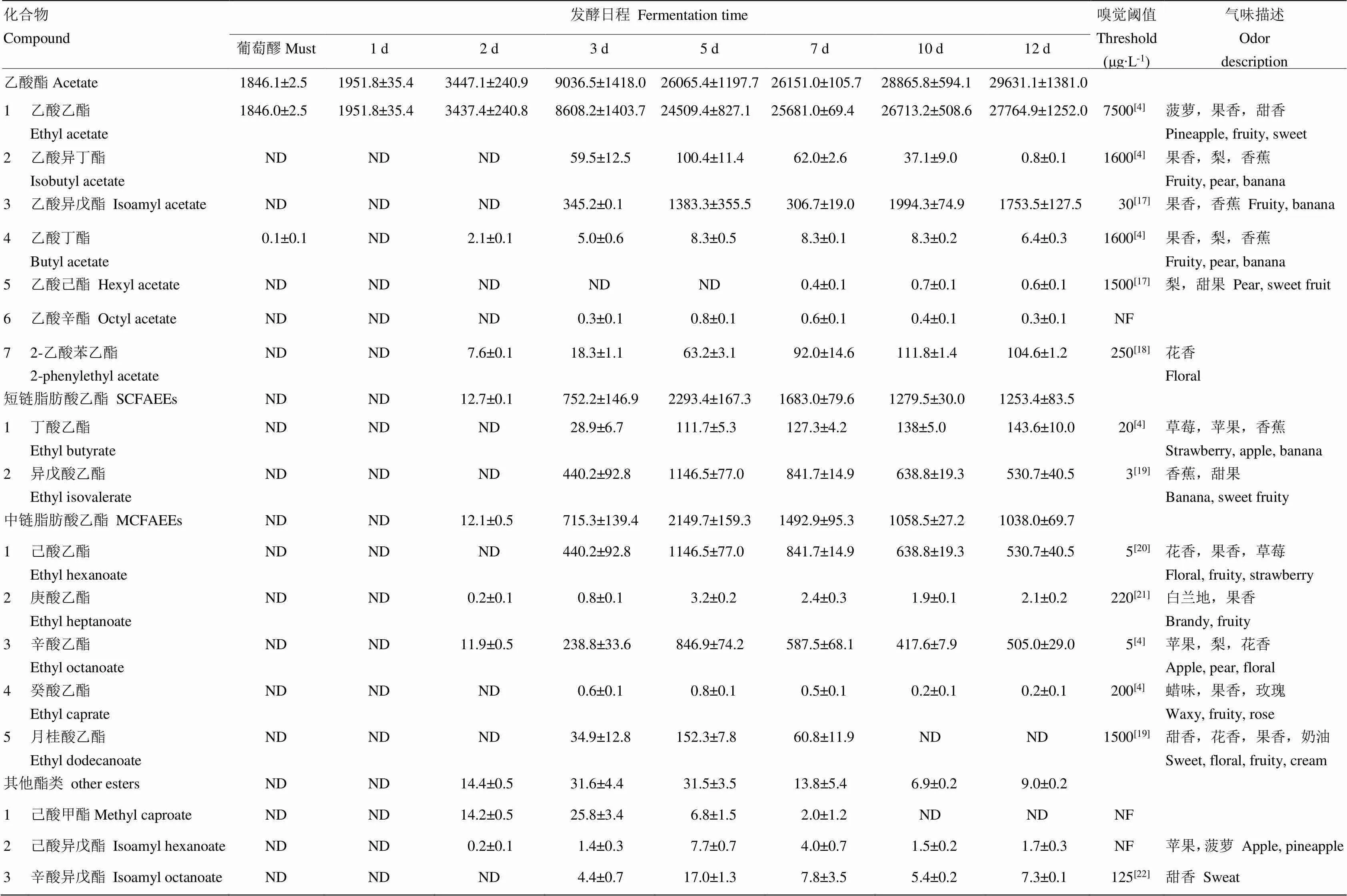
表3 赤霞珠酒精发酵过程中酯类物质的含量
将刺葡萄发酵过程中氨基酸与果香酯类物质含量的相关性系数与‘赤霞珠’对比可见,在发酵过程中,刺葡萄的精氨酸、天冬氨酸、谷氨酸、-氨基丁酸、缬氨酸与果香酯类的相关性系数较‘赤霞珠’偏高。与上述情况相反,刺葡萄发酵过程中的苯丙氨酸与乙酸酯、各类脂肪酸乙酯的相关性系数低于‘赤霞珠’葡萄,异亮氨酸与乙酸酯、中链脂肪酸乙酯的相关性低于‘赤霞珠’葡萄,丙氨酸与乙酸酯和短链脂肪酸乙酯的相关性低于‘赤霞珠’葡萄,上述相关性系数较‘赤霞珠’葡萄发酵过程中对应的相关性系数偏低3%—54%。为直观展现‘赤霞珠’与刺葡萄发酵过程中丙氨酸、苯丙氨酸、异亮氨酸与果香酯类物质的相关性差异,对上述氨基酸含量变化与各类果香酯类物质的含量变化进行线性拟和,拟合结果如图2所示。通过线性拟和分析可以发现,‘赤霞珠’发酵体系中丙氨酸、苯丙氨酸、异亮氨酸与果香酯类的线性拟合效果较刺葡萄发酵体系存在明显差异,刺葡萄发酵体系中的上述氨基酸与果香酯类物质的线性拟和效果较差。在果香酯类物质含量分析中,‘赤霞珠’酒精发酵产生的乙酸酯和短-中链脂肪酸乙酯含量均高于刺葡萄酒,表明不同葡萄品种的发酵酒中果香酯类物质含量的差异可能与氨基酸-果香酯类的相关性差异具有一定关联。结合氨基酸含量研究可见,氨基酸的含量差异与相关性差异具有一定规律性:刺葡萄中精氨酸、天冬氨酸、谷氨酸、-氨基丁酸、缬氨酸含量高于‘赤霞珠’,丙氨酸、苯丙氨酸、异亮氨酸含量低于‘赤霞珠’。上述结果表明,刺葡萄中丙氨酸、苯丙氨酸、异亮氨酸含量偏低与刺葡萄酒果香酯类物质含量偏低具有一定关联,刺葡萄发酵过程中的氨基酸组成与果香酯类物质的生成之间具有“木桶效应”,刺葡萄中含量偏低的丙氨酸、苯丙氨酸、异亮氨酸可能限制了果香酯类物质在发酵过程中的合成,进而导致最终酒样中果香酯类含量的差异。
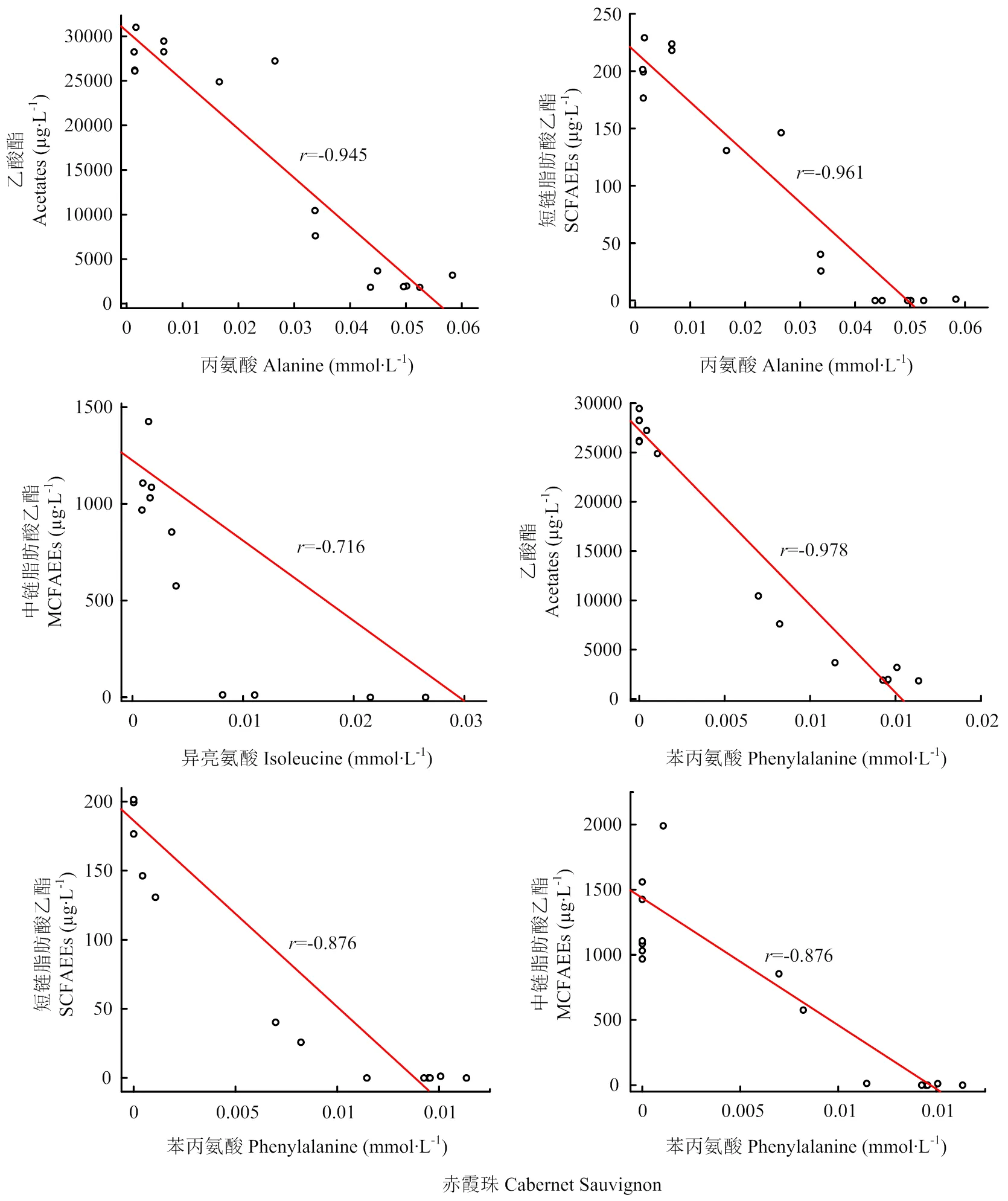
此外,刺葡萄中除脯氨酸外的总氨基酸含量高于‘赤霞珠’葡萄,但其发酵酒中的果香酯类含量仍然低于‘赤霞珠’葡萄酒,这表明不能将果香酯类合成的有机氮营养因素单一地归结于酵母可利用的总氨基酸含量或某种氨基酸含量的多少,发酵过程中发酵基质的氨基酸组成对果香酯类含量具有更加重要的影响,良好的氨基酸组成可能更有利于果香酯类物质的生成。
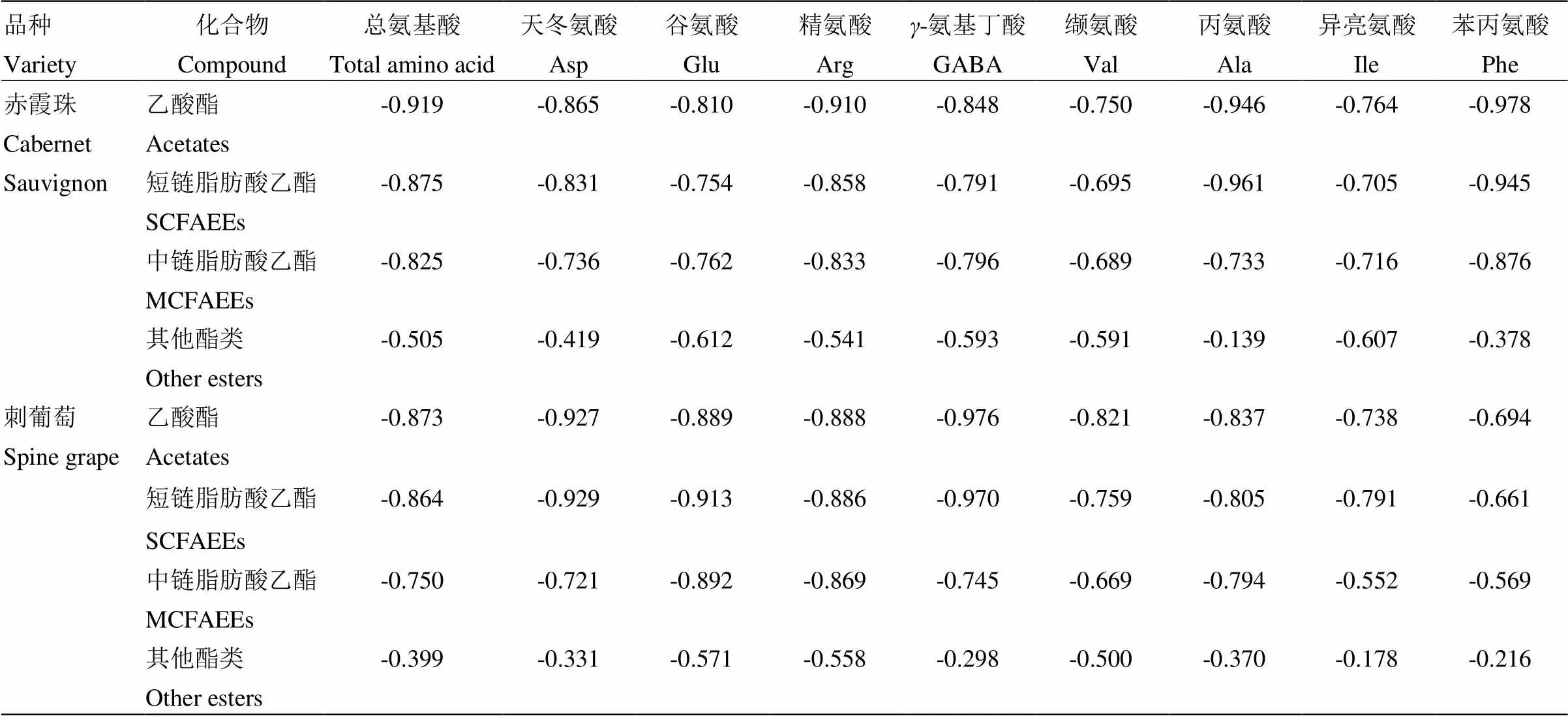
表4 酒精发酵过程中氨基酸与发酵酯类物质的相关性系数
3 讨论
3.1 刺葡萄酒精发酵过程中氨基酸、果香酯类物质的含量变化规律
氨基酸存在于葡萄果实,经过葡萄浸渍后进入发酵体系中从而被酵母利用,参与葡萄酒中的发酵香气的合成。葡萄果实中氨基酸组成与葡萄品种关系密切[23],而其测定结果也根据测定方法不同而存在较大差异[24],本研究未在葡萄醪及发酵汁样品中检出亮氨酸,这与此前部分研究结果不同,推测可能受到特定年份葡萄种植条件及环境的影响。GUTIÉRREZ- GAMBOA等[25]对智利莫莱谷产区的‘佳丽酿’葡萄醪氨基酸含量进行测定,其中色氨酸在多个样品中含量偏低,且蛋氨酸含量最低仅为0.14 mg∙L-1;高年发等[26]对宁夏4个产区的葡萄醪样品进行氨基酸测定,7种被测样品中仅有3种检出色氨酸,且均未检出蛋氨酸。上述研究表明葡萄醪中色氨酸、蛋氨酸含量极低,而本研究未在刺葡萄与‘赤霞珠’葡萄发酵体系中检出色氨酸与蛋氨酸。目前为止尚无对刺葡萄醪及刺葡萄发酵过程中氨基酸含量的研究。本研究发现,在发酵第1天时天冬氨酸、谷氨酸、苯丙氨酸含量略有升高,这与高年发等[26]对浸渍前期氨基酸含量变化的研究结果相似,推测是在浸渍过程中,存在于果皮、果肉和果籽中的部分天冬氨酸、谷氨酸和苯丙氨酸浸出至发酵葡萄汁所致,但尚需更多研究予以证明。在刺葡萄和‘赤霞珠’对照组的酒精发酵过程中,天冬氨酸、谷氨酸、精氨酸、γ-氨基丁酸、缬氨酸、异亮氨酸、苯丙氨酸含量在发酵过程中呈下降趋势,部分氨基酸最终被完全消耗。酪氨酸含量在刺葡萄发酵过程中逐渐下降,而在‘赤霞珠’中呈现波动变化,具有明显的品种差异性,这与高年发等[26]对不同产区、多个葡萄品种的研究结果基本一致,但与GARDE- CERDÁN等[27]的研究结果不同。刺葡萄中天冬氨酸、谷氨酸、精氨酸、γ-氨基丁酸、缬氨酸含量高于‘赤霞珠’,而苯丙氨酸、丙氨酸、异亮氨酸含量低于‘赤霞珠’。由于脯氨酸通常不被视为酵母可同化氮[28],因此本文不再讨论脯氨酸的含量变化及其与果香酯类物质的相关性情况。
葡萄酒中的酯类物质对香气的贡献曾被长期低估,而如今有更多的研究证明其对香气质量的贡献不可忽视[29]。目前为止,对刺葡萄醪及刺葡萄发酵过程中香气物质的研究较少,鲍瑞峰[30]对刺葡萄果实及刺葡萄酒中部分果香酯类成分进行了研究,但其未对香气物质含量进行定量分析;本研究团队在前期研究中对刺葡萄酒中香气物质含量进行了定量测定,但未对发酵过程中的香气物质含量变化进行全程监控,且未将刺葡萄酒的香气物质组成与其他葡萄酒进行对比分析[8]。本研究对刺葡萄及‘赤霞珠’葡萄发酵过程中果香酯类物质含量进行测定,发现刺葡萄酒发酵过程中果香酯类物质含量始终低于‘赤霞珠’,其中乙酸酯、短链脂肪酸乙酯和中链脂肪酸乙酯含量显著低于‘赤霞珠’,这可能是导致刺葡萄酒香气贫乏的直接原因。
3.2 刺葡萄酒发酵体系中氨基酸与果香酯类物质生成的关联
氨基酸组成与葡萄品种相关,通过葡萄发酵,这些氨基酸转化产生特异性的香气物质,形成酒的特异性香气,从而形成不同风格的葡萄酒[31]。氨基酸经过微生物分解代谢产生的香气物质具有一定对应性,支链氨基酸(Leu、Ile、Val)被转化为具有麦芽味、果香和汗味的香气化合物;芳香族氨基酸(Phe、Tyr、Trp)的分解代谢产生具有花香、化学溶剂味和粪便气味的化合物;天冬氨酸(Asp)被分解成具有黄油味的香气物质,含硫氨基酸(Met、Cys)被转化为具有煮白菜、肉味和大蒜味的化合物[32]。在酒精发酵过程中,氨基酸主要通过Ehrlich途径进行代谢,通过转氨、脱羧等过程生成对应的高级醇及脂肪酸[33],并进一步反应生成酯类物质。然而,更多研究表明在实际发酵环境中,氨基酸对香气物质生成的影响并不是严格一一对应的,酵母可能将氨基酸代谢过程中产生的α-酮酸重新分配至其他类似的生物化学反应途径[13]。因此,在具有多种可同化氮来源的复杂发酵基质中,某种氨基酸代谢的中间产物可能同时参与多种香气物质的合成,从而对化学结构相似的多种香气物质的含量产生影响。
对于氨基酸与香气的研究不是一蹴而就的,研究者们将氨基酸归于氮源,又将氮源分为无机氮和氨基酸进行添加试验。HERNÁNDEZ-ORTE等[34]根据11种葡萄品种的氨基酸谱配制模拟葡萄汁,进行模拟发酵,发现一些挥发性化合物(乙酸乙酯、高级醇、异丁酸、己酸、辛酸)存在显著差异,进行多元回归分析后发现,这些挥发性化合物与葡萄汁氨基酸组成相关。GARDE-CERDáN等[35]在氮缺乏葡萄醪中进行氨基酸补充试验发现,总酯、乙酸异戊酯、乙酸苯乙酯与添加的氨基酸量成正比;PROCOPIO等[12]通过对不同氨基酸谱的模拟汁发酵及统计学分析,发现谷氨酸、异亮氨酸、缬氨酸、苯丙氨酸含量会影响最终酒样中酯类物质的含量;CHEN等[36]发现荔枝酒中的苯丙氨酸含量影响到乙酸苯乙酯、异丁酸苯乙酯和己酸苯乙酯的含量;HERNÁNDEZ-ORTE等[37]发现外加苯丙氨酸、丙氨酸、天冬氨酸会促进乙酸苯乙酯、己酸乙酯、辛酸乙酯等乙酸酯和中链脂肪酸乙酯含量的增加。上述研究印证了本研究中天冬氨酸、谷氨酸、缬氨酸、丙氨酸、苯丙氨酸、异亮氨酸与乙酸酯、中链脂肪酸乙酯具有较高相关性的结果。
本研究综合分析了刺葡萄发酵组与‘赤霞珠’葡萄间的氨基酸及果香酯类物质组成、氨基酸-果香酯类相关性数据,在前人对氨基酸与香气物质关联性研究的基础上,进一步明确真实发酵环境下刺葡萄的氨基酸组成与果香酯类物质的生成之间具有显著相关性,同时发现葡萄中氨基酸组成对果香酯类物质生成可能具有“木桶效应”:刺葡萄中含量显著低于‘赤霞珠’葡萄的丙氨酸、苯丙氨酸、异亮氨酸构成了刺葡萄氨基酸组成的“短板”,限制了刺葡萄酒发酵体系中果香酯类物质积累,导致刺葡萄酒中果香酯类物质含量低于‘赤霞珠’。尽管刺葡萄中天冬氨酸、谷氨酸、精氨酸、γ-氨基丁酸、缬氨酸含量高于‘赤霞珠’葡萄,但上述含量较高的氨基酸无法弥补刺葡萄发酵环境中丙氨酸、苯丙氨酸、异亮氨酸含量偏低导致的果香酯类物质含量低下,在刺葡萄酒发酵过程中成为果香酯类物质合成的限制因素。这可能表明发酵葡萄汁中均衡且充足的氨基酸组成对果香酯类物质的生成具有重要作用。在刺葡萄发酵过程中补充上述“短板”氨基酸将可能提高刺葡萄酒中果香酯类物质的含量。尽管有研究显示在发酵过程中对任意单一氨基酸的补充都将在一定程度上影响特定果香酯类的含量[13],但对于优化刺葡萄酒果香酯类含量、提高香气质量而言,基于特定产区内葡萄的氨基酸组成,针对性地补充发酵体系中的“短板”氨基酸具有更高的经济价值和应用前景。此外,发酵基质中无机氮源的含量及补充时间[38]、有机氮源与无机氮源的组成及比例[39]等对葡萄酒果香酯类的含量也具有明显影响,而本研究未涉及无机氮源的考察。因此,有必要进行进一步研究,明确葡萄果实及葡萄发酵体系中以氨基酸为主的有机氮源的组成对葡萄酒果香酯类的影响,进一步阐释氨基酸对果香酯类生成的作用机理,为基于发酵氮营养调控的果酒增香酿造技术的开发提供更坚实的理论基础。
4 结论
刺葡萄中除脯氨酸外的总氨基酸含量是‘赤霞珠’葡萄的3倍,刺葡萄中天冬氨酸、谷氨酸、精氨酸、γ-氨基丁酸、缬氨酸含量高于‘赤霞珠’,但丙氨酸、苯丙氨酸、异亮氨酸含量显著低于‘赤霞珠’。刺葡萄发酵酒中的乙酸酯、短链脂肪酸乙酯和中链脂肪酸乙酯含量显著低于‘赤霞珠’。氨基酸与果香酯类物质的相关性分析显示,刺葡萄中丙氨酸、苯丙氨酸、异亮氨酸与果香酯类物质的相关性低于‘赤霞珠’中上述氨基酸与果香酯类物质的相关性,这可能是导致刺葡萄酒中果香酯类物质含量显著偏低的原因。
致谢:感谢西北农林科技大学测试中心李爱华老师为本研究提供的仪器分析技术支持。
[1] MENG J F, XU T F, SONG C Z, LI X L, YUE T X, QIN M Y, FANG Y L, ZHANG Z W, ZI Z M. Characteristic free aromatic components of nine clones of spine grape (Foex) from Zhongfang county (China)., 2013, 54(2): 1795-1800
[2] KONG C L, LI A H, SU J, WANG X C, CHEN C Q, TAO Y S. Flavor modification of dry red wine from Chinese spine grape by mixed fermentation withand., 2019, 109: 83-92.
[3] EBELER S E, THORNGATE J H. Wine chemistry and flavor: looking into the crystal glass., 2009, 57(18): 8098-8108.
[4] WANG X C, LI A H, DIZY M, ULLAH N, SUN W X, TAO Y S. Evaluation of aroma enhancement for “Ecolly” dry white wines by mixed inoculation of selectedand., 2017, 228: 550-559.
[5] MORENO-ARRIBAS M V, PUEYO E, POLO M C, MARTÍN- ÁLVAREZ P J. Changes in the amino acid composition of the different nitrogenous fractions during the aging of wine with yeasts., 1998, 46(10): 4042-4051.
[6] HAN F L, JU Y L, RUAN X R, ZHAO X F, YUE X F, QIN M Y, FANG Y L. Color, anthocyanin, and antioxidant characteristics of young wines produced from spine grapes (Foex) in China., 2017, 61(1): 1339552.
[7] 王震, 钟晓红, 李含晰, 徐丰, 金燕, 姚磊. 刺葡萄果实及酿酒过程中白藜芦醇含量变化研究. 中国果树, 2019(3): 14-18.
WANG Z, ZHONG X H, LI H X, XU F, JIN Y, YAO L. Studies on resveratrol content in the fruit and wine brewing process ofFoëx., 2019(3): 14-18. (in Chinese)
[8] 李爱华, 粟俊, 王凌云, 王倩倩, 张琳尉, 陶永胜. 混合酵母发酵对刺葡萄酒香气成分气味活性的调整作用分析. 食品科学, 2020, 41(6): 72-78.
LI A H, SU J, WANG L Y, WANG Q Q. ZHANG L W, TAO Y S. Odor activity modulation of aroma compounds in spine grape wine by the mixed fermentation ofand., 2020, 41(6): 72-78. (in Chinese)
[9] 李华. 葡萄酒品尝学. 北京: 科学出版社, 2006: 35-40.
LI H.. Beijing: Science Press, 2006: 35-40. (in Chinese)
[10] STRIBNY J, GAMERO A, PÉREZ-TORRADO R, QUEROL A.anddiffer fromduring the production of aroma-active higher alcohols and acetate esters using their amino acidic precursors.2015, 205: 41-46.
[11] HERNÁNDEZ-ORTE P, CACHO J F, FERREIRA V. Relationship between varietal amino acid profile of grapes and wine aromatic composition. Experiments with model solutions and chemometric study., 2002, 50(10): 2891-2899.
[12] PROCOPIO S, KRAUSE D, HOFMANN T,BECKER T. Significant amino acids in aroma compound profiling during yeast fermentation analyzed by PLS regression., 2013, 51(2): 423-432.
[13] FAIRBAIRN S, MCKINNON A, MUSARURWA H T, FERREIRA A C, BAUER F F. The impact of single amino acids on growth and volatile aroma production bystrains., 2017, 8: 2554.
[14] 王倩倩, 覃杰, 马得草, 陶永胜. 优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒. 中国农业科学, 2018, 51(11): 2178-2192.
WANG Q Q, QIN J, MA D C, TAO Y S. Aroma enhancement of ecolly dry white wine by co-inoculation of selectedand., 2018, 51(11): 2178-2192. (in Chinese)
[15] 刘国新. 葡萄酒酿造过程中氨基甲酸乙酯形成机制的研究[D]. 天津: 天津科技大学, 2014.
LIU G X. The formation mechanism of ethyl carbamate during the vinification process [D]. Tianjin: Tianjin University of Science & Technology, 2014. (in Chinese)
[16] HU K, JIN G J, XU Y H, XUE S J, QIAO S J, TENG Y X, TAO Y S. Enhancing wine ester biosynthesis in mixedfermentation by nitrogen nutrient addition., 2019, 123: 559-566.
[17] CRANDLES M, REYNOLDS A G, KHAIRALLAH R, BOWEN A. The effect of yeast strain on odor active compounds in Riesling and Vidal blanc icewines., 2015, 64(1): 243-258.
[18] SYNOS K, REYNOLDS A G, BOWEN A J. Effect of yeast strain on aroma compounds inicewines., 2015, 64(1): 227-235.
[19] FERREIRA V, LÓPEZ R, CACHO J F. Quantitative determination of the odorants of young red wines from different grape varieties., 2000, 80(11): 1659-1667.
[20] PENG C T, WEN Y, TAO Y S, LAN Y Y. Modulating the formation of Meili wine aroma by prefermentative freezing process., 2013, 61(7): 1542-1553
[21] HU K, QIN Y, TAO Y S, ZHU X L, PENG C T, ULLAH N. Potential of glycosidase from non-isolates for enhancement of wine aroma., 2016, 81(4): M935-M943.
[22] TAO Y S, LI H. Active volatiles of Cabernet Sauvignon wine from Changli County., 2009, 1(3): 176-182.
[23] Huang Z, Ough C S. Amino acid profiles of commercial grape juices and wines., 1991, 42(3): 261-267.
[24] LEE J, SCHREINER R P. Free amino acid profiles from ‘Pinot noir’ grapes are influenced by vine N-status and sample preparation method., 2010, 119(2): 484-489.
[25] GUTIÉRREZ-GAMBOA G, CARRASCO-QUIROZ M, MARTÍNEZ- GIL A M, PÉREZ-ÁLVAREZ E P, GARDE-CERDÁN T, MORENO- SIMUNOVIC Y. Grape and wine amino acid composition fromgrapevines growing under rainfed conditions in the Maule Valley, Chile: Effects of location and rootstock., 2018, 105: 344-352.
[26] 高年发, 李磊, 邓旭衡, 宋磊. 葡萄酒酿造过程中氨基酸含量变化的研究. 中国酿造, 2011(1): 28-33.
GAO N F, LI L, DENG X H, SONG L. Changes of free amino acids during wine fermentation., 2011(1): 28-33. (in Chinese)
[27] GARDE-CERDÁN T, MARTÍNEZ-GIL A M, LORENZO C, LARA J F, PARDO F, SALINAS M R. Implications of nitrogen compounds during alcoholic fermentation from some grape varieties at different maturation stages and cultivation systems., 2011, 124(1): 106-116.
[28] BELTRAN G, ESTEVE-ZARZOSO B, ROZÈS N, MAS A, GUILLAMÓN J M. Influence of the timing of nitrogen additions during synthetic grape must fermentations on fermentation kinetics and nitrogen consumption., 2005, 53(4): 996-1002.
[29] SUMBY K M, GRBIN P R, JIRANEK V. Microbial modulation of aromatic esters in wine: Current knowledge and future prospects.2010, 121(1):1-16.
[30] 鲍瑞峰. 刺葡萄果实与刺葡萄酒香气成分的研究[D]. 长沙: 湖南农业大学, 2010.
BAO R F. Study on the aroma components ofFoex fruit andFoex wine [D]. Changsha: Hunan Agricultural University, 2010. (in Chinese)
[31] MARTÍNEZ-PINILLA O, GUADALUPE Z, HERNÁNDEZ Z, AYESTARÁN B. Amino acids and biogenic amines in red varietal wines: The role of grape variety, malolactic fermentation and vintage.2013, 237(6): 887-895.
[32] ARDÖ Y. Flavour formation by amino acid catabolism., 2006, 24(2): 238-242.
[33] UGLIANO M, HENSCHKE P A. Yeasts and wine flavor//. New York: Springer, 2009: 313-392.
[34] HERNÁNDEZ-ORTE P, IBARZ M J, CACHO J, FERREIRA V. Effect of the addition of ammonium and amino acids to musts of Airen variety on aromatic composition and sensory properties of the obtained wine., 2005, 89(2): 163-174.
[35] GARDE-CERDÁN T, ANCÍN-AZPILICUETA C. Effect of the addition of different quantities of amino acids to nitrogen-deficient must on the formation of esters, alcohols, and acids during wine alcoholic fermentation., 2008, 41(3): 501-510.
[36] CHEN D, CHIA J Y, LIU S Q. Impact of addition of aromatic amino acids on non-volatile and volatile compounds in lychee wine fermented withMERIT. ferm., 2014, 170: 12-20.
[37] HERNÁNDEZ-ORTE P, IBARZ M J, CACHO J, FERREIRA V. Addition of amino acids to grape juice of the Merlot variety: Effect on amino acid uptake and aroma generation during alcoholic fermentation., 2006, 98(2): 300-310.
[38] SEGUINOT P, ROLLERO S, SANCHEZ I,SABLAYROLLES J M, ORTIZ-JULIEN A, CAMARASA C, MOURET J R. Impact of the timing and the nature of nitrogen additions on the production kinetics of fermentative aromas byduring winemaking fermentation in synthetic media., 2018, 76: 29-39.
[39] TORREA D, VARELA C, UGLIANO M, ANCIN-AZPILICUETA C, FRANCIS I L, HENSCHKE P A. Comparison of inorganic and organic nitrogen supplementation of grape juice–Effect on volatile composition and aroma profile of a Chardonnay wine fermented withyeast., 2011, 127(3): 1072-1083.
Correlation Analysis Between Amino Acids and Fruity Esters During Spine Grape Fermentation
ZHU ZiJian1, CHEN SiYu1, SU Jun2, TAO YongSheng1, 3
(1College of Enology, Northwest A&F University, Yangling 712100, Shaanxi;2Hunan Research Center of Spine Grapes, Hongjiang 418200, Hunan;3Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, Shaanxi)
【】The aim of this study was to reveal the correlation between amino acid composition and fruity ester production during fermentation of spine grapes, so as to provide the theoretical guidance for aroma enhancement fermentation of spine grape wine.【】A spine grape variety, Xiangzhenzhu, was used to conduct alcoholic fermentation with, and Cabernet Sauvignon grape was served as control. During fermentation, sampling was carried out every 24 h to analyze the concentrations of amino acids and esters by using HPLC and GC-MS, respectively. Furthermore, the mathematical relationship between these two parameters was analyzed by Pearson correlation analysis.【】Total content of amino acids (except proline) in spine grape was 3 folds higher than that in Cabernet Sauvignon grape, with 2.4, 2.2, 4.2, 7.7 and 3 folds for aspartic acid, valine, glutamic acid, γ-aminobutyric acid and arginine, respectively. However, the content of alanine, phenylalanine and isoleucine in spine grape only accounted for 10%, 35% and 20%, respectively. Compared with Cabernet Sauvignon, fermentation with spine grape only produced 55%, 11% and 69% in the concentrations of acetates, short-chain fatty acid ethyl esters, and medium-chain fatty acid ethyl esters, respectively. Pearson correlation analysis further showed that the correlation coefficient between alanine, phenylalanine, isoleucine and acetate, fatty acid ethyl ester was 0.552-0.837 during fermentation with spine grape, which was significantly lower than that of Cabernet Sauvignon.This might be related to low content of fruity esters in spine grape wine.【】Low content of alanine, phenylalanine and isoleucine could negatively affect ester productions during alcoholic fermentation.
wine; spine grape; amino acid; fruity ester; correlation analysis

10.3864/j.issn.0578-1752.2020.11.013
2019-09-30;
2019-12-16
国家自然科学基金(31972199)、陕西省杰出青年科学基金(2020JC-22)、中央高校基本科研业务费专项基金(2452019182)
朱子健,E-mail:zhuzijian@nwafu.edu.cn。通信作者陶永胜,E-mail:taoyongsheng@nwafu.edu.cn
(责任编辑 赵伶俐)
