大黄素来源的研究进展综述
2020-07-30于彦民王真真
于彦民 王真真
摘 要
大黄素作为多种中药中广泛存在的一种羟基蒽醌类化合物,具有抗炎、抗菌、抗病毒、抗肿瘤、止咳及降血压等多种药理作用,具有良好的临床应用前景。本文根据大黄素的不同来源方式,从中药中提取分离、生物合成以及有机合成等三个方面全面概括了目前大黄素来源的新进展,以期为大黄素的工业化生产提供借鉴意义。
关键词
大黄素;中药中提取分离;生物合成;有机合成
中图分类号: R285.5 文献标识码: A
DOI:10.19694/j.cnki.issn2095-2457.2020.16.081
大黄素(1,3,8-三羥基-6-甲基蒽醌)是一种天然蒽醌类化合物,橘黄色晶体,难溶于水,易溶于乙醇等极性有机溶剂,广泛存在于芦荟、大黄、首乌藤、鼠尾草、决明子、瞿麦和虎杖等多种植物及中草药中[1]。大黄素具有抗炎、抗菌、抗病毒、抗肿瘤、止咳和降血压等多种药理作用[2],在临床上大黄素被广泛应用到肠道、肾脏、心血管及胰腺等器官相关疾病的治疗[3]。我国为中药大国,各类中药资源丰富,但由于蒽醌类化合物提取纯化的困难性,纯品大黄素依旧相对短缺。基于这种现状,本文分别从中药提取、生物合成及有机合成等角度全面总结了目前大黄素的来源,期望为相大黄素的工业化生产提供借鉴意义。
1 中药中提取分离
从中药中提取分离纯化是目前大黄素的主要来源,应用不同的提取分离方法与技术可显著影响其提纯的效果,因此改善提取工艺与加工技术也是目前研究的重点方向。
1.1 溶剂萃取法
大黄素传统的提取方法为水煎煮法、回流法和渗漉法。公等[4]使用不同的pH酸水提取虎杖根茎,在最优条件下10g虎杖根茎粗粉中大黄素提取量可达70.3mg,提取率为0.703%。曹等[5]报道对大黄粉末采用15%硫酸与氯仿混合提取,优化条件后大黄素提取率可高达0.79%。但采用传统方法提取时,溶剂耗费量大,提取时间长,中药活性成分高温作用下有可能被破坏,提取效率低,有机溶剂也会对环境造成一定损害,因此许多新的工艺及技术已经逐渐开发替代传统方法[6]。
1.2 能量辅助提取法
中药中活性成分大多存在于细胞中,加热等常规方式难以破坏植物细胞壁,导致提取效率较低,而外加辅助能量(超声、微波、微流动力等),帮助细胞壁破裂,增加溶剂与细胞内有效成分碰撞,可增加活性成分的提取效率。超声波[7]以其显著的振动效应、热效应、机械效应以及空化效应增加了中药中活性成分的提取效率,而微波[8]能是利用电磁场的作用,能直接作用到细胞内部进行加热。微射流技术[9]借助微射流发生器,给予物料一定动力,使其向不同方向高速运动,在细胞发生碰撞的瞬间物理破裂,增加有效成分的溶出。采用超声波、微波、微流控等能量供给方式,促使植物细胞易于破裂,加速有效成分的扩散与溶解,具有提取速度快,能量消耗小,溶剂用量小,萃取效率高,环境污染小等众多优势。高等发现,温度70oC,有机溶剂比例80%,料液比为1:20,超声时间30min,即可使虎杖中大黄素的提取率升高至1.4%[10]。邹等采用超声及微波协同方式进行虎杖中大黄素提取,在50W超声波,30W微波作用下,5min大黄素产率高达1.26%[11]。微波辅助的(NH4)2SO4 /乙醇双相体系被应用来萃取虎杖中大黄素[12],超声波辅助Na2SO4 /丙醇双相体系提取大黄中蒽醌类成分,总蒽醌收率相比普通方法提高了61.8%[13]。吴少莉比较了微射流提取法与煎煮法对虎杖饮片中大黄素的提取效率,同样使用60%乙醇作为提取媒介,发现微射流对大黄素的提取率为0.323%,而在煎煮法提取液中未检测到大黄素[14]。
1.3 临界流体萃取法
临界流体萃取法即采用临界状态的物质作为提取溶剂,例如超临界流体[15]、亚临界水[16]等。超临界流体采用的萃取剂一般为CO2,在CO2接近液体的密度时具有较高的溶解度,同时兼具良好的流动性,具有较强的萃取能力。亚临界水是在高温作用下,水的氢键数目减少,极性减弱,从而使亚临界水具有较强的极性范围,实现连续提取水溶性及脂溶性组分。临界流体提取具有工艺简便、提取时间短、效率高、溶剂与组分可快速分离,环境友好等众多优点。童胜强等采用超临界流体CO2提取虎杖中的大黄素,采用1%的无水乙醇作为改性剂,正交实验筛选最优提取条件下大黄素的提取率为0.36%[17]。毛等发现在不同条件下使用亚临界水提取法对大黄素的提取率均高于有机溶剂提取法[18]。可见临界流体在大黄素的提取中具有潜在应用前景。
2 生物合成
合成生物学的发展为制备大黄素提供了新的方法。通过将细菌、真菌等微生物与中药共培养,利用微生物产生的特定催化酶对中药中的活性成分进行转化,为中药的开发利用提供了新方向[19]。并且大黄素本身即为一些微生物的次级代谢产物,在青霉菌属、黄丝曲霉属及曲霉属的代谢物中均有发现[20]。田等发现将虎杖与一株产生β-葡萄糖苷酶的根霉菌株T-34共发酵,其能将虎杖中大黄素β-葡萄糖苷的糖苷键水解,优化发酵及提取条件后,可使大黄素产率提高至2.25%[21]。杜等偶然发现赭曲霉(Aspergillus Ochraceus)可以大量产生大黄素,通过离子注入诱变高产菌株,并进一步优化其发酵过程,但大黄素在发酵液中含量较少,而大部分存在于菌体中。通过对虎杖、何首乌、决明子、大黄、齿果酸模、羊蹄等六种中药的根、茎、叶进行大黄素定量分析发现,大黄根部含量最高可达9.69mg/g,但仍然仅为赭曲霉菌丝中大黄素含量的2/3(14.58mg/ml),可见微生物的培养开发有望成为大黄素来源的一种重要方法[22]。
3 有机合成
鉴于大黄素在中药中含量的限制以及提取纯化的困难性,随着合成方法学的发展,化学家也在一直探索使用有机合成的方法来构建大黄素[23]。但目前现有的合成路线仍然存在产率较低、路线复杂等各种缺点,简便高产的合成路线仍有待开发。
3.1 半合成
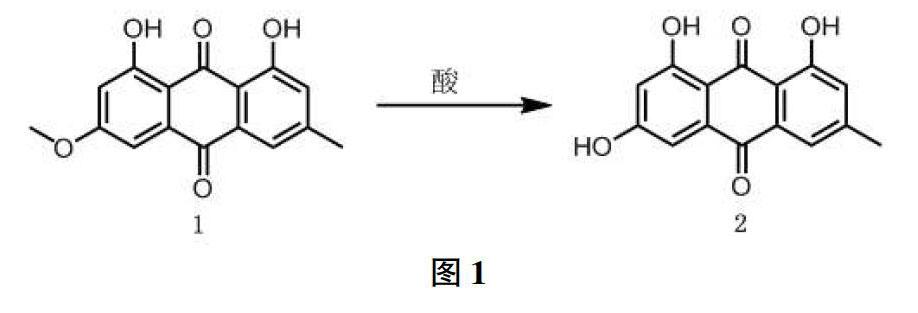
大黄素3位羟基的甲基化衍生物被熟知为大黄素甲醚,同为蓼科植物中含量较为丰富天然蒽醌类化合物,可通过简单的pH梯度萃取大量提取。在众多酸性条件下(例如盐酸吡啶盐、氢溴酸等),大黄素甲醚1即可高效率脱去甲基转化为大黄素2(图1)。[24,25]
3.2 全合成
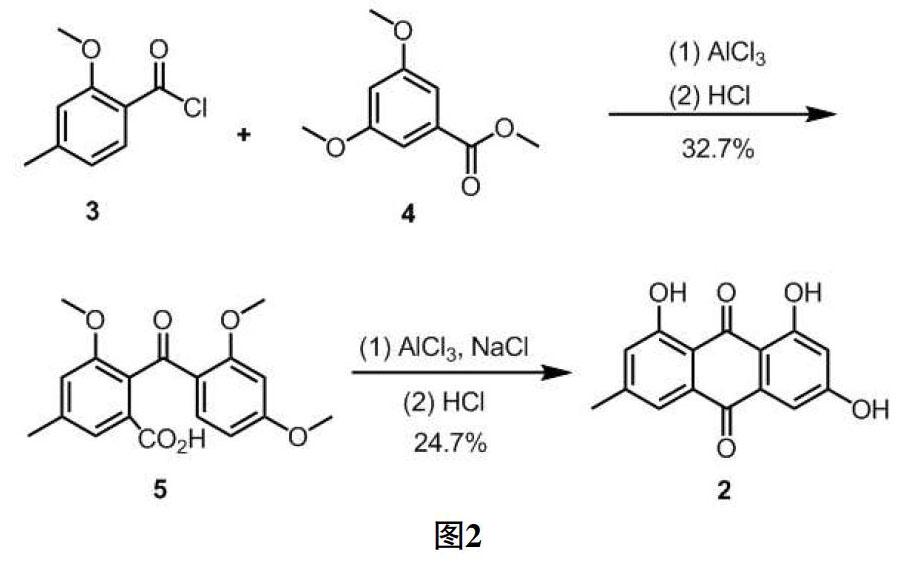
1923年,Eder第一个报道了大黄素的全合成方法,以间甲酚及3,5-二硝基邻苯二甲酸酐作为原料,经过两次Friedel-C rafts反应构建蒽醌主体,并采用硝基还原,重氮化等四步反应完成大黄素的全合成,收率文章中未见报道[26]。Gravers[27]和Jacobson[28]均采用3,5-二甲氧基邻苯二甲酸酐作为原料,同样经Friedel -Crafts反应与间甲酚构建酮基,后经分子内傅克反应作为关键步完成大黄素的全合成。但3,5-二甲氧基邻苯二甲酸酐并非市售易得的原料,且这些路线繁琐复杂,收率较低。大黄素通常也被用来作为制备金丝桃素的原料,在探索金丝桃素的合成路线中,Liang[29]采用两步Fridel-Crafts反应合成,如Fig.2所示,以7.7%收率合成了大黄素,反应路线简洁,但反应收率较低,不适合工业大量生产。
大黄素具有抗菌、抗病毒、抗炎、抗肿瘤等多种重要药理活性,在临床具有广泛的应用前景,发挥了重要的治疗作用,但由于其提取纯化的困难性及其来源的局限性,目前国内纯品大黄素仍较为短缺。本文首先总结了大黄素最新的药理活性研究进展,进一步从中药中提取分离、生物合成及有机合成等三个方面详细的介绍了目前大黄素来源的研究新进展。从传统中药中提取分离的产率相对较低,有机合成也存在产率低、路线复杂等相关问题,生物合成在大黄素的生产上展现了巨大的潜力,但如何提高大黄素从菌丝中释放速度也存在一定的挑战,因此高效的大黄素生产路线仍有待开发研究。
参考文献
[1]黄兆胜,王宗伟.大黄素基原及药理作用研究[J].国外医学中医中药分册,1997, 19(5):9-12.
[2]Dong X,Fu J,Yin X,et al.Emodin:A Review of its Pharmacology,Toxicity and Pharmacokinetics[J].Phytotherapy Research,2016,30(8):1207-1218.
[3]周子洪.中药大黄素的临床应用研究进展[J].心血管病防治知识(学术版),2015, (04):154-156.
[4]公衍玲,王宏波,金宏,et al.虎杖主要提取物半仿生提取条件的优选[J].青岛科技大学学报(自然科學版),2007,28(03):202-204.
[5]曹云丽,黄强,班春兰,et al.对中药大黄中蒽醌类物质的提取分离方法的研究[J]. 云南中医中药杂志,2005,26(1):36-38.
[6]Qing-Wen Zhang,Li-Gen Lin,Ye.W-C.Techniques for extraction and isolation of natural products: a comprehensive review[J].Chinese Medicine,2018,13:20-45.
[7]徐小燕.超声技术在中草药提取中的应用[J].中国药房,2007,18(18): 1426-1429.
[8]马长雨,杨悦武,郭治昕,et al.微波萃取在中药提取和分析中的应用[J].中草药, 2004,35(11):7-10.
[9]王利文,潘家祯.超高压超临界微射流技术提取中药有效成分新方法[J].时珍国医国药,2008,19(10):2453-2455.
[10]高明波,马金龙,杜崇旭,et al.虎杖中大黄素的超声波提取工艺优化[J].湖北农业科学,2015,54(12):2991-2993.
[11]邹时英,谭文渊,李富兰,et al.超声波-微波协同萃取虎杖中大黄素[J].四川理工学院学报(自然科学版),2011,24(5):509-511.
[12]Wang H,Dong Y,Xiu Z-L.Microwave-assisted aqueous two-phase extraction of piceid, resveratrol and emodin from Polygonum cuspidatum by ethanol/ammonium sulphate systems[J].Biotechnology Letters,2008,30(12):2079-2084.
[13]姚琴,赵茂俊,张利,et al.超声辅助双水相提取大黄中蒽醌类成分[J].天然产物研究与开发,2018,8:1346-1353.
[14]吴少莉,黄裕,彭颖华,et al.微射流技术提取虎杖中有效成分的研究[J].现代中医药,2018,6:123-126.
[15]杨必成,杨义芳.超临界流体萃取中药及天然产物的样品制备和预处理方法研究进展[J].中草药,2010,41(8):1391-1394.
[16]张振巍,李国庆,仇继玺,et al.亚临界水萃取技术在中药领域的发展及应用[J]. 中医学报,2014,29(197):1494-1496.
[17]童胜强,颜继忠,钟朝康,et al.超临界流体CO2提取虎杖中的有效成分[J].应用化工,2006,35(3):208-209.
[18]毛银春.大黄中蒽醌类衍生物的亚临界水提取研究[D].西华大学,2016.
[19]黄璐琦,高伟,周雍进.合成生物学在中药资源可持续利用研究中的应用[J].药学学报,2014,49(1):37-43.
[20]Izhaki I.Emodin a secondary metabolite with multiple ecological functions in higher plants[J].New Phytologist,2002,155(2):205-217.
[21]田天丽,王嫱,王永宏,et al.虎杖的微生物发酵转化及其发酵产物提取分离的研究[J].天然产物分离,2006,4(4):1-4.
[22]吕平.赭曲霉发酵产大黄素及其生物合成途径和诱发机制的研究[D].天津大學,2009.
[23]梁英,喻大昭.大黄素的化学合成及结构修饰研究进展[J].有机化学,2011,31(8): 1324-1333.
[24]闻永举,申秀丽,陈灵艳,et al.虎杖中大黄素甲醚脱甲基的研究[J].江苏农业科学,2010,2:322-323.
[25]丁镇,张德志.脱甲基制备大黄素的方法比较[J].广东药学院学报,2007,23(1): 28-29.
[26]Eder R,Widmer C.Untersuchungen über Derivate des β-Methylanthrachinons. III.Mitteilung.Synthese des Frangula-Emodins[J].Helvetica Chimica Acta,1923,6(1): 966-981.
[27]Graves G D,Adams R.TRIHYDROXY-METHYL-ANTHRAQUINONES.I[J].Journal of the American Chemical Society,1923,45(10):2439-2455.
[28]Jacobson R A,Adams R.Trihydroxy-methylanthraquinones.III.Synthesis of emodin[J].Journal of the American Chemical Society,1924,46(5):1312-1316.
[29]梁剑平,白卫兵,车清明,et al.金丝桃素及其衍生物的化学合成方法,2006.
