miR-363-3p靶向TWIST1调控上皮间质转化抑制非小细胞肺癌A549细胞迁移和侵袭
2020-07-30
越来越多的研究表明,抑制上皮间质转化(epithelial-mesenchymal transition,EMT)进程是抑制肿瘤转移的重要机制,而微小RNA(microRNA,miRNA)在此过程中发挥着重要的调控作用[1-3]。miR-363-3p是一种与肿瘤转移关系密切的miRNA,在结直肠癌、胃癌和甲状腺乳头状癌等肿瘤组织中表达下调,上调其表达可抑制癌细胞的迁移和侵袭[4-6]。有学者指出,miR-363-3p 在非小细胞肺癌中异常低表达,且其表达与淋巴结转移呈正相关,但其在癌细胞转移中的作用并不明确[7]。采用生物信息学软件预测发现,miR-363-3p 与EMT相关转录因子TWIST13'UTR存在互补的核苷酸序列,可能通过靶向TWIST1调控EMT进程影响非小细胞肺癌细胞的转移。本研究以非小细胞肺癌A549细胞为研究对象,通过观察miR-363-3p和TWIST1的关系,旨在阐明miR-363-3p 在非小细胞肺癌EMT进程和癌细胞转移中的作用,为改善和治疗非小细胞肺癌提供新的线索。
材料与方法
一、材料
人非小细胞肺癌A549细胞(中国科学院上海生命科学研究院);胎牛血清(货号2104,杭州四季青公司);RPMI-1640培养基(货号C22400500BT,美国Gibco公司);胰蛋白酶(货号T0458,上海生工生物公司);β-actin抗体(货号ET1702-52,华安生物公司);TWIST1抗体(货号T6454MSDS,美国Sigma公司),Vimentin抗体(货号5741)、E-cadherin抗体(货号3195,美国Cell Signaling Technology公司);辣根过氧化物酶标记的羊抗鼠/兔二抗(货号926-32221,美国Li-Cor公司);LipofectamineTM2000(货号11668-027,美国Introvgen公司);Matrigel基质(货号356237,美国BD公司);Transwell板(美国Corning公司);PVDF膜(美国Bio-Rad公司);miR-363-3p模拟物、miR-363-3p抑制剂及相应的阴性对照(上海GenePharma公司);pcDNA3.1-TWIST1 过表达质粒和pcDNA3.1 空载体质粒(长沙赢润生物技术公司);Dual-luciferase检测试剂盒说明书(美国Promega公司);反转录试剂盒、Bradford蛋白浓度测定试剂盒(中国Beyotime公司)。
二、方法
1.细胞培养、分组与转染:人非小细胞肺癌A549细胞购于中国科学院上海生命科学研究院。采用含100 ml/L胎牛血的RPMI-1640培养基于5﹪CO2的37℃恒温培养箱中常规培养。实验分为:空白对照组(细胞未做任何处理);模拟物对照组(转染miR-363-3p模拟物阴性对照);模拟物组(转染miR-363-3p模拟物);每组设置3个平行孔。转染前24 h,将长势良好的对数生长期A549细胞按照每孔6×105个细胞平铺于6孔细胞板上,于培养箱内常规培养过夜。严格按照LipofectamineTM2000转染试剂说明书步骤按照实验分组将50 μmol/L的miRNA试剂转染至A549细胞中。待转染48 h后,收集各组A549细胞进行实验。后期实验另设:模拟物+pcDNA组(转染miR-363-3p模拟物和pcDNA3.1 空载体质粒)、模拟物+TWIST1组(转染miR-363-3p模拟物和pcDNA3.1-TWIST1过表达质粒),每组设置3个平行孔。以LipofectamineTM2000转染后,收集各组细胞,采用进行 Western blot和Transwell 小室实验分别检测TWIST1过表达对miR-363-3p 高表达的A549细胞EMT、迁移和侵袭的影响。
2.RT-PCR检测miR-363-3p和TWIST1mRNA的表达:以Trizol 法提取待测A549细胞的总RNA后,采用Nanodrop 2000分析总RNA纯度。根据反转录试剂盒说明书步骤将RNA 进行逆转录,并将所得到的逆转录产物cDNA作为模板,U6或β-actin为内参进行PCR扩增,miR-363-3p和TWIST1mRNA的相对表达量采用2-ΔΔCT法进行计算。其中,由北京Tiangen Biotech公司合成的miR-363-3p、U6、TWIST1、β-actin 引物序列见表1。实验重复3次。
3.Western blot检测TWIST1和EMT相关蛋白Vimentin、E-cadherin的表达:向待测的A549细胞中加入裂解液裂解细胞获取总蛋白,并采用Bradford法对总蛋白定量。将其与上样缓冲液混合均匀后,置于沸水浴中煮沸3~5 min。按照每孔60 μg蛋白样品上样行SDS-PAGE电泳分离。转至PVDF膜后,以含有50 g/L脱脂奶粉的TBST溶液封闭1.5 h。加入1:500 稀释的一抗工作液4℃下结合反应24 h。次日经TBST溶液洗膜后,置于1:2 000稀释的二抗工作液中常温反应1 h。显影后,采用Image 软件分析目的蛋白的相对表达水平。目的蛋白的相对表达水平=目的条带灰度值/内参β-actin条带灰度值。实验重复3次。
4.Transwell 小室实验检测细胞的侵袭和迁移能力:侵袭实验:(1)将以培养液稀释后的Matrigel基质胶按照每孔80 μL 平铺于Transwell 小室的上室,37℃下充分融合备用;(2)取24孔细胞板加入600 μL 含10﹪胎牛血清的培养基,放上Transwell小室,并于上室内加入细胞悬液200 μL(细胞数为4×103个);(3)放入培养箱内常规培养24 h;(4)将Transwell小室取出,采用4﹪多聚甲醛对转移并附着在上室下表面的细胞固定10~15 min,并以1 g/L结晶紫染色10~20 min;(5)洗去染色液后,风干并以显微镜进行观察。结果以随机选取的6个高视野视野中细胞数的均值表示。迁移实验:同侵袭实验步骤相似,无需进行第1步。实验重复3次。
5.miR-363-3p和TWIST1靶向关系的验证:转染前24 h,将长势良好的对数生长期A549细胞以105个/孔的密度接种至12孔细胞板上,待细胞生长至70﹪融合度时,参照LipofectamineTM2000转染试剂说明书步骤将百奥迈科生物技术有限公司构建的野生型(TWIST1-WT)和突变型(TWIST1-MUT)的TWIST13'-UTR 双荧光报告质粒分别与miR-363-3p模拟物/抑制剂和相应阴性对照共转染至A549细胞中。每组设置3个平行孔。转染48 h后,参照Dual-luciferase检测试剂盒说明书检测各组细胞的荧光素酶活性。实验重复3次。
三、统计学分析方法
采用SPSS22.0 软件进行统计学分析,A549细胞中miR-363-3p、TWIST1、Vimentin和E-cadherin表达水平、荧光素酶活性、侵袭细胞数和迁移细胞数以表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
一、转染后A549细胞中miR-363-3p表达升高而TWIST1表达降低
与空白对照组和模拟物对照组比较,模拟物组A549细胞中miR-363-3p表达水平升高,TWIST1mRNA和蛋白的表达水平降低,差异具有统计学意义(P均<0.05);而空白对照组和模拟物对照组之间的miR-363-3p表达水平、TWIST1mRNA和蛋白的表达水平之间比较差异无统计学意义(P> 0.05)。(图1、表2)

图1 Western blot检测TWIST1蛋白的表达
表2 模拟物干预后A549细胞中miR-363-3p 及TWIST1 mRNA和蛋白表达水平(±s,n = 3)

表2 模拟物干预后A549细胞中miR-363-3p 及TWIST1 mRNA和蛋白表达水平(±s,n = 3)
注:与空白对照组比较,aP <0.001;与模拟物对照组比较,bP <0.001;n为实验重复次数
分组 miR-363-3p表达量TWIST1 mRNA表达量TWIST1蛋白表达量空白对照组 1.00±0.08 1.00±0.06 0.81±0.05模拟物对照组 0.97±0.05 0.98±0.06 0.78±0.06模拟物组 3.82±0.45ab 0.39±0.02ab 0.42±0.02ab F值 114.067 142.223 65.215 P值<0.001<0.001<0.001
二、TWIST1是miR-363-3p潜在的靶基因
采用TargetScan 软件预测发现,TWIST13' UTR区域有能够与miR-363-3p 互补结合的核苷酸序列(图2)。采用双荧光素酶报告基因实验检测发现,与模拟物对照组比较,模拟物组TWIST1-WT活性(1.00±0.10 比0.42±0.04)降低(t= 9.327,P= 0.001),与抑制剂对照组比较,抑制剂组TWIST1-WT活性(1.08±0.07比2.96±0.30)增高(t= 10.570,P<0.001)。(图3)

图2 TWIST1 3' UTR 与miR-363-3p的结合位点

图3 模拟物及抑制剂干预细胞后双荧光素酶相对活性
三、miR-363-3p过表达抑制A549细胞EMT进程
Western blot检测发现,与空白对照组和模拟物对照组比较,模拟物组A549细胞Vimentin蛋白表达水平降低,E-cadherin蛋白的表达水平增高,差异有统计学意义(P均<0.05);与空白对照组比较,模拟物对照组Vimentin和E-cadherin蛋白表达水平之间比较差异无统计学意义(P> 0.05);与模拟物对照组比较,模拟物组A549细胞Vimentin蛋白表达水平降低,E-cadherin蛋白的表达水平增高,差异有统计学意义(P均<0.05)。(图4、表3)
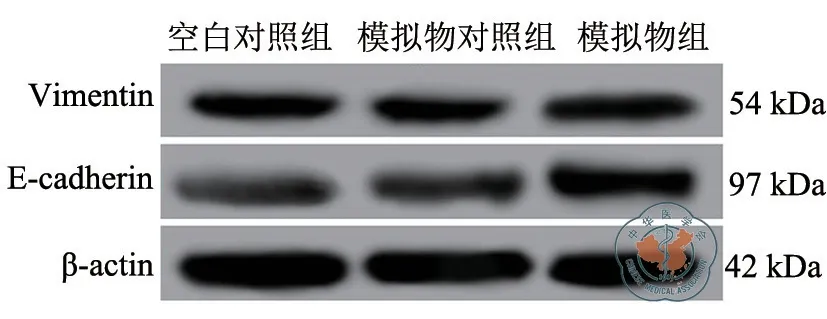
图4 Western blot检测Vimentin和E-cadherin蛋白的表达
表3 miR-363-3p过表达对A549细胞中Vimentin和E-cadherin蛋白的相对表达水平(±s,n = 3)

表3 miR-363-3p过表达对A549细胞中Vimentin和E-cadherin蛋白的相对表达水平(±s,n = 3)
注:与空白对照组比较,aP <0.001;与模拟物对照组比较,bP <0.001;n为实验重复次数
分组 Vimentin蛋白表达量 E-cadherin蛋白表达量空白对照组 0.58±0.04 0.22±0.02模拟物对照组 0.55±0.05 0.25±0.03模拟物组 0.36±0.03ab 0.47±0.03ab F值 25.620 76.227 P值 0.001<0.001
四、miR-363-3p过表达抑制A549细胞迁移和侵袭
Transwell 实验发现,与空白对照组和模拟物对照组比较,模拟物组迁移细胞数和侵袭细胞数减少,差异具有统计学意义(P均<0.05);与空白对照组比较,模拟物对照组迁移细胞数和侵袭细胞数之间比较差异无统计学意义(P均> 0.05);与模拟物对照组比较,模拟物组迁移细胞数和侵袭细胞数减少,差异具有统计学意义(P均<0.05)。(表4、图5)
表4 miR-363-3p过表达对A549细胞侵袭和迁移的影响(±s,n = 3)

表4 miR-363-3p过表达对A549细胞侵袭和迁移的影响(±s,n = 3)
注:与空白对照组比较,aP <0.001;与模拟物对照组比较,bP <0.001;n为实验重复次数
分组迁移细胞数(个)侵袭细胞数(个)空白对照组 85.75±5.45 128.26±6.15模拟物对照组 83.52±6.85 125.95±8.05模拟物组 53.05±4.50ab 71.64±5.75ab F值 30.990 68.106 P值<0.001<0.001
五、TWIST1逆转miR-363-3p过表达对A549细胞EMT、迁移和侵袭的抑制作用
与模拟物+pcDNA3.1组比较,转染pcDNA3.1-TWIST1过表达质粒后,miR-363-3p过表达的A549细胞中Vimentin蛋白的表达水平升高,而E-cadherin蛋白表达水平降低,A549细胞的迁移数和侵袭数增加(P均<0.05)。(图6~图7和表5)
讨 论
表5 TWIST1 对miR-363-3p过表达的A549细胞EMT、迁移和侵袭的影响(±s,n = 3)

表5 TWIST1 对miR-363-3p过表达的A549细胞EMT、迁移和侵袭的影响(±s,n = 3)
分组 Vimentin蛋白表达量 E-cadherin蛋白表达量迁移细胞数(个)侵袭细胞数(个)模拟物+pcDNA3.1组 0.32±0.02 0.56±0.04 49.45±4.22 72.45±5.73模拟物+TWIST1组 0.42±0.03 0.38±0.03 67.52±5.05 108.35±6.56 t 值 4.804 6.235 4.756 7.139 P值 0.009 0.003 0.009 0.002
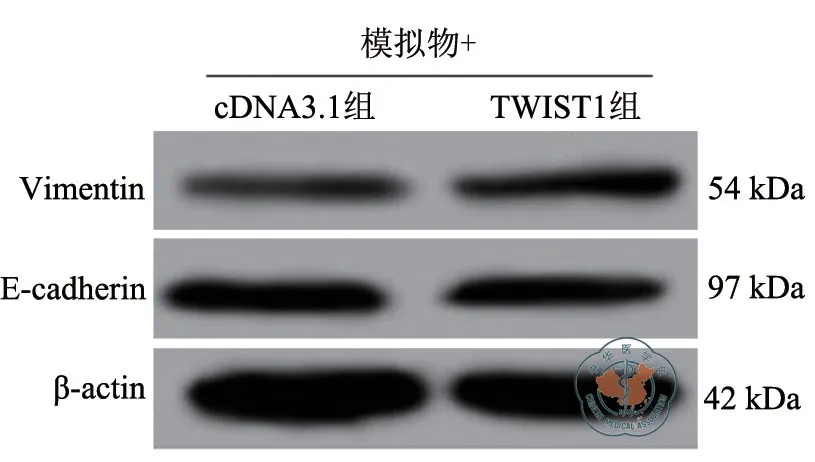
图7 Western blot检测Vimentin和E-cadherin蛋白表达
EMT是赋予肿瘤细胞迁移和侵袭能力的生物学过程,被认为是肿瘤复发和转移的主因。随着研究的不断深入,人们发现越来越多的miRNA 如miR-330、miR-4472和miR-194-5p 等在调控EMT过程中发挥着重要作用[8-10]。miR-363-3p是一个值得关注的miRNA,被认为具有潜在的抑瘤作用。miR-363-3p 高表达被认为是宫颈腺癌预后良好的重要预测指标[11];肾癌中miR-363-3p表达缺失时可使致癌基因CREB1过表达,而引入miR-363-3p可通过下调CREB1表达抑制肿瘤细胞的增殖、迁移[12]。另外,有学者指出,miR-363-3p 在伴有淋巴结转移结直肠癌组织中经常下调,而下调miR-363-3p表达可通过靶向Sox4诱导EMT进程,促进癌细胞的迁移和侵袭[4]。
本研究采用TargetScan 软件预测发现,TWIST13' UTR区域有能够与miR-363-3p 互补结合的核苷酸序列,并通过双荧光素酶报告基因实验检测证实TWIST1是miR-363-3p的潜在靶基因。TWIST1是一种可诱导肿瘤EMT 过程的核转录因子,与恶性肿瘤转移关系密切[13]。TWIST1在非小细胞肺癌组织中高表达,在癌细胞的生长、侵袭和转移过程中发挥着重要的促进作用;另外减少TWIST1表达可通过抑制EMT 间质蛋白N-cadherin表达抑制癌细胞侵袭[14-16]。有研究指出,miR-363-3p 在非小细胞肺癌组织中异常低表达,且其表达与淋巴结转移呈正相关,可通过靶向PCNA抑制癌细胞增殖并诱导细胞凋亡,但其是否通过靶向TWIST1调控EMT进程进而影响非小细胞肺癌转移[7,17]。
E-cadherin表达减少和Vimentin表达增多常被认为是发生EMT的重要标志[18-20]。有研究指出,E-cadherin 在淋巴结转移的非小细胞肺癌组织中表达降低,而Vimentin 则相反,EMT 可能在非小细胞肺癌的淋巴转移过程中发挥着重要作用[21]。通过构建miR-363-3p过表达的非小细胞肺癌A549细胞株,本研究发现miR-363-3p过表达可引起TWIST1和Vimentin表达降低,而E-cadherin表达升高,抑制EMT进程;同时,miR-363-3p过表达可明显减弱A549细胞的迁移和侵袭能力。此外,TWIST1过表达后,miR-363-3p 对A549细胞EMT、迁移和侵袭的抑制作用得以逆转。提示,miR-363-3p 可通过靶向TWIST1调控EMT抑制A549细胞的迁移和侵袭。根据相关文献报道,TWIST1 基因可能通过抑制Ecadherin蛋白表达,上调Vimentin蛋白表达促进了EMT,进而增强肿瘤细胞的转移能力[22-23]。然而其可能的机制有待于进一步研究。
综上所述,miR-363-3p 在非小细胞肺癌发生发展过程中具有抑制癌细胞迁移和侵袭的作用,而靶向TWIST1抑制EMT进程是其重要的机制之一。然而,非小细胞肺癌恶性转移的分子机制十分复杂,如何更全面的阐明miR-363-3p 在非小细胞肺癌发生发展中的作用还有待深入研究。
