嗜酸性肉芽肿性多血管炎并多发脑梗死一例
2020-07-30梁梅李凤琴曾志鹏李咏谢敏
梁梅 李凤琴 曾志鹏 李咏 谢敏
患者,男,52岁,因“反复咳嗽、咳痰、喘息3年,间断痰中带血半年,加重1个月”于2018年10月26日入住华中科技大学同济医学院附属同济医院呼吸与危重症医学科。患者于2015年8月无明显诱因出现咳嗽、喘息,于当地医院诊断为哮喘,给予对症治疗后症状缓解,出院后长期规律吸入布地奈德福莫特罗和噻托溴铵,并间断口服孟鲁司特钠、多索茶碱片控制病情,但上述症状仍反复发作,且发作频率增加,急性加重时外院多次查嗜酸性粒细胞(EOS)计数升高(家属代诉,未见报告)。近半年来,患者因急性加重于院外平均每个月需加服1~2个周期的甲泼尼龙片,期间患者间断出现痰中带血,半年来体重下降约5 kg。2018年5月患者因急性加重于当地医院诊治,血常规提示EOS计数0.89×109/L(0.05~0.50×109/L,括号内为正常参考值范围,以下相同),EOS 百分比11.64%( 0.50%~5.00%)。胸部CT检查提示慢性支气管炎、肺气肿并双肺少许感染。电子支气管镜检查提示:支气管化脓性炎症改变。当地医院给予糖皮质激素抗炎、抗感染、舒张支气管等治疗后症状好转出院。于2018年9月25日患者症状再次加重,喘息、气促明显,痰量增加,痰粘稠偏黄,痰中带鲜血,自服甲泼尼龙片、孟鲁司特钠片及吸入布地奈德福莫特罗、噻托溴铵等效果欠佳,于2018年10月19日出现发热,入住当地医院,测体温最高达39.3 ℃,不伴寒颤,入院后立即查血常规提示EOS计数3.32×109/L,EOS百分比35.71%。血气分析:PaO256.3 mmHg(80.0~100.0 mmHg),PaCO231.9 mmHg(35.0~45.0 mmHg)。痰涂片:抗酸染色(-),偶见革兰阳性菌,未见真菌孢子。痰培养:酵母样真菌生长。革兰阴性杆菌脂多糖104.6 pg/L,1-3-β-D葡聚糖正常。胸部CT检查见双肺弥漫性结节状、小斑片状密度增高影,沿支气管分布,提示双肺感染性病变(真菌?),见图1A。入院后给予头孢噻利、莫西沙星、伏立康唑、糖皮质激素治疗,于2018年10月21日出现呼吸困难加重,心率增快,血压下降,并出现一过性皮疹,入住呼吸重症监护室(RICU),给予无创呼吸机辅助通气,并给予糖皮质激素治疗后症状稍缓解,2018年10月23日复查血常规:EOS计数7.13×109/L,EOS百分比43.2%。 肾功能:尿素氮8.01 mmol/L(3.20~7.10 mmol/L),血肌酐187 μmol/L(53~106 μmol/L)。超敏C反应蛋白48.66 mg/L(<10 mg/L)。2018年10月25日复查胸部CT提示双肺结节、斑片及渗出影较2018年10月19日明显增多(图1B),改用美罗培南、利奈唑胺抗感染及丙种球蛋白治疗,2018年10月26日查降钙素原(PCT)正常,嗜肺军团菌、肺炎支原体、肺炎衣原体、腺病毒、呼吸道合胞病毒、甲型流感病毒、乙型流感病毒、副流感病毒、Q热立克次体IgM均阴性。患者于2018年10月26日清晨出现言语含混不清、书写障碍,当地医院立即完善头部CT检查,提示少许缺血灶。为求进一步诊治,于2018年10月26日下午转入华中科技大学同济医学院附属同济医院呼吸与危重症医学科。入院后体格检查:神志清楚,呼吸稍急促,说话含混不清,书写障碍,无明显鼻塞、流涕,双中下肺可闻及细湿啰音,未闻及哮鸣音,心律齐,各瓣膜听诊区未闻及明显病理性杂音,腹部体格检查未见异常,四肢肌力及肌张力基本正常。入院时血气分析:PaO266 mmHg,PaCO238.5 mmHg,动脉血氧饱和度(SaO2)94%(双腔鼻导管吸氧3 L/min时,不吸氧时正常参考值范围95%~98%)。血常规:EOS计数0.06×109/L,EOS百分比0.7%。氨基末端脑钠肽前体(NT-proBNP)1 249 pg/ml(<200 pg/ml),高敏心肌肌钙蛋白I 448.9 pg/ml(<35.0 pg/ml),D-二聚体20.09 μg/ml(<0.50 μg/ml),红细胞沉降率23 mm/h(<15 mm/h),超敏C反应蛋白22.6 mg/L,肝肾功能、电解质、尿常规及大便常规均正常。血总IgE 1 383.00 IU/ml,烟曲霉菌 0.27 KUA/L,抗中性粒细胞胞浆抗体(ANCA)核周型、ANCA胞浆型、抗蛋白酶3抗体、抗髓过氧化物酶、抗核抗体和抗核抗体谱均阴性,IgG稍偏高(16.4 g/L),IgM、IgA正常,补体C3、C4正常。血吸虫、肺吸虫、肝吸虫、囊虫、囊毛虫、裂头蚴、包虫均阴性。常规心电图检查提示:窦性心律,左心房负荷过重,不完全性右束支传导阻滞。心脏、腹部、肾脏超声检查结果均正常。骨髓细胞学检查示:骨髓增生活跃,EOS增多,其百分比为18.50% (1.21%~4.75%)。骨髓活检结果正常。白血病基因定性检测[43种融合基因筛查,采用实时聚合酶链反应(PCR)荧光探针法]均为阴性。头颅MRI检查示:双侧枕叶、右侧颞枕交界处、双侧额叶、右侧顶叶、右侧小脑多发点状、片状异常信号影,考虑急性/亚急性脑梗死,双侧额叶及左侧顶叶点状腔隙性梗塞灶;双侧上颌窦炎。头颅磁共振弥散加权成像(DWI)检查示:双侧额叶及枕叶、右侧顶叶、右侧颞枕叶交界处及右侧小脑半球急性/亚急性期脑梗死(图2)。四肢血管超声及头颈部CTA均未发现血栓。因患者病情重故未行支气管镜检查,未取肺组织活检。初步诊断:1.嗜酸性肉芽肿性多血管炎(EGPA,全身型,累及肺部、脑、鼻窦、肾脏、心脏、皮肤);Ⅰ型呼吸衰竭;肾功能不全;2.双肺感染。入院后继续给予丙种球蛋白10 g/d静脉滴注,总疗程5天,甲强龙(40 mg每日1次)静脉滴注抗炎,头孢哌酮钠舒巴坦钠(3 g每8 h 1次)、莫西沙星(0.4 g每日1次)、伏立康唑(0.2 g每12小时1次)静脉滴注抗感染治疗,治疗后患者说话逐渐清晰,写字逐渐整齐,咳嗽、咳痰、咯血明显好转。于2018年11月2日复查胸部CT提示:双肺病灶较2018年10月25日明显吸收(图1C),拟感染控制后,进一步给予免疫抑制剂治疗,但患者及家属强烈要求回当地医院继续诊治,于2019年11月9日办理出院。出院2个月后电话随访1次,患者家属诉患者于当地医院治疗后症状好转出院,但于当地医院住院期间未使用免疫抑制剂治疗。
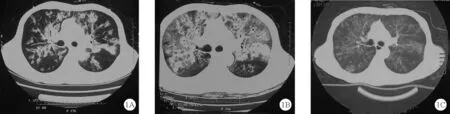
图1 患者胸部CT检查结果(A:2018年10月19日;B:2018年10月25日;C:2018年11月2日)

图2 患者2018年10月30日头颅DWI检查提示多发脑梗死(A:双侧额叶、右侧顶叶受累;B:颞叶受累)
讨 论
EGPA最早于1951年由Churg和Strauss发现并报道,故曾称为Churg-Strauss综合征或变应性肉芽肿性血管炎[1],是一种少见的系统性坏死性小血管炎,与其他的小血管病变不同的是,EGPA以严重的哮喘及血和组织中EOS浸润为特征。EGPA属于抗中性粒细胞胞浆抗体(ANCA)相关性系统性血管炎,虽然文献报道只有不到50%的EGPA患者ANCA检测阳性[2-3]。EGPA发病原因不明,目前认为遗传、环境因素均起重要作用,EOS浸润及ANCA诱导的血管内皮损伤为其主要发病机制。EGPA常为多器官受累,包括肺、心脏、神经系统、消化系统、肾脏、皮肤等,其组织和脏器损害的主要发病机制如下:(1)自身抗体介导损伤;(2)部分炎症介质导致的特异性及非特异性器官损害;(3)与抗磷脂抗体有关的高凝状态及血栓形成[4]。
目前,EGPA的诊断仍采用1990年美国风湿病学会的标准[5]:(1)哮喘样症状(或喘息发作);(2)外周血EOS百分比≥10%或绝对计数≥1.5×109/L;(3)单发或多发性单神经或多神经病变;(4)游走性或一过性肺浸润;(5)鼻窦病变;(6)病理检查提示血管炎伴血管外EOS浸润。凡具备上述4项及4项以上,排除其他血管炎和肉芽肿性疾病即可诊断EGPA。该诊断标准的灵敏度为85.0%,特异度达99.7%。EGPA最早且最容易侵犯呼吸道和肺脏,绝大多数患者以喘息样发作为首发症状,极易误诊为难治性哮喘。该患者有哮喘样症状和咯血,胸部CT检查提示肺部浸润,头颅MRI检查提示有鼻窦病变和中枢神经系统受累,外周血EOS百分比>10%,且不排除皮肤受损(出现一过性皮疹)、肾脏受损(出现血肌酐、血尿素氮升高)、心肌受损(高敏心肌肌钙蛋白I 异常升高)可能。按照上述标准,该患者符合EGPA诊断,且使用糖皮质激素和丙种球蛋白等综合治疗后患者所有症状均逐渐好转。
约70% EGPA患者出现神经系统受累,主要表现为周围神经病变,可有多发性单神经炎或对称性感觉运动神经末梢病变等,较少累及中枢神经系统[6]。中枢神经系统受累主要有以下4种不同表现形式[7]:(1)缺血性病变;(2)颅内出血或蛛网膜下腔出血;(3)脑神经麻痹;(4)视力丧失。周佳鑫等[8]的研究结果显示,在73例EGPA患者中,中枢神经系统受累比例为11%,其中4例脑梗死或脑缺血,2例脑出血,1例蛛网膜下腔出血,1例颈髓受累,其中中枢神经系统受累患者的脑梗死或脑缺血影像学主要表现为多发、小缺血或梗死灶,分布部位多样,而本例患者头颅MRI检查提示大脑、小脑多发急性/亚急性脑梗死,与上述表现相符合。上述研究中中枢神经受累的比例差异较大,考虑与样本量少、选取患者存在偏倚有关。EGPA合并脑出血的患者与合并脑梗死的患者在临床表现上稍有不同,相对而言,脑梗死患者年龄偏大,心脏更易受累,与之相反,脑出血患者更易发生周围神经炎和肾脏损害,ANCA阳性率更高,EOS计数更高[7]。该患者ANCA阴性,暂未发现周围神经病变,故较符合上述规律,具体病因和发病机制需要进一步探讨。
EGPA需要与特发性高嗜酸性粒细胞综合征(IHES)相鉴别,二者有许多相似之处,包括均为系统性疾病,均有组织器官EOS浸润和外周血EOS计数升高,但IHES缺乏哮喘样症状和中小血管炎并发症,且骨髓中EOS计数占有核细胞计数的百分比为20.0%以上,较EGPA比例更高,终末脏器组织学检查有EOS浸润或有EOS脱颗粒[9]。本例患者骨髓EOS百分比为18.5%,未达到20.0%,且相关基因检测为阴性,故不考虑IHES。
EGPA的预后取决于能否在疾病早期及时诊断和治疗。早期诊断和治疗可改善患者预后,提高其生存时间和生活质量。据统计,EGPA的5年生存率为68%~100%,10年生存率约为79.4%[10],而心脏严重受累和中枢神经系统受累是EGPA患者死亡的主要原因之一[5]。本例患者多系统受累,需要积极治疗,否则预后欠佳。但因患者拒绝继续住院治疗,故后期失访。
