食品改良剂对丁香鱼干品质特性的影响
2020-07-28顾赛麒王苏宁鲍嵘斌胡彬超杨晓霞张继磊陈景滢林招永丁玉庭柯志刚
顾赛麒,王苏宁,鲍嵘斌,胡彬超,杨晓霞,张继磊,陈景滢,林招永,丁玉庭,柯志刚,*
(1.宁海县浙工大科学技术研究院,浙江 宁海 315601; 2.浙江工业大学 海洋学院,浙江 杭州 310014; 3.国家远洋水产品加工技术研发分中心(杭州),浙江 杭州 310014; 4.瑞安市华盛水产有限公司,浙江 瑞安 325200; 5.玉环市东海鱼仓现代渔业有限公司,浙江 玉环 317602)
丁香鱼是尚未长出骨骼的鳀鱼(Engraulisjaponicus)幼鱼的别称,又称离水烂、烂船丁、抽条等,是一种广泛分布于西太平洋和西印度洋的亚热带鱼种[1],其捕捞后一般直接经煮制、干燥加工成丁香鱼干(又称“海蜒”),深受国内以及东亚、东南亚地区消费者的喜爱,是我国出口创汇的重要水产加工制品之一。
丁香鱼干中含氮类物质含量丰富,若环境温度控制不当,极易引发脂肪氧化、色泽褐变、微生物增殖等问题[2]。因此,其一般采用冷链方式进行流通,但冷链物流存在设备造价贵、能耗高等弊端。如果采用适当的食品改良剂(如抑菌剂、抗氧化剂、涂膜剂等)对其进行处理,可有效延缓丁香鱼干常温条件下品质劣化的速率,使其满足常温贮运的要求,将大幅节约成本、提高经济效益。
近年来,茶多酚(tea polyphenols,TP)、抗坏血酸棕榈酸酯(ascorbyl palmitate,AP)、单月桂酸甘油酯-大豆分离蛋白复合物(glycerol monolaurate-soy protein isolate,GML-SPI)等食品改良剂在水产品加工领域的应用已越来越广泛。TP含多酚羟基结构,较易被氧化成醌类并在此过程中提供质子,具有较强的抗氧化性和一定的抗菌活性[3]。有研究者发现,TP可有效抑制腌干水产品贮藏过程中过氧化值的升高,同时延长其货架期[4]。AP是一种亲脂性的酯类,具有较高的稳定性和抗氧化性[5],据报道其可以提高水产品油脂的稳定性,延缓其脂质氧化速率[6]。GML-SPI具有阻氧、阻水和阻光等特性[7],兼具可食、可降解等优点,被报道可以显著改善虾皮的贮藏品质[8]。目前,尚未发现食品改良剂在丁香鱼干品质改良方面的相关报道。
本研究采用不同食品改良剂(TP、AP、GML-SPI)对丁香鱼干进行处理,研究处理后鱼干样品在常温贮藏过程中各项指标(水分、菌落总数、挥发性盐基氮、脂肪氧化、色泽、肌纤维结构、挥发性风味物质、感官评分)变化规律,确定最优的食品改良剂种类,旨在为丁香鱼干加工企业改进生产工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜丁香鱼干:体长(3.9±0.8)cm,体质量(0.3±0.1)g,产自浙江东海海域,于2018年4月下旬分三批次从温州市瑞安华盛水产公司采购,每批1 000 g,总计3 000 g。
石油醚、三氯甲烷、硫代硫酸钠、碘化钾(均为化学纯),国药集团化学试剂有限公司;茶多酚(≥99%,食品级),上海仟爵生物技术有限公司;抗坏血酸棕榈酸酯(≥99%,食品级),北京鼎国昌盛生物技术有限公司;大豆分离蛋白、甘油、单月桂酸(≥99%,均为食品级),河南千志商贸有限公司。
1.2 仪器与设备
UV762紫外可见分光光度计,上海仪电分析仪器有限公司;UltraScan色差仪,美国Hunter Lab公司;S4700场发射扫描电子显微镜,日本Hitachi公司;RCC18固相萃取整体捕集剂,日本GL Sciences公司;7890A-5975C气相色谱-质谱联用仪,美国Aglient公司;N310全自动凯氏定氮仪,广州格丹纳仪器有限公司;HYGRO Lab四通道水分活度仪,瑞士罗卓尼克。
1.3 方法
1.3.1 样品前处理
茶多酚(TP)、抗坏血酸棕榈酸酯(AP)溶液制备:分别称取0.03 g茶多酚和0.02 g抗坏血酸棕榈酸酯,各自溶于100 mL去离子水和100 mL 75%乙醇中,制备得到TP和AP溶液。单月桂酸甘油酯-大豆分离蛋白(GML-SPI)溶液制备:参照顾赛麒等[7]的方法。
品质改良工艺:称取200 g丁香鱼干,分别以100 g去离子水(CK)、TP、AP和GML-SPI溶液喷涂均匀,25 ℃下风干至原重,真空包装后于25 ℃下贮藏6 d,每隔2 d取样检测。
1.3.2 指标测定
水分含量按照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》的方法进行测定。水分活度按照GB 5009.238—2016《食品安全国家标准 食品水分活度的测定》的方法进行测定。菌落总数按照GB 4789.2—2016《食品微生物学检验 菌落总数测定》的方法进行测定。挥发性盐基氮(TVB-N)按照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》的方法进行测定。过氧化值(POV)按照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》的方法进行测定。硫代巴比妥酸值(TBARS)按照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》的方法进行测定。
1.3.3 色差的测定
取10 g丁香鱼干打碎,随机选择5个点以上,采用色差仪直接测定样品的L*、a*和b*值,并同时计算其与对照样品(贮藏0 d)的总色差值ΔE*=[(ΔL*)2+(Δa*)2+(Δb*)2]1/2。
1.3.4 表面结构的扫描电镜
参照蔡路昀等[9]方法测定丁香鱼干表面结构。
1.3.5 吸附萃取-气相-质谱联用(MMSE-GC-MS)
参照顾赛麒等[10]的方法并稍作修改。准确称取3.0 g丁香鱼干,将其加入15 mL棕色顶空瓶中。选取4个RCC18吸附子(空心圆柱体),以固定装置串联后置于顶空瓶内样品正上方。将顶空瓶置于恒温水浴锅中,60 ℃下萃取1 h。待萃取完毕后,进行热解析进样。
热脱附(TDU)条件:不分流模式,初始温度40 ℃,以180 ℃·min-1升至240 ℃,保留6 min。冷进样系统(CIS)条件:液氮制冷,起始温度-40 ℃,平衡30 s,以12 ℃·s-1升至270 ℃,保留10 min。
气相(GC)条件:DB-5 MS毛细管柱(60 m×0.32 mm,1 μm),汽化室温度240 ℃。柱温起始40 ℃,以4 ℃·min-1升至100 ℃,再以2 ℃·min-1升至150 ℃,最后以8 ℃·min-1升至240 ℃,保留5 min。载气为99.999%高纯氦气,载气流量1.0 mL·min-1。
质谱(MS)条件:EI能量源;电子能量70 ev,质量扫描范围35~450 m·z-1,离子源温度220 ℃,传输线温度250 ℃。
将10 μL浓度为10-5g·mL-1的内标物2,4,6-三甲基吡啶(TMP)加入到3 g丁香鱼干样品中,通过下式计算各挥发物的浓度(绝对校正因子设定为1):
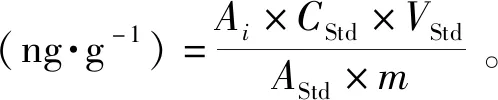
(1)
式中:Ai、AStd分别表示挥发物与内标物的峰面积;CStd和VStd为加入内标物的浓度和体积;m为加入丁香鱼干样品质量。
1.3.6 气味活性值分析
气味活性值(odor activity value,OAV)用于表征某一挥发物的气味活性强弱,计算公式如下:
OAVi=Ci/OTi。
(2)
式中:Ci为挥发物i在样品中的浓度(ng·g-1);OTi为挥发物i一定温度下在某种基质中的阈值(ng·g-1)。
1.3.7 感官评定
评定小组由15位有感官评定经验的人员组成(7男8女,平均年龄23岁),对丁香鱼干的色泽、气味、滋味和组织形态进行综合评分,感官评分标准见表1。
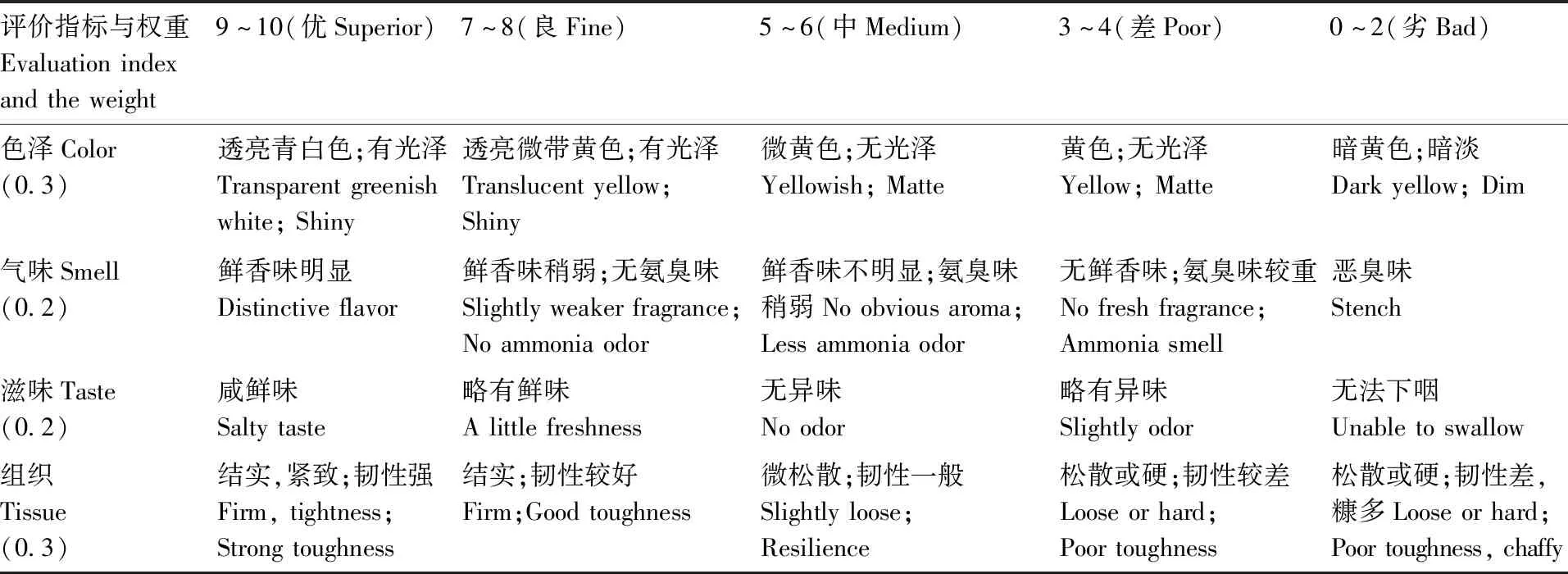
表1 感官评分标准
1.3.8 数据分析
运用SPSS 17.0软件和Origin 8.0软件进行数据处理和作图,采用多重比较法中的最小显著差法(least significant difference,LSD)对所得数据进行差异显著性分析。
2 结果与分析
2.1 食品改良剂处理对丁香鱼干水分含量与水分活度的影响
水分含量指食品中水分所占的比重,而水分活度反映水分与食品组分的结合状态。较低的水分含量和水分活度均有利于维持食品性状稳定,抑制微生物生长,延长货架期[11]。值得注意的是,过低的水分含量和水分活度均会造成水产干制品表面硬化、口感变差等问题。
由表2可知,刚处理完毕(即贮藏0 d)的4组样品,无论其水分含量还是水分活度数值均无显著性差异(P>0.05),表明样品前处理方式对4组样品中的水分均无影响。此外,随着贮藏时间的延长,4组丁香鱼干的水分含量和水分活度也均没有显著性差异(P>0.05),表明水分不是引起丁香鱼干常温贮藏过程中品质变化的主要因素。
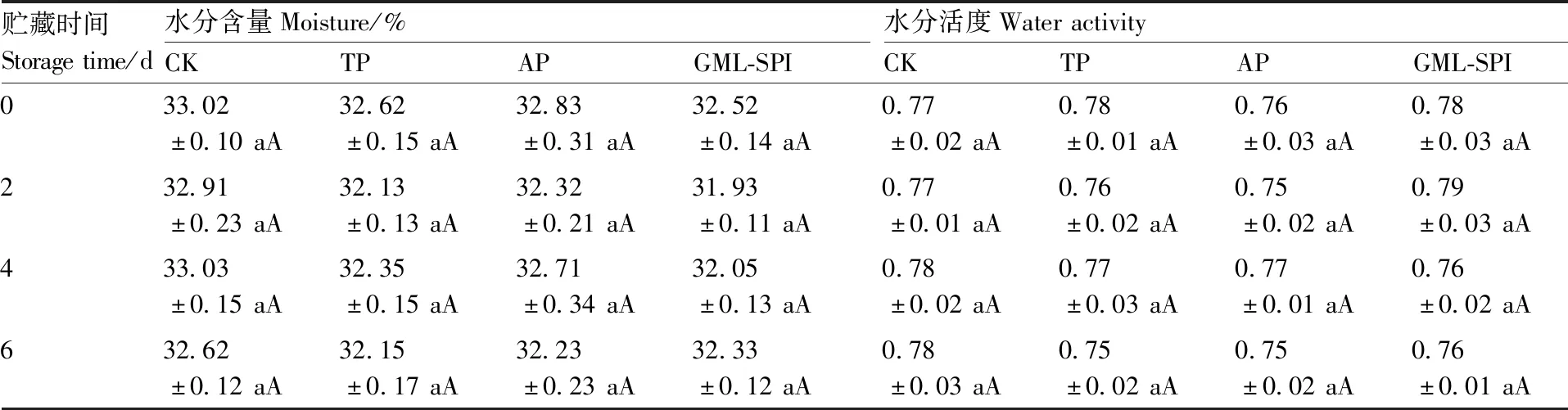
表2 不同改良剂处理丁香鱼干常温贮藏过程中水分含量和水分活度的变化
2.2 食品改良剂处理对丁香鱼干菌落总数的影响
图1显示,CK、TP、AP、GML-SPI四组样品的初始菌落总数分别为3.31、3.23、3.12和3.25 lg(CFU·g-1),远低于GB 2733—2015中规定的6 lg (CFU·g-1)的上限,表明丁香鱼干样品的初始安全性较好。随着贮藏时间的延长,各组样品的菌落总数均不同程度上升。贮藏6 d时,各组样品中菌落总数均超过了6 lg (CFU·g-1),表明此时丁香鱼干样品已开始腐败变质。
进一步观察图1发现,在整个贮藏期内,三种改良剂处理的丁香鱼干菌落总数与对照组相比也有明显差异。TP组菌落总数略低于CK组,推测主要与茶多酚具有一定的抑菌作用有关[3]。然而,本研究中使用的TP浓度(0.03%)远远低于其有效抑菌浓度(0.75%)[12],因而其抑菌效果尚不突出。与TP组类似,AP组菌落总数同样略低于CK组,这可能与AP自身的抗氧化作用有关。AP作为氧的驱散剂,丁香鱼干表面的氧气,在起到抗氧化作用的同时,有效抑制了丁香鱼干中好氧微生物的生长[13]。与TP和AP组不同,GML-SPI组的菌落总数高于CK组,推测原因可能是GML-SPI中含有4%的大豆蛋白,其可作为微生物生长的良好氮源而促进其生长。

各数据间没有相同小写字母表示差异显著(P<0.05)。下同。The values without the same lowercase letters showed significant difference(P<0.05).The same as below.图1 不同改良剂处理丁香鱼干常温贮藏过程中菌落总数的变化Fig.1 Changes of total bacterial count of dried Engraulis japonicas during normal temperature storage with different food improvers
2.3 食品改良剂处理对丁香鱼干TVB-N含量的影响
TVB-N是指动物性蛋白质在细菌和酶的作用下分解产生氨以及胺类等碱性含氮物质,是一种常用的水产品新鲜度指标[14]。由图2可知,在整个贮藏期内,TP和AP均可有效抑制鱼干中TVB-N的生成,相反GML-SPI则可促进其生成。图2结果与图1中菌落总数的变化趋势基本一致,两者可以起到相互印证的作用。进一步观察图2发现,贮藏0 d时,4组样品的TVB-N含量基本一致。随着贮藏时间的延长,各组样品的TVB-N含量均显著增加(P<0.05)。在整个贮藏期中,TP组和AP组TVB-N含量均低于CK组,且与AP组相比,TP组抑制丁香鱼干TVB-N升高的效果更为显著。原因可能是TP组和AP组均能抑制微生物的生长,且TP组比AP组抑菌效果更好(图1),降低了丁香鱼干中蛋白质的分解,从而减少了TVB-N的产生。在整个贮藏期内,GML-SPI组其TVB-N含量始终高于其余三组样品,在贮藏6 d时已达到32.91 mg·100g-1,该数值已经超过30 mg·100g-1的接受上限[15],推测原因可能是GML-SPI中含有的大豆分离蛋白分解所致。相比而言,贮藏6 d时TP组和AP组样品TVB-N含量分别为25.23 mg·100g-1和26.65 mg·100g-1,显著低于CK组的28.7 mg·100g-1,且保持在30 mg·100g-1的限值范围以内。
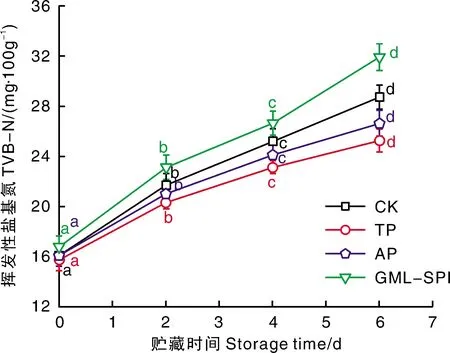
图2 不同改良剂处理丁香鱼干常温贮藏过程中挥发性盐基氮含量的变化Fig.2 Changes of TVB-N content of dried Engraulis japonicas during normal temperature storage with different food improvers
2.4 食品改良剂处理对丁香鱼干POV值的影响
POV可反映脂类初级氧化产物,常用于指示鱼体脂肪氧化程度,其值越大表示鱼体脂肪氧化越严重,鱼体品质越差[16]。由图3可知,整个贮藏期内,对照组和3种改良剂处理下,丁香鱼干的POV值均随贮藏时间的延长而显著增加(P<0.05)。贮藏0 d时,各组样品POV值均无显著差异;贮藏2 d开始,三种改良剂组POV值始终低于CK组。具体而言:GML-SPI组POV值上升速率较CK组缓慢,可能原因是GML-SPI在丁香鱼干表面形成保护膜,能够有效包裹丁香鱼干,减慢了氧气从周围环境通过表面向鱼干的扩散速率,延缓了脂质氧化反应速率;三种改良剂中,TP组和AP组的效果优于GML-SPI组,推测与两者良好的抗氧化特性有关;TP组与AP组比较,TP组POV值上升速率更小,这可能与其兼具的抗菌特性有关,某种程度上减少了微生物来源的脂肪氧合酶的生成。贮藏6 d时,GML-SPI、AP和TP组的POV值分别为5.74、4.69和4.45 mg·100g-1,均远远低于GB10136—2015《食品安全国家标准 动物性水产制品》中规定的0.6 g·100g-1限量标准,表明经3种食品改良剂处理后的丁香鱼干产品质量安全可靠。
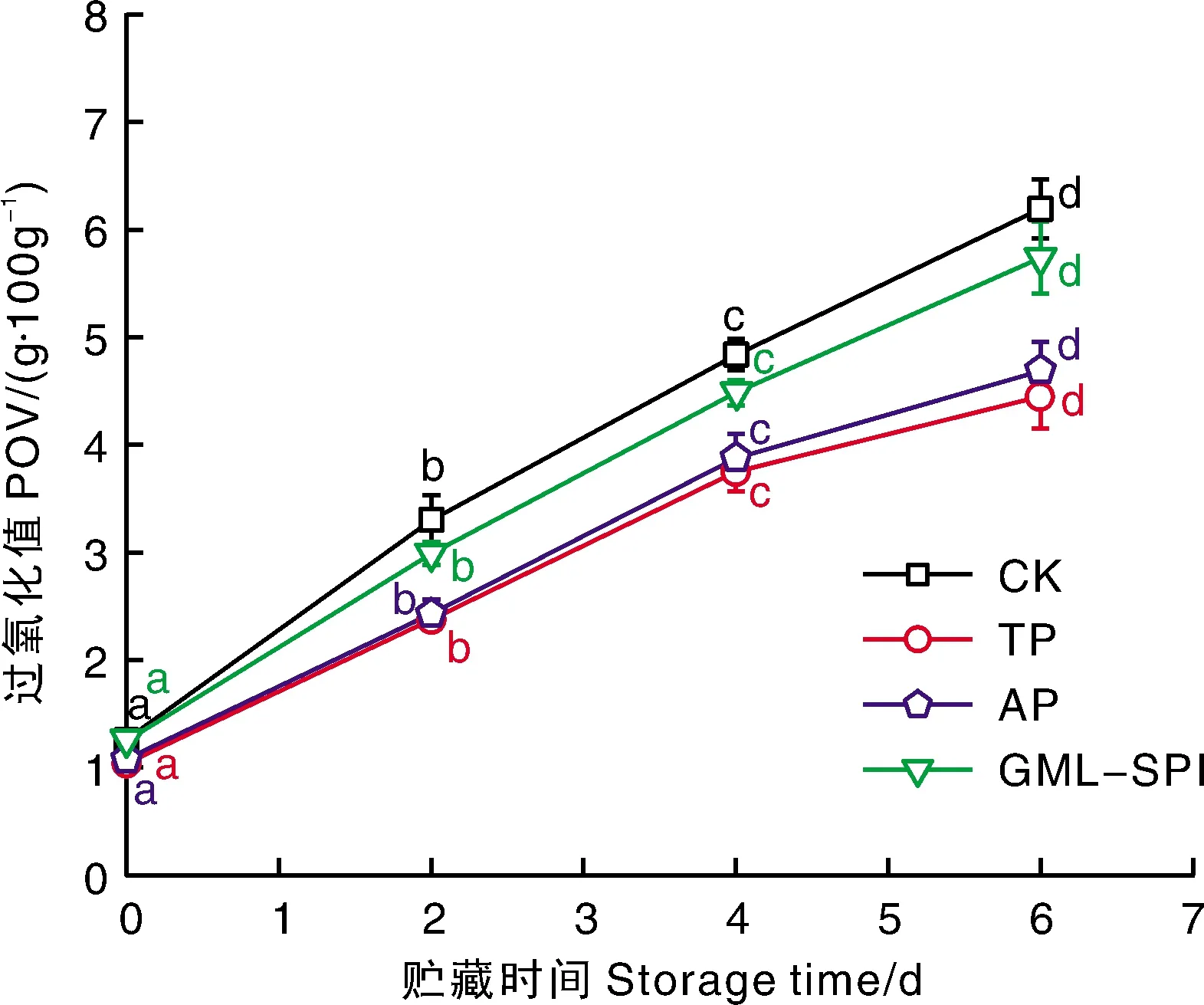
图3 不同改良剂处理丁香鱼干常温贮藏过程中POV值的变化Fig.3 Changes of POV value of dried Engraulis japonicas during normal temperature storage with different food improvers
2.5 食品改良剂处理对丁香鱼干TBARS的影响
丙二醛作为一种常见且稳定的脂类二级氧化产物,其含量常被用于判定脂肪氧化程度。Ibrahim-Sallam[17]指出,高品质的冻鱼或冰鲜鱼其TBARS值应小于5 mg·kg-1,而满足食用条件的TBARS最高限值为8 mg·kg-1。贮藏0 d时,4组样品的TBARS值无显著性差异。随着贮藏时间的延长,各组TBARS值不断升高,表明丁香鱼干脂类二级氧化产物含量逐渐增加。贮藏4 d开始,对照组与3种改良剂处理组样品TBARS值产生了较明显差异,且存在CK>GML-SPI>AP>TP的趋势,表明3种改良剂均可有效抑制丁香鱼干的脂质氧化,其中以茶多酚(TP)的抑制效果最强,这可能与其含有多酚羟基结构有关。贮藏6 d时,4组样品的TBARS值均升至极值,其中CK组TBARS值最大(为2.79 mg·kg-1),但仍远低于8 mg·kg-1的限量标准。雷丽萍等[18]采用0.2%的TP浸泡大黄鱼,发现TP可显著抑制大黄鱼在冰藏过程中TBARS的生成,与本研究的结果相符。
2.6 食品改良剂处理对丁香鱼干色泽的影响
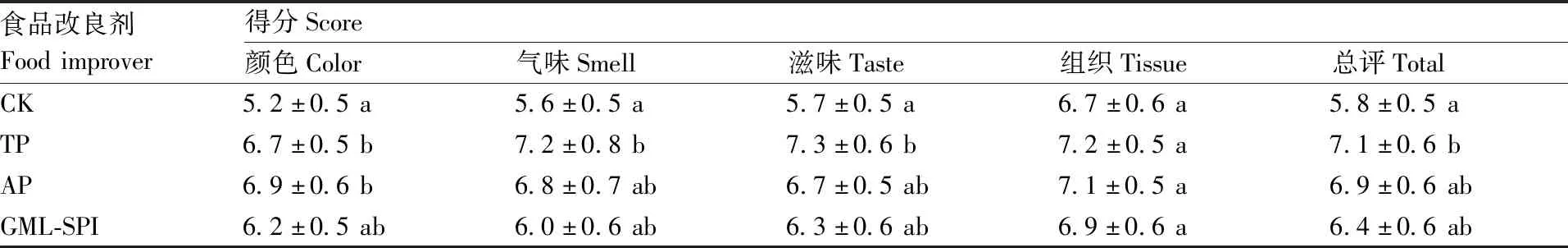
色泽是评估水产品质量的重要参数之一,是影响消费者对水产品的接受程度的重要因素[15]。由表3可知,随着贮藏时间的增加,对照组与3种改良剂处理组样品的L*值基本呈逐渐下降趋势,但降幅不显著,这可能与贮藏过程中鱼干中水分少量散失有关,表1中水分含量变化趋势也印证了此结果。4组样品的a*值随贮藏时间增加呈不断升高趋势,分析可能与丁香鱼干中肌红蛋白氧化程度不断加深有关。值得注意的是,初始0 d时四组样品的a*值均为负数,推测可能是鱼体中肌红蛋白所含的血红素结构在高温加工(预煮和风干)过程中部分开环产生了胆绿素[19],这也解释了优质丁香鱼干呈透亮青白色的原因。贮藏0 d时,TP组样品b*最高,可能与茶多酚自身带微黄色有关,但随着贮藏时间的增加,茶多酚其抗氧化效果逐渐显现,因而TP组的b*上升速率最为缓慢。贮藏6 d后,3种改良剂处理组样品b*值均显著低于对照组,且存在TP 图4 不同改良剂处理丁香鱼干常温贮藏过程中TBARS值的变化Fig.4 Changes of TBARS value of dried Engraulis japonicas during normal temperature storage with different food improvers 表3 不同食品改良剂处理丁香鱼干常温贮藏过程中色泽的变化 由图5-a可以看出,新鲜丁香鱼干样品纹理清晰,肌纤维排列整齐,没有明显破坏裂隙,整体结构完整。图5-b显示,常温贮藏6 d后丁香鱼干肌纤维结构开始发生改变,表面出现褶皱,肌纤维干瘪、粗糙,纹理变得不清晰,破坏程度加大,这可能是由于肌纤维氧化、微生物分解造成的。观察图5-c-e发现,经三种改良剂处理并常温贮藏6 d的丁香鱼干,其肌肉纤维纹理略优于图5-b中的对照组,肌纤维饱满、表面较光滑,裂隙较小,表明添加食品改良剂对丁香鱼干肌肉纤维具有一定的保护作用,且经对比发现,TP组和AP组的效果较好,推测其可能通过减缓鱼体肌纤维的氧化,同时抑制微生物的快速生长来降低其破坏分解作用,从而实现对丁香鱼干肌纤维的保护作用。 由表4可见,本研究共检测出五大类25种挥发性风味成分,计算各挥发物气味活性值(OAV)后,可从中筛选出5种气味活性物质(OAV>1),具体为:3-甲基丁醛、辛醛、癸醛、1-辛烯-3-醇和2-乙基呋喃。与对照组相比,经3种改良剂处理后丁香鱼干挥发物总浓度和气味活性值总和均有大幅下降,按其降幅进行排序:TP>AP>GML-SPI,表明3种改良剂均能有效改善丁香鱼干挥发性气味,其中TP组效果最佳,AP组效果次之,GML-SPI组效果最差。推测原因如下:常温贮藏过程中,丁香鱼干样品中不良风味物的形成主要与微生物增殖(产生次生代谢产物)以及脂质氧化(产生醛、酮、醇等小分子氧化产物)有关。TP兼具抗菌和抗氧化作用,因此效果最好;AP主要以抗氧化作用为主,故其效果次之;GML-SPI主要以阻气、阻水等阻隔作用为主,由于其配方中含有4%大豆分离蛋白,在常温贮藏过程中可能引起蛋白质氧化、微生物增殖等问题,造成异味物质增加。 醛类物质的阈值较低,主要来源于不饱和脂肪酸的氧化分解[20],对丁香鱼干整体气味贡献较大。由表4可知,本研究中共有3种醛类具有气味活性(包括2种直链醛和1种支链醛),其中辛醛和癸醛气味特征多为青草味、水果香和油脂香,3-甲基丁醛具有果香味。与对照组相比,经3种食品改良剂(TP、AP和GML-SPI)处理后,丁香鱼干样品醛类OAV值总和分别下降了6.03、5.06和3.42,气味改良效果显著。 a,新鲜丁香鱼干样品;b,新鲜丁香鱼干贮藏6 d的样品;c,TP处理后贮藏6 d的样品;d,AP处理后贮藏6 d的样品;e,GML-SPI处理后贮藏6 d的样品。a,Fresh dried Engraulis japonicas sample; b,Fresh dried Engraulis japonicas sample stored for 6 d; c,Sample stored for 6 d after treatment by TP; d,Sample stored for 6 d after treatment by AP; e,Sample stored for 6 d after treatment by GML-SPI.图5 不同改良剂处理丁香鱼干常温贮藏不同天数肌纤维扫描电镜照片Fig.5 Scanning electron microscopic images of dried Engraulis japonicas during different normal temperature storage days with different food improvers 醇类主要由脂肪酸氢过氧化物降解产生,或者来自醛酮类羰基化合物的还原作用[21]。饱和醇类化合物的阈值较高,而不饱和醇类化合物具有较低阈值,对鱼类制品风味贡献程度显著。本研究检出唯一的具有气味活性的醇类——1-辛烯-3-醇,呈蘑菇味和青草味,是典型的水产腥味物质,在不同改良剂处理的丁香鱼干样品中均未被检出。 酮类主要由多不饱和脂肪酸的降解、醇类的氧化以及氨基酸的降解生成[21],通常阈值较高,对样品整体风味贡献不大,有学者指出酮类对样品整体风味具有一定的修饰作用[22]。本研究共检出4种酮类,其OAV值均小于1,不具有气味活性。 芳香类化合物主要来自于含苯环氨基酸的氧化降解或者由外部环境中导入[23]。苯、甲苯等芳香类物质具有刺激性气味,它们可能是来自煮制时鱼体内苯丙氨酸和酪氨酸等的降解,本研究中检出的三种芳香类物质均无气味活性。烃类一般阈值较高,对整体气味贡献不显著。Watanabe等[24]认为,饱和烷烃类化合物主要来自于长链脂肪酸的键的裂解及其脱羧基作用产生,Selke等[25]认为它们是由氢过氧化物降解产生的烷基自由基生成的。 三甲胺一般来源于氧化三甲胺的还原反应,或源自含胆碱基团的卵磷脂的氧化分解[26],被认为是水产品中典型的具有腥臭味的挥发物。2-乙基呋喃属含氧杂环类化合物,具有类似可可豆的焦香气味,由硫胺素热降解产生,被报道是腌干水产品的挥发性风味物之一[19],表4显示经3种改良剂处理后丁香鱼干中的2-乙基呋喃其OAV值明显下降。 表4 MMSE-GC-MS法鉴别不同改良剂处理丁香鱼干常温贮藏过程中的挥发性风味物质 表5显示,无论是单项评分还是总评分,均是对照组最低,经三种改良剂处理后,丁香鱼干的颜色、气味、滋味、组织状态以及总评分均有了一定程度的提高。上述改良剂中,GML-SPI处理组总评分最低,这可能与GML-SPI中含有4%的大豆分离蛋白有关(其具有一定的豆腥味,并且可以作为氮源促进微生物生长)。TP组和AP组的总评分较为接近,其中TP组稍优于AP组。经对比单项得分发现,TP组在色泽得分上稍逊于AP组,这可能与茶多酚自身颜色有关,喷涂后可能造成产品略微发黄;然而,TP组在气味、滋味、组织状态等其他单项得分上均优于AP组,表明茶多酚作为一种兼具抗氧化性和抗菌性的食品改良剂,对丁香鱼干的品质改良效果较好。 表5 不同改良剂处理丁香鱼干常温贮藏过程中感官评分的变化 综合比较了三种食品改良剂对丁香鱼干品质改良的效果。结果表明,与对照组相比,三种食品改良剂均有一定的品质改良效果,其中茶多酚(TP)和抗坏血酸棕榈酸酯(AP)可有效延缓丁香鱼干在常温贮藏过程中的品质劣化速率,而单月桂酸甘油酯-大豆分离蛋白(GML-SPI)因含有4%的大豆分离蛋白,反而会促进微生物生长,影响产品食用安全性。三种食品改良剂中,0.03% TP溶液兼具抗菌性和抗氧化活性,对丁香鱼干品质改良效果最优,能够显著地抑制常温贮藏过程中丁香鱼干微生物增殖速率、减少挥发性盐基氮生成量、减缓脂质氧化反应速率、控制色泽变化程度、保持肌纤维结构完整性、降低异味物质生成量、提高产品感官得分。今后,可尝试将本研究成果在水产品干制加工生产线中进行推广应用。

2.7 食品改良剂处理对丁香鱼干肌纤维结构的影响
2.8 食品改良剂处理对丁香鱼干挥发性风味的影响


2.9 食品改良剂处理对丁香鱼干感官评分的影响
3 结论
