红螯螯虾累代繁养群体的遗传多样性分析
2020-07-28黄鸿兵严维辉许志强
彭 刚,徐 宇,张 燕,王 静,黄鸿兵,严维辉,许志强
( 江苏省淡水水产研究所,江苏 南京 210017 )
红螯螯虾(Cheraxquadricarinatus),属节肢动物门,甲壳纲,十足目,拟螯虾科,光壳虾属[1],体色为褐绿色或绿色,雄性成虾第一步足大螯的外侧顶端有一鲜红、柔软的膜质带[2],红螯螯虾原产澳大利亚北部,个体大,食性杂,耐低氧,养殖当年即可上市,我国于1992年由湖北水产研究所引进该品种进行小规模试养。随着人们对其基础生物学特性不断研究,养殖技术不断完善,红螯螯虾在国内养殖范围逐步扩大,在海南、广东、浙江、江苏、湖北等地均有养殖成功的案例[3-4],红螯螯虾国内引进近30年,许多地区已建立了自己的繁育基地,实现了保种越冬、自繁自养。
线粒体细胞色素氧化酶亚基Ⅰ(COⅠ)基因位于线粒体DNA中,是线粒体基因组13种氨基酸编码序列之一,中度保守,进化速率适中,既能保证足够的变异又易于扩增,且很少存在插入与缺失,适合种群水平差异的检测[5-6]。近十年来,COⅠ基因被广泛应用于物种分类及种内种间遗传分化研究[7-11]。目前国内大部分红螯螯虾的繁养基地主要依赖于自有群体的养殖繁殖,经过多代的自繁自育后其遗传多样性如何,国内较少见文献报道,仅谢雁南[12]对3个地区的红螯螯虾开展了群体遗传学分析。为有效评估国内不同地区繁养基地红螯螯虾种质资源状况,分析遗传多样性及遗传分化水平,项目组采集了6个主要繁养区域的红螯螯虾,基于线粒体DNA COⅠ基因序列对不同群体的遗传多样性进行初步评估,为后续开展红螯螯虾的培育以及选育工作积累数据资料。
1 材料与方法
1.1 试验材料
试验所用红螯螯虾于2018年10—12月采自国内6个红螯螯虾繁养区,分别为安徽阜阳、浙江湖州、广东珠海、江苏镇江、海南澄迈、江苏苏州,样本采集量均为100尾以上,每个群体随机取30尾用于后续的群体遗传学分析。
1.2 方法
1.2.1 DNA模板制备
取红螯螯虾尾部肌肉组织,常规酚—氯仿法提取基因组DNA,1%琼脂糖凝胶电泳检测基因组DNA的完整性,紫外分光光度法检测样品DNA含量及纯度。
1.2.2 PCR扩增及序列测定
参照红螯螯虾COⅠ基因序列(GenBank:HG942364.1)设计引物用于线粒体COⅠ基因扩增和序列测定。引物由生工生物工程(上海)股份有限公司合成,COⅠ-F: 5′-TTGTGTTCGGAGCCTGAT-3′; COⅠ-R: 5′-AGAAGGTCTTCCTGGTAGG-3′。对每个样本的线粒体 COⅠ基因序列进行扩增,PCR反应体系为25 μL:模板DNA 25 ng,2×PCR Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O补足体积。反应程序为:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,经30个循环再72 ℃延伸5 min。扩增产物用1%的琼脂糖凝胶电泳检测,以标准DL2000 Ladder(TAKARA)估算产物大小。PCR扩增产物直接送生工生物工程(上海)股份有限公司测序获取序列信息。
1.2.3 数据统计与分析
通过双向测序获得红螯螯虾线粒体COⅠ序列,经SeqManⅡ(DNASTAR Inc)软件拼接并进行人工核查和校正,所获序列用Clustal X软件进行比对,用Mega 6.0软件中的Kimura双参数法计算遗传距离。用Modeltest 3.16计算位点间碱基替代率的Gamma分布参数,并以邻接法构建分子系统树。通过单倍型多样性和核苷酸多样性分析当前不同繁养区红螯螯虾群体的遗传多样性。
2 结果与分析
2.1 序列变异特征分析
共获取了6个红螯螯虾群体共180个样品的线粒体COⅠ基因序列,对其进行对比分析,比对长度为831 bp,其中变异位点为56个,变异比率为6.7%,简约信息位点16个,单核苷酸多态性位点76个。平均A、T、G、C碱基含量分别为27.840%、32.395%、14.848%、24.917%。红螯螯虾线粒体COⅠ基因G+C(%)含量较低39.765%,表现出较为明显的碱基组成偏倚性。
在6个群体180个样本中共检测出 10 种单倍型(表1)。安徽阜阳群体与江苏苏州群体、海南澄迈3个群体间有2个共享单倍型 (H1/H3)。单倍型H1出现次数最多,为浙江湖州以外的5个群体的共享单倍型,单倍型 H2、H5、H7以及H10分别为安徽阜阳、海南澄迈、浙江湖州以及江苏苏州群体所特有的单倍型。

表1 红螯螯虾6个群体COⅠ基因单倍型(H1~H10)的分布
遗传多样性结果表明,本试验中所涉及的红螯螯虾群体均具有较高的遗传多样性(表 2),其总体单倍型多样性指数为0.693,核苷酸多样性指数为0.00652。其中,江苏苏州群体的单倍型多样性指数最高(0.964),海南澄迈群体最低(0.618),核苷酸多样性指数以浙江湖州群体最高(0.01587),海南澄迈群体最低(0.01219)。
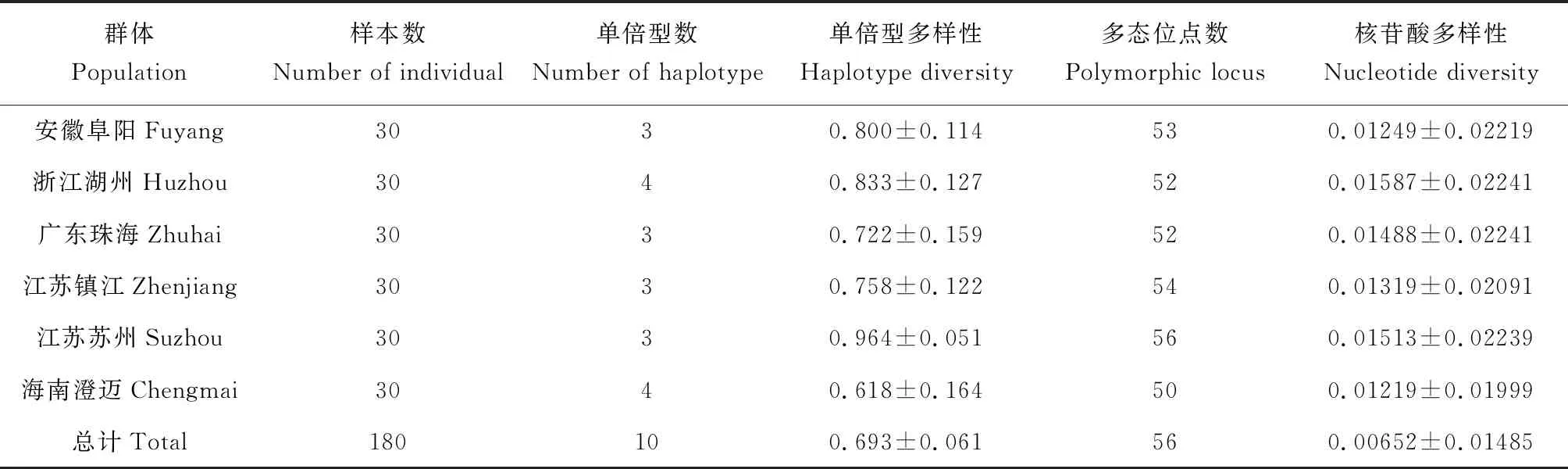
表2 红螯螯虾6个群体遗传多样性指数
2.2 群体结构及分子遗传变异
6个红螯螯虾群体间的遗传距离为0.00403~0.00969(表3)。其中海南澄迈群体和安徽阜阳群体间的遗传距离较大,为0.00969,广东珠海群体和江苏苏州群体间的遗传距离最小,为0.00403。其中安徽阜阳群体与其他5个群体间的遗传距离均较远。

表3 红螯螯虾6个群体间的遗传距离
以邻接法构建的系统关系图显示,江苏苏州群体和浙江湖州群体首先聚为一支,并逐渐与江苏镇江、海南澄迈、广东珠海群体聚集,安徽阜阳群体单独为一支(图1)。

图1 红螯螯虾6个群体的聚类分析
3 讨 论
3.1 红螯螯虾COⅠ基因片段变异及特征分析
红螯螯虾原产于澳大利亚北部及昆士兰西北部地区,我国最早于1992年由湖北水产研究所引进,1998年浙江湖州突破了红螯螯虾规模化人工繁殖技术,目前江苏、浙江、广东、海南等地是我国红螯螯虾的主要养殖地区。多年来,由于群体引进记录不完善,国内不同繁养群体的遗传特征(特别是不同群体间的亲缘关系)尚未被系统研究,红螯螯虾养殖过程中又存在无序留种、单一群体累代繁殖等问题,养殖过程中相继出现病害频发等现象。为解决种群退化问题,国内相关企业已多次从国外引进红螯螯虾对国内繁养群体进行种质更新。在红螯螯虾引种过程中,由于不同批次引进群体的遗传特征数据尚未获取,无序引种一方面造成了巨大的资金浪费,同时也限制了国内已有繁养群体的应用潜力。因此,对国内不同繁养基地已有红螯螯虾群体进行遗传特征分析,获取其遗传多样性及不同群体间的亲缘关系数据,对于有效利用国内已有红螯螯虾种质资源具有重要的意义。
谢雁南[12]利用微卫星分子标记对国内厦门、广州、崇明3个红螯螯虾养殖群体进行了遗传多样性分析,发现3个群体的平均表观杂合度为0.648~0.679,平均期望杂合度为0.535~0.567,平均多态信息含量为0.451~0.480,每个点位等位基因数为2~7,养殖群体尚未出现种质退化。线粒体基因组具有结构简单、分子小、进化快等特征,遵循严格的母系遗传,几乎不发生重组,不同区域的进化速度存在差异,而被广泛应用于种群遗传分化及多样性的研究[13-14],本试验遗传多样性分析结果表明,国内红螯螯虾累代繁育群体均具有较高的遗传多样性,这与上述谢雁南[12]得出的养殖群体尚未出现种质退化结论基本相同。究其原因,主要与该品种引入国内时间较短,同时部分繁养基地由于前期繁养不成功,会从其他繁养基地或澳大利亚、中国台湾补充少量种虾,群体间的基因交流也有效保持了各群体均具有较高的遗传多样性。6个群体中海南澄迈群体和广东珠海群体单倍型多样性较低,推测或因红螯螯虾在该地区繁养环境条件较为适宜,养殖经验较为丰富,基本解决“繁养推”一体化,多年的自繁自养等因素导致其遗传多样性相对较低。浙江是国内较早攻克红螯螯虾室内人工苗种繁育技术的地区,该地区苗种的供给比较成熟,有相对独立的亲本引繁体系。试验中发现,浙江繁养群体缺乏H1单倍型,推测浙江群体与其他群体间的基因交流相对较少,而且该单倍型可能来源于最新从国外引进的红螯螯虾群体。
3.2 不同繁育基地红螯螯虾遗传距离及交流情况
Nei[15]认为,群体间的遗传距离为0.00~0.05。本研究中6个红螯螯虾群体间的遗传距离为0.00403~0.00969,低于李吉涛等[16]测定的脊尾白虾(Exopalaemoncarinicauda)渤海湾、莱州湾、胶州湾、海州湾4群体间的遗传距离(0.0153~0.0345)。由6个群体间遗传距离结果来看,由于交流频繁,广东珠海群体和江苏苏州群体间遗传距离最小,同时由于地缘关系江浙一带群体间遗传距离也较小,但安徽阜阳群体与其他5个群体间的遗传距离均较远,推测与其亲本引进渠道及外界交流较少有关。红螯螯虾在江浙等内陆地区不能自然繁殖,无法自然进行种群的扩散繁衍,其种质的保存与更新完全依赖人为的干预。
3.3 红螯螯虾资源的保护与利用
养殖业会受到长期近亲繁殖带来的产量下降等一系列影响[17],本试验结果初步表明,目前我国红螯螯虾繁养群体遗传多样性水平仍然较高,但随着养殖规模的扩大和养殖行业的推进,红螯螯虾长期自繁自养的弊端可能会逐步凸显,如何加强对种质资源的评估和繁育群体多样性的保护更新,对推动红螯螯虾产业长期健康稳定发展具有重要的现实指导意义。
