激光剥蚀电感耦合等离子体质谱在生物样品定量分析中的研究进展
2020-07-27刘金辉郑令娜陈明丽丰伟悦
刘金辉,郑令娜,汪 冰,陈明丽,王 萌*,丰伟悦
(1.中国科学院高能物理研究所,中科院纳米生物效应与安全性重点实验室,北京 100049;2.东北大学理学院,辽宁沈阳 110819;)
1 前言
激光剥蚀电感耦合等离子体质谱(Laser Ablation-Inductively Coupled Plasma-Mass Spectrometry,LA-ICP-MS)作为一种用于直接分析固体材料中元素的分析技术[1],自诞生以来就受到了广泛的关注,并已经在地质、海洋、核工业、环境、生物、材料、法医等科学领域得到了广泛应用[2 - 5]。传统湿法消解的元素分析方法存在着消解过程繁琐,易挥发元素损失,酸碱试剂消耗量大,制样过程易受到污染等问题。而LA-ICP-MS样品前处理过程简单,样品损伤小,进样速度快,空间分辨率高,因此LA-ICP-MS成为一种固体样品中微量元素分析的常用技术[2,3]。
LA-ICP-MS分析技术最早由Gray提出[6]。经历了30多年的发展,LA-ICP-MS仪器不断改进:在激光剥蚀系统方面,新开发的冷冻剥蚀更适合生物组织的成像分析[7];快速洗脱样品池可以实现小于10 ms的洗脱时间,降低了样品气溶胶的扩散和稀释,大大提高了分析速度和灵敏度[8,9];近场技术(Near Field,NF)让激光光斑降低到亚μm级,使得基于NF-LA-ICP-MS的单细胞元素成像成为可能[10]。在质谱系统方面,随着新一代的ICP-MS,特别是采用飞行时间(Time of flight,TOF)质量分析器的商品化ICP-TOF-MS的出现,使得LA-ICP-MS系统具有更快的数据采集速度,能够同时检测更多的同位素[11]。但是由于基体效应、元素分馏效应的影响,准确的定量分析仍是LA-ICP-MS分析的一个难点,限制了LA-ICP-MS进一步地应用和发展。本文将对基于LA-ICP-MS的生物样品定量分析进行总结与展望。
2 LA-ICP-MS系统
LA-ICP-MS系统主要由激光剥蚀(LA)系统和电感耦合等离子体质谱(ICP-MS)系统两部分组成,主要包括:激光系统、配有精密移动平台的样品池、ICP-MS仪和计算机。基本原理是将高能激光束聚焦于固体样品表面进行剥蚀取样,随后使用ICP-MS仪分析产生的气溶胶。为了保证分析的准确度,理想的LA-ICP-MS分析需要满足以下三个条件:一是激光剥蚀取样具有代表性,即激光剥蚀产生的气溶胶的组成与样品组成相同;二是高的气溶胶传输效率,即传输过程中气溶胶损失较少;三是高的离子化效率,即气溶胶颗粒能在等离子体中完全原子化和离子化[5]。
3 定量校正方法
LA-ICP-MS分析的误差主要来自样品剥蚀过程、气溶胶传输过程、气溶胶离子化过程和质谱分析过程(图1)[12]。LA-ICP-MS中校正的目的是减少分析过程中的误差,使检测信号可以更准确、更真实地反映样品中的元素信息。误差的校正主要包括两个部分:基体效应和元素分馏效应的校正。
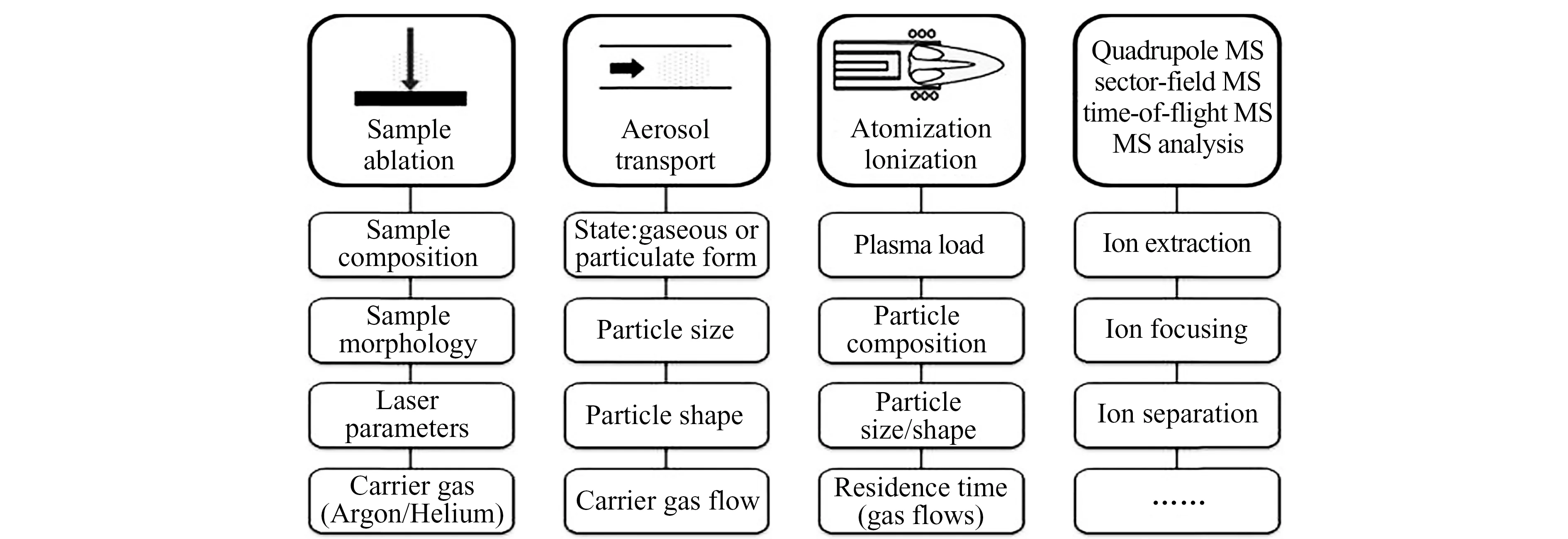
图1 LA-ICP-MS分析中的误差来源[12]Fig.1 Sources of error in LA-ICP-MS analysis[12]
基体效应是指基体对测量结果的影响,可分为基体组成效应(基体元素的浓度和形态等)与物理结构效应(如玻璃态与结晶态)[13]。由于很难找到完全基质匹配的标准参考物,实际分析中常常选用合适的内标元素来补偿基体效应[14]。分馏效应是由于样品中不同元素在剥蚀、传输和离子化过程中存在差异,导致测量结果与样品实际组成有一定差异[5,15]。样品中的易挥发性元素在剥蚀产生的气溶胶中被富集,从而导致非化学计量取样和分析[16]。如激光波长是影响元素分馏效应的一个重要因素,使用更短的激光波长能有效减少分馏效应;使用He作为载气也可以减小分馏效应,提高分析结果的可靠性[17 - 19]。
目前生物样品的LA-ICP-MS分析主要采用基体匹配外标校正法和同位素稀释法两种方法。
3.1 基体匹配外标校正法
基体匹配外标校正法需要使用与待测样品基体匹配的有证标准物质(Certified Reference Materials,CRM)。如果样品与CRM基体匹配,那么两者的激光剥蚀、气溶胶传输、离子化等过程被认为是基本相同的,从而得到可靠的分析结果。但是目前只少数几类商品化的CRM(如玻璃),而缺乏应用于LA-ICP-MS生物分析的CRM。为了解决上述问题,各个实验室自行制备了基质匹配的生物标准样品,其制备过程主要包括匀浆、元素加标、冷冻、低温切割和固化等[3],主要流程如图2所示。目前文献中已有使用鼠脑[20]、鸡胸肉[21]、蛋黄[22]等制备基体匹配标准并成功用于生物样品中微量元素定量的报道。使用生物组织作为标准物质的优点在于,标准与样品基体相近,可以有效减小基体效应和分馏效应的影响。
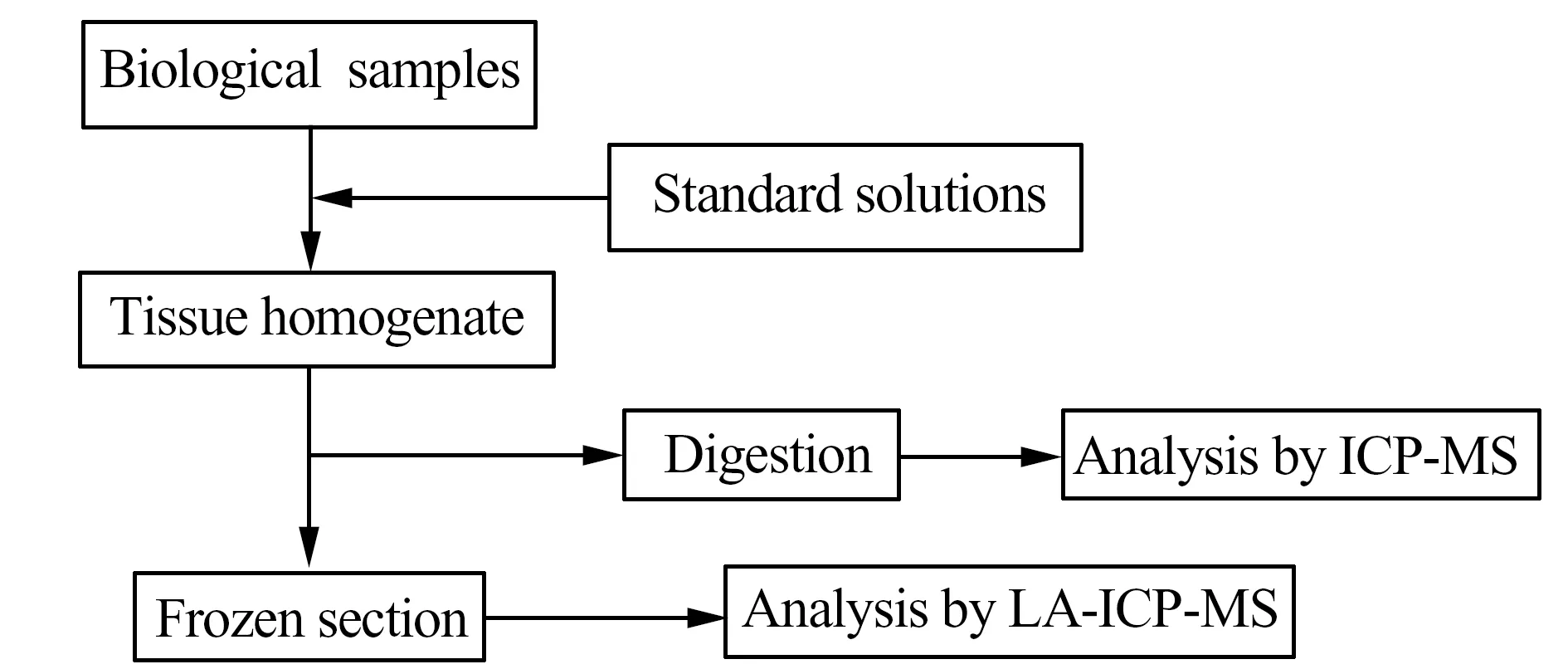
图2 组织标准合成的工作流程Fig.2 Schematic workflow for standard tissue synthesis
除了使用生物组织以外,还可以使用天然或人工合成的高分子材料制作标准物质。Austin等用旋涂的方法制备了含有已知浓度的系列聚甲基丙烯酸甲酯薄膜(PMMA),成功定量分析了生物切片[23]。Stark等使用加标的琼脂糖薄膜作为LA-ICP-MS定量标准,实现了对细胞内金属元素的准确定量[24]。Cruz-Alonso等使用实验室制备的眀胶标准,对阿尔茨海默病患者脑中的含铁蛋白进行了定量成像[25]。此类方法的优点是标准物质制备过程相对简单,价格低廉,具有很好的实用价值。
在使用基体匹配外标法定量时,可以同时使用内标法进行校正。合适的内标可以校正激光输入功率、样品剥蚀量等差别,得到更加可靠的分析结果。选择的内标元素需要在样品中均匀分布,并且内标元素与分析元素在LA-ICP-MS分析过程中的物理化学行为近似。碳元素在生物组织中广泛分布,常常作为内标校正元素。此外,硫元素也可以作为分析某些生物样品(如头发)的内标校正元素[26]。
3.2 同位素稀释法
在应用同位素稀释法(Isotope Dilution,ID)时,首先向样品中加入已知丰度和质量的同位素稀释剂,达到同位素平衡后,再通过分析同位素比的变化得到样品中元素含量[27]。同位素稀释法可以直接溯源到国际单位制,是一种权威的化学计量方法。但是对于LA-ICP-MS分析来说,同位素稀释剂很难直接添加到生物样品中并实现同位素平衡[28]。
为了将同位素稀释剂均匀地添加到生物样品中,Thieleke等利用含有同位素稀释剂的聚合物薄膜(5~10 μm)对生物样品中的微量元素进行了定量,为LA-ICP-MS的准确定量提供了一种可选择的方案[29]。Feng等利用免疫组化笔勾勒鼠脑切片的轮廓,保证添加的同位素稀释剂均匀分布在切片范围内,通过称量法得到添加同位素稀释剂质量,得到了鼠脑切片中Cu、Zn、Fe定量成像[30]。Moraleja等利用商品化的喷墨打印机,在小鼠肾脏切片上均匀打印同位素稀释剂,实现了同位素稀释剂与生物切片的原位混合,通过LA-ICP-MS得到了铂类抗癌药物在小鼠肾脏中的分布[31]。
除了上述在样品制备过程中添加同位素稀释外,还可以在线引入同位素稀释剂。在这种校准方法中,激光剥蚀产生的固体气溶胶与来自同位素稀释剂的液体气溶胶混合,进入进ICP-MS仪完成分析,因而无需繁琐前处理过程就可以实现组织切片等生物样品的原位定量分析[32,33]。在线引入同位素稀释剂存在的问题是两种气溶胶很难混合均匀,可能导致同位素比值测定不准确。为了提高气溶胶混合效率,达到良好的同位素平衡,Feng等比较了4种不同的在线同位素稀释剂混合装置,综合评价了装置的混合效率[34]。
4 应用
目前地球科学仍然是LA-ICP-MS的主要应用领域,但近年来LA-ICP-MS在生物分析领域得到了越来越广的应用。本文将简述LA-ICP-MS在单细胞分析,生物元素成像、生物分子成像等方面的应用。
4.1 单细胞分析
传统分析细胞中微量元素的方法(如消解后用ICP-MS法检测),只能获得细胞群体中元素的平均含量,并不能得到单个细胞的元素含量,无法研究元素在细胞间的差异。LA-ICP-MS法被认为是一种很有潜力的单细胞原位分析方法[35,36],但目前分析方法的主要困难在于缺乏单细胞的定量标准物质。
Drescher等用移液器在硝基纤维薄膜上制备金属纳米颗粒液滴(~0.5 μL),作为基体匹配标准,实现了LA-ICP-MS法对单细胞中金属纳米颗粒的定量分析[37]。但是用移液器制备的液滴(μL量级)与细胞(pL量级)的体积有巨大的差别,在一定程度上影响了结果的可靠性。Wang等使用喷墨打印机制备了与细胞大小和含碳量相似的标准溶液液滴,作为基体匹配的单细胞外部定量标准,利用LA-ICP-MS法定量分析了载玻片上单细胞中的金纳米颗粒[38]。Stigin等采用微流控技术制备了含有不同浓度Cu的明胶微阵列作为外部标准,采用LA-ICP-MS法定量分析了单个海螺细胞中的Cu,并用同步辐射X射线荧光法验证了LA-ICP-MS法的结果[39]。
为了提高LA-ICP-MS的单细胞分析通量,Zheng等使用微加工技术制备了用于捕获细胞的微孔阵列,得到了整齐排列的人支气管上皮细胞(16HBE)单细胞阵列,因此可以采用网格方式剥蚀阵列中的单细胞,从而提高了LA-ICP-MS单细胞的分析通量(图3)[40]。
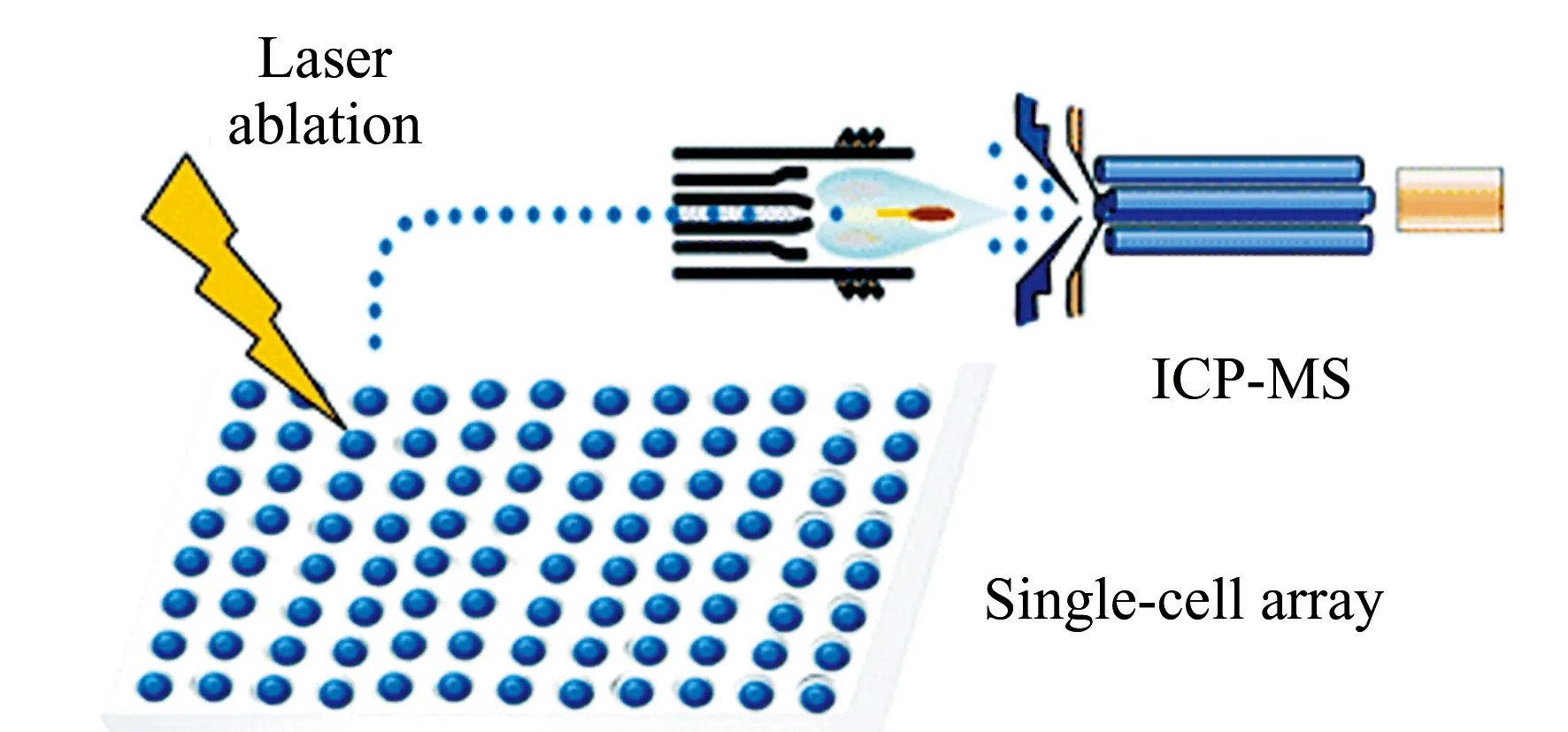
图3 LA-ICP-MS分析单细胞阵列[40]Fig.3 Analysis of single cells in array by LA-ICP-MS[40]
4.2 生物元素成像
微量元素在生物体内含量虽然很低,却起着至关重要的作用。例如微量元素作为蛋白质的活性中心或结构中心,参与了生物体内的许多重要化学反应[41]。微量元素还与一些疾病的发生发展密切相关[42]。因此,生物元素的原位分析,无论是对于研究微量元素在生物体内的结构、功能和生物效应,还是对于阐明与微量元素相关疾病的发病机理,寻找这些疾病的预防和治疗策略,都具有重要的意义[43,44]。LA-ICP-MS法最近越来越多地应用于生物元素成像分析,表1列举其中部分应用实例。

表1 LA-ICP-MS生物元素成像的部分应用
4.3 生物分子成像
LA-ICP-MS技术与免疫组织化学技术结合,可以实现生物切片中分子成像分析。首先使用元素标记的抗体特异性识别切片上的待测分子(抗原),然后通过LA-ICP-MS法分析标记的元素得到待测分子的成像图。利用上述方法,Seuma等成功得到了两种癌症生物标志分子在组织上的成像,进一步拓展了LA-ICP-MS 的应用范围[57]。
最近出现的基于TOF技术的ICP-MS仪(即流式质谱仪,Mass Cytometry),被认为可能成为下一代单细胞分析的实验平台[58,59]。由于使用TOF质量分析器,流式质谱仪具有很快的扫描速度,可以瞬时检测信号中的多个元素,大大提高了元素成像的速度。Giesen等将流式质谱仪与激光剥蚀系统联用,使用金属标记抗体,在亚细胞水平上对乳腺癌组织切片的32种蛋白同时完成了免疫成像分析[60]。虽然基于LA-ICP-MS法的免疫分子成像技术还处于早期发展阶段,但已经表现出了强大的分析能力,有望在肿瘤微环境研究、免疫诊疗等领域中得到进一步应用[61]。
5 总结与展望
检出限好、动态范围宽、空间分辨率高等优点让LA-ICP-MS成为直接分析固体样品中元素的有力工具。近年来,随着激光器、样品池、质量分析器等仪器硬件的快速发展,同时随着分析方法,特别是定量方法的不断进步,LA-ICP-MS法开始越来越广泛地应用于生物医学研究。
在最近的文献报道中,有几个趋势值得关注:首先,LA-ICP-MS分析空间分辨率不断提高,达到亚微米的水平,这使得在单细胞的元素成像成为了可能;其次,LA-ICP-MS的分析速度提高,可以分析整体动物切片,并可以通过三维重构连续切片的元素成像图,得到元素在样品中三维立体分布;最后,LA-ICP-MS与其他多种生物技术或检测技术的联用,可以研究以前单一技术难以完成的科学问题。比如近年来研究人员把LA-ICP-MS技术和免疫组织化学技术结合,实现了对同一切片中几十种蛋白分子的成像和半定量分析。仪器硬件和分析方法的紧密结合和相互促进,必将推动LA-ICP-MS法在生物医学领域更广泛的应用,取得更多的突破性成果。
