浙江景宁云锦杜鹃叶斑病病原菌鉴定及生物学特征研究
2020-07-27刘浩凯陈玲芳仇辉康王宗琪刘卫荣路媛媛
刘浩凯 ,张 辉,陈玲芳,仇辉康,王宗琪,刘卫荣,李 丽,路媛媛
(1.景宁畲族自治县自然资源和规划局,浙江 景宁 323500;2.景宁畲族自治县生态林业发展中心,浙江 景宁 323500;3.山西农业大学生命科学学院,山西 太谷 030801)
云锦杜鹃Rhododendron fortunei为杜鹃花科Ericaceae杜鹃属Rhododendron常绿杜鹃亚属Subgen.Hymenanthes常绿灌木或小乔木,高3~12 m,在我国浙江、江西、福建、湖南、安徽、广东、广西等省(区)均有分布,生长于海拔600~2 000 m的山脊阳处或林下。景宁上山头海拔1 689 m,是景宁畲族自治县第一高峰,该地保存着以云锦杜鹃和猴头杜鹃Rh.simiarum为主的千亩天然杜鹃林,是当地宝贵的自然资源,近年来病虫害的频繁发生严重影响了杜鹃林的健康生长和景观效果。
近几年,我国对云锦杜鹃开展了许多基础性研究[1],内容涉及资源分布、生态研究[2-6]、遗传多样性[7]等,但关于病虫害方面的报道甚少。目前,对杜鹃病害的研究多以叶部病害为主,主要有叶斑病Cercospora rhododendri,灰霉病Sclerotinia fuckeliana,煤污病Capnodiumsp.等[8-12],其中,汪梅蓉[8]、何香等[9]和林高峰等[10]发现叶斑病主要症状为发病初期叶片上出现红褐色小斑点,逐渐扩展成为圆形或不规则的多角形病斑,呈黑褐色,后期病斑中央组织变为灰白色,并将杜鹃叶斑病病原鉴定为杜鹃尾孢菌C.rhododendri。2017年,景宁畲族自治县上山头天然杜鹃林中的云锦杜鹃发生了严重的叶斑病,侵染初期,叶片上出现褐色小斑点,逐渐扩展成为圆形或不规则病斑,呈黑褐色,直径1~5 mm,后期病斑周围出现黄色晕圈,导致叶片枯黄、早落,此次在云锦杜鹃上发现的叶斑病与以往报道的叶斑病症状有所不同。为明确该云锦杜鹃叶斑病的病原菌种类,作者对发病叶片进行了病原分离和致病性测定,结合病原形态学及rDNA-ITS序列分析鉴定了病原菌种类;同时开展了该病原菌生物学特性研究,探讨了不同培养条件对病原菌生长的影响,以期为该病害的深入研究及防控提供理论依据。
1 材料与方法
1.1 主要仪器和试剂
13395H2X光学显微镜(德国Leica公司)、XB-K-25血球计数器(上海医用光学仪器厂)、LRH-250-G光照培养箱(广东省医疗器械厂)、TC-4000 PCR扩增仪(北京德力莱科技发展有限公司)、BG-1520凝胶成像系统仪(上海欧翔科学仪器有限公司)。
无水乙醇(分析纯)、无菌水、0.1%升汞、0.5 mol·L-1EDTA(乙二胺四乙酸)、1 mol·L-1Tris-HCl、3% CTAB提取缓冲液、TAE缓冲液、氯仿-异戊醇、异丙醇、Taq酶。
1.2 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯(阳芋Solanum tuberosum)200 g,葡萄糖20 g;马铃薯蔗糖琼脂培养基(potato sucrose agar,PSA):马铃薯200 g,蔗糖20 g;燕麦琼脂培养基(oat meal agar,OMA):燕麦片30 g;察氏培养基:NaNO33.0 g,K2HPO41.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO40.01 g,蔗糖30 g;霉菌培养基:马铃薯200 g。以上固体培养基均需加入琼脂20 g,蒸馏水定容至1 L。
1.3 病样采集及柯赫氏法则验证
2017-2018年,在浙江省丽水市景宁畲族自治县上山头天然杜鹃林采集云锦杜鹃叶斑病症状典型叶片,根据症状进行描述。病原菌分离采用常规组织分离法[13],共分离出9株菌株,经单孢分离技术[14]纯化后获得菌落形态一致的病原菌,供试菌株DJ-1保存于4℃冰箱中。
柯赫氏法则验证:选用现采的无病害带枝新叶,采用喷雾法进行接种,将PDA平板培养7 d后的病原菌菌落用无菌水配制成浓度为1×107个·mL-1的孢子悬浮液,喷雾接种于20片上述云锦杜鹃叶片上,每片叶片接种2 mL孢子悬浮液,在25~28℃、相对湿度85%的条件下进行保湿培养;以喷施清水为对照。
1.4 病原菌rDNA-ITS测定
采用常规CTAB法进行病原菌基因组总DNA提取。核糖体rDNA序列扩增引物为ITS1:(5′-TCCGTAGGTG AACCTGCGG-3′)和ITS4:(5′-TCCTCCGCTTATTGATATGC-3′)[15]。
反应体系20 μL:10.0 μL 2×Taq PCR Mix,0.5 μL上游引物(10 μM),0.5 μL下游引物(10 μM),1.0 μL模板DNA,8.0 μL ddH2O(扩增所用试剂购于TaKaRa)。
扩增程序:94℃变性5 min;94℃ 30 s,55℃ 30 s,72℃ 1min,35个循环;72℃延伸10 min。
将PCR回收产物委托宝生物工程(大连)有限公司(TaKaRa)进行测序,将所测结果在GenBank中利用Blast N软件进行序列分析。
1.5 病原菌生物学特征测定
1.5.1 不同培养基对DJ-1菌株生物学特征的影响 在25℃条件下,选取云锦杜鹃叶斑病病菌菌株DJ-1在PDA上培养3~4 d后,从菌落边缘打取直径6 mm的菌饼,将其转移至新的PDA,PSA,OMA,察氏,霉菌5种不同的固体培养基上培养,从第2天开始,采用十字交叉法逐日测量菌落直径,计算菌丝生长速率,每个处理重复5次。利用纽鲍尔(Neubauer)氏血球计数板测定产孢量,每个处理重复10次。
1.5.2 不同碳源对DJ-1菌株生物学特征的影响 供试碳源有5种:蔗糖、葡萄糖、果糖、木糖、甘露醇,用量2%(100 mL培养基中加入2 g碳源物质),以PDA为基础培养基,将其配制成不同碳源培养基。待菌落生长成熟,移植直径为9 mm的菌饼于培养基平板中央,于25℃恒温培养,每个处理重复5次。测量方法同上。
1.5.3 不同氮源对DJ-1菌株生物学特征的影响 供试氮源有6种:KNO3,(NH4)2SO4,蛋白胨,脲,苯丙氨酸,甘氨酸,用量2%(100 mL培养基中加入2 g氮源物质),以察氏培养基为基础培养基,将其配制成不同氮源培养基。待菌落生长成熟,移植直径为9 mm的菌饼于培养基平板中央,于25℃恒温培养,每个处理重复5次。测量方法同上。
1.5.4 不同pH对DJ-1菌株生物学特征的影响 采用PDA平板培养基。用1 mol·L-1和0.1 mol·L-1的HCl,1 mol·L-1和0.1 mol·L-1的NaOH溶液进行调配,间隔为1设置pH梯度,范围为3.0~12.0。移植直径为9 mm的菌饼于培养基平板中央,于25℃恒温培养,每个处理重复5次。测量方法同上。
1.5.5 不同光照条件对DJ-1菌株生物学特征的影响 分别设置全光照、全黑暗和光照12 h+黑暗12 h交替3个处理。采用PDA平板培养基。移植直径为9 mm的菌饼于培养基平板中央,于25℃恒温培养,每个处理重复5次。测量方法同上。
1.5.6 菌丝致死温度测定 将直径为9 mm的病原菌菌饼移入装有10 mL无菌水的试管中,每管3个菌饼,塞好棉塞,将不同试管分别置于50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65℃恒温水浴锅中处理10 min(预热1 min),测定菌丝的致死温度范围。每个处理重复5次,于25℃下恒温培养。测量方法同上。
1.6 数据分析
试验数据采用SPSS 17.0软件统计分析,应用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 病症描述
根据野外调查结果显示,云锦杜鹃叶斑病主要危害叶片,侵染初期,叶片上出现褐色小斑点,后逐渐扩展成为圆形病斑,或不规则病斑,黑褐色,直径1~5 mm。后期病斑周围出现黄色晕圈,导致叶片枯黄、早落。在潮湿环境条件下,叶斑下面着生许多褐色的小霉点,即病原菌的分生孢子及分生孢子器(图1A)。

图1 云锦杜鹃叶斑病发病症状Figure 1 Symptom of leaf spot on R.fortunei
2.2 病原菌分离及柯赫氏法则验证
本试验经分离纯化后获得9株菌株(DJ-1,DJ-2,DJ-3,DJ-4,DJ-5,DJ-6,DJ-7,DJ-8,DJ-9),经形态学鉴定为同一种病原菌,选取DJ-1为供试菌株,经喷雾法接种于现采的无病害带枝新叶,7 d后叶片发病。发病初期叶片出现褪绿斑点,随后,扩展为褐色病斑(图1B)。人工接种后症状与野外症状相一致。经重新分离后,获得与野外自然发病同一种病原菌,证明DJ-1菌株是引起云锦杜鹃叶斑病的病原菌。
2.3 病原菌形态特征
在PDA上形成的菌落特征:培养初期,病原菌在培养基上形成白色的菌丝,菌落稀疏;随着培养时间的延长,菌落颜色呈灰白色,均匀致密,菌丝为绒毛状或棉絮状,20 d后菌落上形成黑色小点(图2A)。
分生孢子为单细胞、无色、纺锤形至椭圆形,两端有1~2个油滴,平均大小为(7.0~10.0)μm×(2.7~3.3)μm(图2B),未观察到乙型(β型)分生孢子。分生孢子器呈黑褐色,扁球形,大小为82 μm×178 μm(图2C)。

图2 云锦杜鹃叶斑病病原菌形态Figure 2 Morphology of pathogen of leaf spot on R.fortunei
依据《真菌鉴定手册》[16]等对拟茎点霉属Phomopsis的描述及鉴定标准,本实验分离获得的云锦杜鹃叶斑病病原菌,形态特征与其完全相符,初步鉴定该菌为芦笋拟茎点霉Phomopsis asparagi。
2.4 病原菌分子鉴定
采用ITS1和ITS4引物对扩增病原菌的rDNA-ITS区序列,获得片段长度为531 bp(图3),将该序列与GenBank中相关菌株的ITS序列进行同源性比较。结果显示,待测菌株与芦笋拟茎点霉(登录号HM145960.1)的同源性达到99%,由此根据形态学及分子生物学鉴定待测的云锦杜鹃叶斑病病原菌菌株为芦笋拟茎点霉。
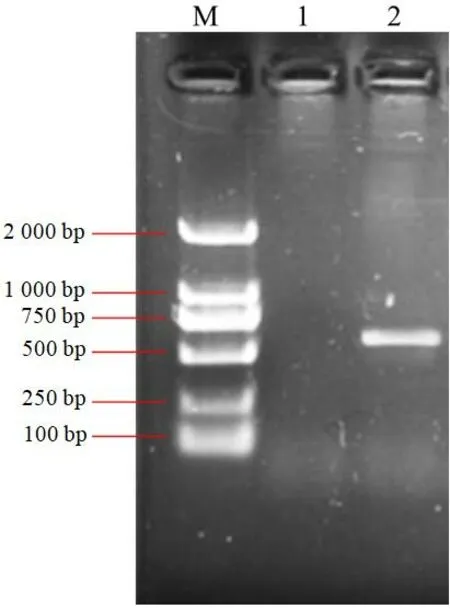
图3 病原菌的PCR扩增产物Figure 3 PCR amplification of pathogen
2.5 环境条件对病原菌菌丝生长速率及产孢量的影响
2.5.1 不同培养基对DJ-1菌株生长速率及产孢量的影响 由表1表明,DJ-1菌株菌丝生长速率在供试的5种培养基上均表现出明显差异(P<0.05),其中以PDA培养基上菌丝生长速率最快(13.93 mm·d-1),其次为PSA,OMA和霉菌培养基,其生长速率分别为12.13 mm·d-1,12.83 mm·d-1和12.63 mm·d-1,在察氏培养基上生长速率最慢(8.9 mm·d-1);不同的培养基上病原菌产孢量同样具有显著差异(P<0.05),病原菌在PDA和PSA上产孢量最大,分别达到4.83×106和4.78×106个,其次为OMA,霉菌培养基,在察氏培养基上病原菌产孢量最小仅为0.83×106个(表1)。从菌落形态和颜色来看,DJ-1菌落除在察氏培养基上分布稀疏、颜色较浅外,在其他培养基上均菌落分布致密并呈轮纹状(图4)。
2.5.2 不同碳源对DJ-1菌株生长速率及产孢量的影响 由测定结果表明,病原菌可以利用多种碳源,但在不同碳源培养基之间菌落直径差异显著(P<0.05)(图5),其中,以甘露醇最适宜生长,其病原菌生长速率为13.67 mm·d-1;其次为葡萄糖和蔗糖,在这2种碳源培养基上菌丝的生长速率相差不大,差异不显著,其病原菌的生长速率分别为12.20 mm·d-1和12.13 mm·d-1;果糖和木糖的利用率较差,在其培养基上病原菌的生长速率分别为11.70 mm·d-1和10.00 mm·d-1;由产孢量测定结果表明,不同碳源对DJ-1菌株的产孢量存在显著影响(P<0.05),DJ-1菌株在葡萄糖和果糖培养基碳源中产孢量最大,分别为4.83×106,4.72×106个,其次为蔗糖和木糖,在甘露醇中产孢量最少,仅为0.95×106个(表2)。

表1 不同培养基对DJ-1菌丝生长速率及产孢量的影响Table 1 Effect of different medium on mycelium growth and sporulation quantity of DJ-1

表2 不同碳源对DJ-1菌丝生长速率及产孢量的影响Table 2 Effect of different carbon sources on mycelium growth and sporulation quantity of DJ-1 bacterium
图4 不同培养基上的病原菌菌落形态Figure 4 Colonial morphology of pathogen on different media

图5 不同碳源培养基上的病原菌菌落形态Figure 5 Colonial morphology of pathogen on different carbon source media
图6 不同氮源培养基上的病原菌菌落形态Figure 6 Colonial morphology of pathogen on different nitrogen source media
2.5.3 不同氮源对DJ-1菌株生长速度及产孢量的影响 由测定结果表明,病原菌可以在多种氮源中生长(图6),但在不同氮源培养基中,病原菌菌落的直径差异较显著(P<0.05),其中,在甘氨酸中的生长最快,其生长速率为12.22 mm·d-1,在脲中其次,其生长速率为10.61 mm·d-1,在硫酸铵、蛋白胨和KNO3中生长速率差异并不明显,苯丙氨酸中不适宜该病原菌生长,其生长速率仅为6.09 mm·d-1;由产孢量测定结果显示,病原菌产孢量在不同的氮源培养基下差异显著(P<0.05),甘氨酸培养基有利于病原菌产孢,其产孢量达到8.26×106个,其次为硫酸铵、蛋白胨、苯丙氨酸培养基,而脲和KNO3培养基不利于产孢(表3)。

表3 不同氮源对DJ-1菌丝生长速率及产孢量的影响Table 3 Effect of different nitrogen source medium on mycelium growth and sporulation quantity of DJ-1
2.5.4 不同pH对DJ-1菌株生长速率及产孢量的影响 由图7可知,不同pH对病原菌菌丝生长速率影响显著(P<0.05),病原菌菌丝在pH 3.0~ 12.0范围内均可以生长,其中,以pH在 8.0~10.0时菌丝的生长速率最快(pH8.0,9.0,10.0时的菌丝生长速率分别为10.79 mm·d-1,10.31 mm·d-1,10.60 mm·d-1),最适宜该病原菌的生长;当pH在3.0~7.0时,随着pH的升高,菌丝生长速率加快;当pH在8.0~12.0时,随着pH的增高,菌丝生长速率逐渐减慢;对产孢量的测定结果表明,pH对于病原菌产孢量的影响显著(P<0.05),pH在3.0~8.0范围,病原菌产孢量随着pH的增高逐渐增多,在pH为8.0时产孢量达到最大,为3.15 ×106个,但pH在10.0~12.0时病原菌的产孢量随着pH的升高逐渐减少。由表4可知,强酸和强碱条件下均不利于病原菌孢子的产生。

图7 不同pH培养基上的病原菌菌落形态Figure 7 Colonial morphology of pathogen on media with different pH
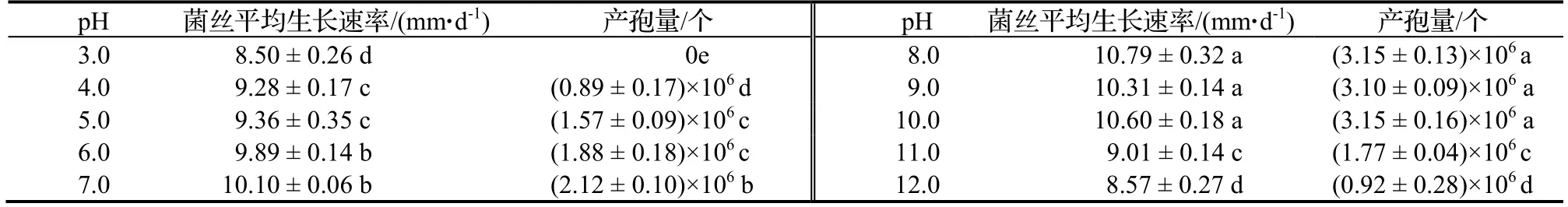
表4 不同pH对DJ-1菌丝生长速率及产孢量的影响Table 4 Effect of pH on mycelium growth and sporulation quantity of DJ-1
2.5.5 不同光照条件对DJ-1菌株生长速率及产孢量的影响 根据试验测定结果表明(图8),全光照、全黑暗、光照12 h+黑暗12 h交替条件下菌丝均可以生长,但不同光照处理下DJ-1菌丝平均生长速率存在明显差异(P<0.05),病原菌菌丝在光照12 h+黑暗12 h交替条件下生长最好,菌丝平均生长速率达到12.08 mm·d-1,显著高于(P<0.05)全光照和全黑暗处理(10.36 mm·d-1,11.33 mm·d-1);由产孢测定结果表明,全光照、全黑暗、光照12 h+黑暗12 h交替都有利于病原菌产孢,但以光照12 h+黑暗12 h交替处理最利于病原菌孢子的产生,其产孢量为3.10 ×106个,其次为全光照及全黑暗条件,其产孢量分别为2.25×106个和2.17×106个(表5)。

表5 不同光照条件对DJ-1菌丝生长速率及产孢量的影响Table 5 Effect of different illumination on mycelium growth and sporulation quantity of DJ-1

图8 不同光照条件下病原菌菌落形态Figure 8 Colonial morphology of pathogen under different light conditions
2.5.6 DJ-1菌丝及分生孢子致死温度测定 由表6可知,在50~59℃,将病原菌菌丝处理10 min,菌丝均能正常生长;当处理温度≥60℃时,菌丝均不再生长,因此该病原菌致死温度为60℃。在50~54℃,将该致病菌分生孢子处理10 min后,分生孢子均能萌发,然而当温度≥55℃时,分生孢子不再萌发,由此可认定该病原菌分生孢子的致死温度为55℃。
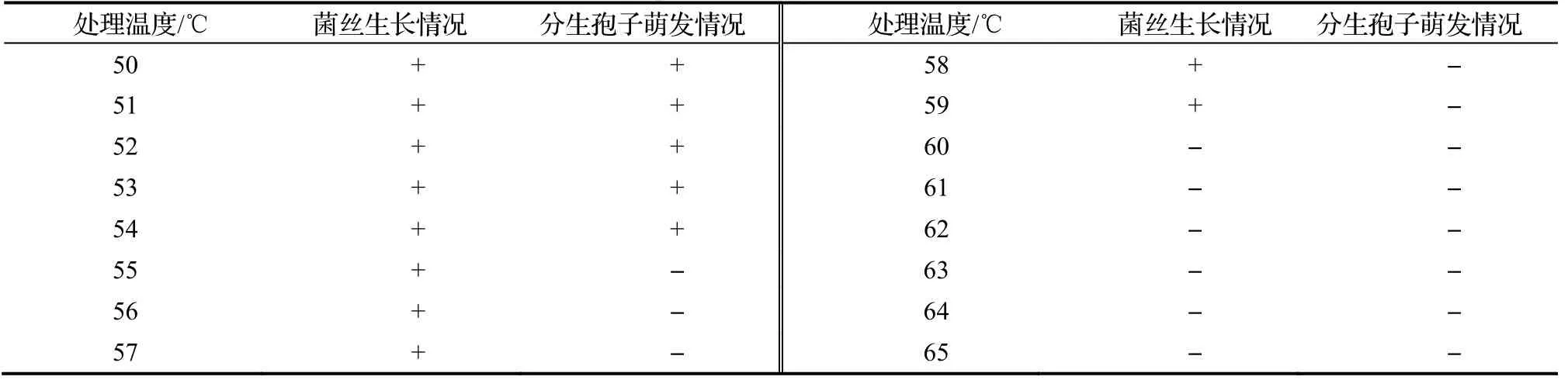
表6 DJ-1菌丝和分生孢子致死温度测定Table 6 Lethal temperature for mycelium and conidium of DJ-1
3 结论与讨论
本研究对采集于浙江省景宁县上山头云锦杜鹃叶斑病样本进行了病原菌分离、形态学观察,采用柯赫氏法则验证及DNA序列分析,最终确定云锦杜鹃叶斑病的致病病菌为芦笋拟茎点霉。
芦笋茎枯病菌隶属于拟茎点霉属,该属种类多,分布广,为重要的植物致病真菌,属中大多数种可导致作物、水果及树木等植物病害,如拟茎点霉属真菌引起的油棕叶斑病Elaeis guineensis[17],葡萄拟茎点藤叶斑病P.viticola[18];筒凤拟茎点霉P.spectabilis引起的广东凤梨科Bromeliaceae观赏植物叶斑病[19]等。尤其在热带和亚热带地区,一些寄生性和致病性较强的种类,会引起严重病害而导致农作物和花卉等的产量大大减少,如:橘子树脂病P.cytospore,茄子褐纹病P.vexans,芒果树脂病P.cytospore和大豆茎溃疡病Diaporthe phaseolorum等[20]。有报道,在美国爱荷华发现芦笋茎枯病菌可引发多种大豆Glycine max病害[21],其中包括根腐病。目前该病菌已经传到其他植物上,且在中国、日本和葡萄牙等国家也均有发现。
本研究形态学鉴定结果与前人在芦笋茎枯病上的研究结果基本一致[22-26]。研究结果表明,不同培养基及环境条件对芦笋拟茎点霉菌株菌丝生长速率及产孢量有着显著的影响,其中,病原菌菌丝致死温度为60℃,10 min,这与刘志恒等的研究结果相一致[27]。但2003年顾振芳[28]在芦笋茎枯病菌生物学特性研究中发现,芦笋拟茎点霉的适宜pH为6.0~10.0,然而本试验中芦笋拟茎点霉的适宜pH为8.0~10.0,偏碱性。存在这种差异的原因可能是由不同植物之间遗传多样性不同所产生的。该致病菌在供试的不同碳、氮源中都可以生长,能够吸收利用多种碳源和氮源,说明该致病菌对营养条件要求不是很高,其中,菌丝生长时对甘露醇的利用效率最高,对木糖的利用率最低,所以醇类比糖类更易被病原菌吸收;而在氮源中吸收效果最好的是甘氨酸,最差的是硫酸铵。因此,在云锦杜鹃的管理过程中应该选择恰当的肥料。另外,该菌寄主范围较广,栽培上应避免种间的相互交叉感染,防止危害进一步扩大。本研究初步确定了云锦杜鹃叶斑病病原菌的生物学特性,为以后相关的防治研究提供了依据。
