香蕉细菌性枯萎病菌荧光LAMP检测体系的建立
2020-07-27杨雷亮孙丽霞吴颖儿单振菊王章根陈定虎
杨雷亮,管 维,孙丽霞,吴颖儿,单振菊,王章根,陈定虎
(1. 中山海关技术中心,广东 中山 528403; 2. 江苏农林职业技术学院,江苏 句容 212400)
【研究意义】香蕉为芭蕉科芭蕉属植物,全年可收获,是热带地区的重要经济作物之一,也是世界鲜果贸易量最大的水果。香蕉细菌性枯萎病是由青枯菌Ralstonia solanacearum2号小种侵染香蕉所引起的毁灭性土传真菌病害,是香蕉生产中危害最严重的病害之一[1-3]。由于该病防治困难,因此对该病菌的分子生物学早期检测在生产上的意义重大,一种快速简便、准确灵敏的检验检疫方法自然是目前迫切被需要。【前人研究进展】目前检测鉴定该病菌的方法主要包括形态鉴定、生理生化型鉴定,分子生物学鉴定。分子生物学鉴定分为PCR法、荧光PCR法和环介导等温扩增法等;环介导等温扩增(Loop-meadiated isothermal amplification, LAMP)技术是指利用2对针对目标基因设计特异性引物和一种具有链置换活性的DNA聚合酶,恒温条件下高效扩增基因的新技术[4-9]。目前,LAMP技术在检测细菌[10-18]、动植物病毒[19-22]、寄生虫[23],真菌[24-26]、转基因食品[27-28]、食物源成分[29-30]、生物工程[31]等领域均有应用,发展前景非常乐观。针对香蕉真菌性枯萎病菌已有荧光PCR检测方法[32]和LAMP检测方法[33]的报道,而对香蕉细菌性枯萎病的定性检测,我国学者还是围绕在如何让该病病原菌目标基因成功扩增或者对其特异性基因信号进行放大开展研究工作。漆艳香等根据香蕉细菌性枯萎病菌16SrDNA的保守区序列,在基因扩增片段区间应用引物和探针设计软件设计实时荧光PCR引物,再在引物对基因的扩增区间内找出具有稳定性的点突变区设计特异性探针,建立了对香蕉细菌性枯萎病菌的实时荧光PCR检测方法[34]。王念武等根据该菌的特异插入序列ISRso19设计了滚环扩增的锁式探针,并对超分支滚环扩增的反应条件进行优化,建立了灵敏度极高的香蕉细菌性枯萎病菌超分支滚环扩增技术。该检测技术能从相似的9种病原菌中特异性地检测出香蕉细菌性枯萎病菌,对DNA的检测的最低浓度为500 fg/μL,远高于普通PCR的灵敏度[35]。目前未见关于LAMP检测应用于香蕉细菌性枯萎病菌的报道。【本研究切入点】实时荧光LAMP技术是使用实时荧光扩增装置实时监测LAMP扩增产物并进行分析的方法,该方法比普通LAMP方法更为灵敏可靠,采用了不必在反应完开盖检测的方法,使反应产物不易被污染。早期检测中需要解决样品所含低含量及重干扰病菌组织的难题,而实时荧光LAMP能比较好地解决这一问题。【拟解决的关键问题】本实验拟建立该病菌的荧光LAMP检测体系,设计香蕉细菌性枯萎病菌的LAMP引物;以DNA为模板,在不同属内及其近似种间进行引物的特异性、灵敏度和重复性验证。
1 材料与方法
1.1 试验材料
1.1.1 供试病原菌 香蕉细菌性枯萎病菌Ralstonia solanacearum(race 2),RS2;烟草青枯病菌R. solanacearum(race 1),RS1;马铃薯青枯病菌R. solanacearum(race 3),RS3;丁香假单胞菌Pseudomonus syranguepv.syingae,PSS;苜蓿萎蔫病菌Clavibacter michiganensissubsp.insidiosus,CMI;玉米细菌性枯萎病菌Pantoea stewartiisubsp.stewartii,PS;梨火疫病菌Erwinia amylovora,EA;菜豆枯萎病菌Curtobacterium flaccumfacienspv.flaccumfaciens,CF,由中国检科院植检所赵文军研究员惠赠。
1.1.2 扩增仪器和试剂 扩增仪器采用ABI 7500实时荧光定量PCR仪,试剂盒采用广州迪奥生物科技有限公司DNA扩增试剂盒(恒温扩增法)。
1.1.3 引物合成 选择香蕉细菌性枯萎病菌的特异插入序列ISRso19序列,根据引物设计原则,使用PrimerExplorerV5在线设计外引物RS2-F3-2、RS2-B3-2, 内 引 物 RS2-FIP-2、RS2-BIP-2,其序列见表1,由广州生工生物技术工程股份有限公司合成。

表1 LAMP引物序列Table 1 Sequence of primers for LAMP
1.2 试验方法
1.2.1 DNA提取和浓度测量 所得菌种经浓度梯度划线分离、纯化后接种到NA平板上,800 mL裂解液中挑取细菌群落总数10个,进行DNA提取,定容至100 μL,即定容至100 CFU/mL。DNA提取采用Wizard Genomic DNA Purification Kit(Promega Corporation, Madison , WI ,USA),提取前用液氮充分研磨,提取后用Nano Drop1000型核酸微量测定仪(Thermo Fisher Scientific Inc.Waltham,MA,USA)测定核酸浓度。
1.2.2 实时荧光LAMP对RS2及其近似种特异性评价 反应扩增体系为:总量25 μL,含有DNA 2 μL,2×RM 反应母液 12.5 μL,5 μmol/L F3 引物1 μL,5 μmol/L B3 引物 1 μL,10 μmol/L FIP 引物1 μL,10 μmol/L BIP 引 物 1 μL,8 U/μL BstDNA酶 1 μL,荧光染料 0.5 μL,最后加入 20 μL 密封液。扩增参数为 63 ℃30 s、63 ℃ 15 s、63 ℃ 45 s,荧光收集阶段设置为60个循环。将8种待测菌种DNA分别配制反应体系溶液,同时设置阴性对照CK1~CK3与空白对照CK4,采用相同参数进行上机实验。每个处理3次重复。
1.2.3 实时荧光LAMP对不同浓度RS2灵敏度评价 样品DNA浓度梯度:将浓度为1 CFU/mL的RS2 DNA提取液按照10倍比依次系列稀释到10-7倍。将不同浓度DNA分别构建实时荧光LAMP反应体系,每个样品设3个平行反应,并设置阴性对照。反应体系组成与参数不变,利用ABI 7500型荧光定量PCR仪的自带软件进行结果分析,自动生成扩增曲线,根据所得曲线判断检测的阴阳性。若有“S”型扩增曲线,则检测结果判断为阳性(有核酸扩增);若无“S”型扩增曲线,结果则判断为阴性(无核酸扩增)。每个处理3次重复。
1.2.4 实时荧光LAMP对RS2重复性评价 重复性实验采用的DNA模板浓度为1 CFU/mL,每个反应体系的模板DNA加入量均为2 μL,重复组数设置为4个,设置阴性对照与空白对照。实验采用同一批模板DNA,每个处理3次重复。

图1 实时荧光LAMP对RS2及其近似种特异性检测结果Fig. 1 Results of specificity of real-time fluorescence LAMP detection to RS2 and allied species
2 结果与分析
2.1 实时荧光LAMP对RS2及其近似种特异性评价
实时荧光LAMP检测结果(图1)表明,1号样品(RS2)出现明显扩增信号且曲线平滑,其余样品均未出现扩增信号。故特异性实验证明荧光LAMP体系能够明显区分RS2与RS1、RS3、PSS、CMI、PS、EA、CF等近似种,并证明所选的靶基因与所设计的引物适配与香蕉细菌性枯萎病菌的定性检测实验。
2.2 实时荧光LAMP对不同浓度RS2灵敏度评价
目标菌株(RS2)DNA系列浓度的荧光LAMP结果(图2)表明,RS2菌株DNA在1、10-1、10-2CFU/mL 3个稀释浓度都得到阳性结果,而10-3到10-7的稀释浓度得到的是阴性结果的线条,故实时荧光LAMP检测RS2的DNA灵敏度可达10-2稀释度,即浓度为0.01 CFU/mL。经核酸微量测定仪的测定,所提RS2菌株DNA原液浓度为 70.2 ng/μL,10-2稀释浓度为 0.702 ng/μL。
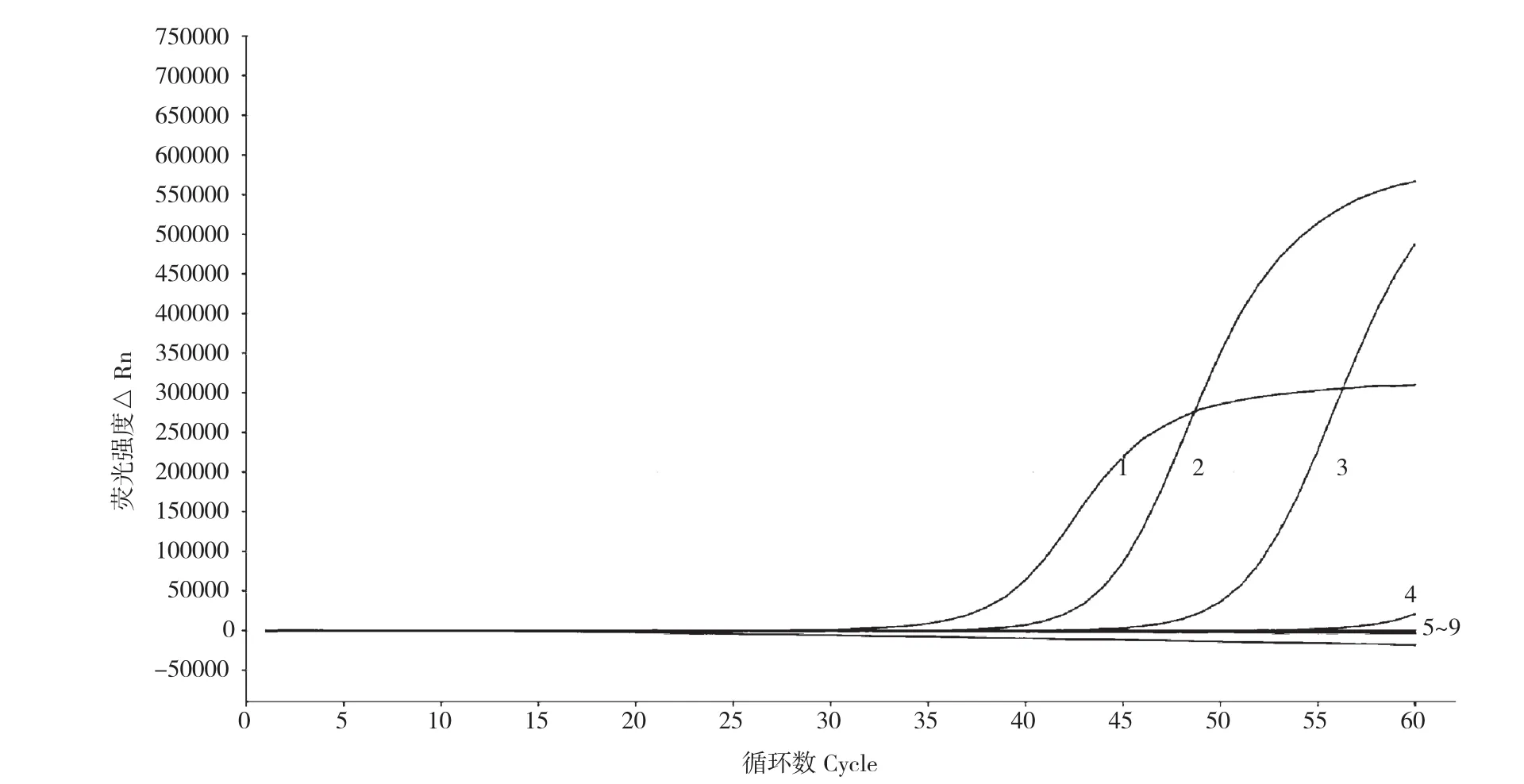
图2 实时荧光LAMP对不同浓度RS2菌DNA灵敏度检测结果Fig. 2 Results of sensitivity of real-time fluorescence LAMP detection to DNA of RS2 with different concentrations
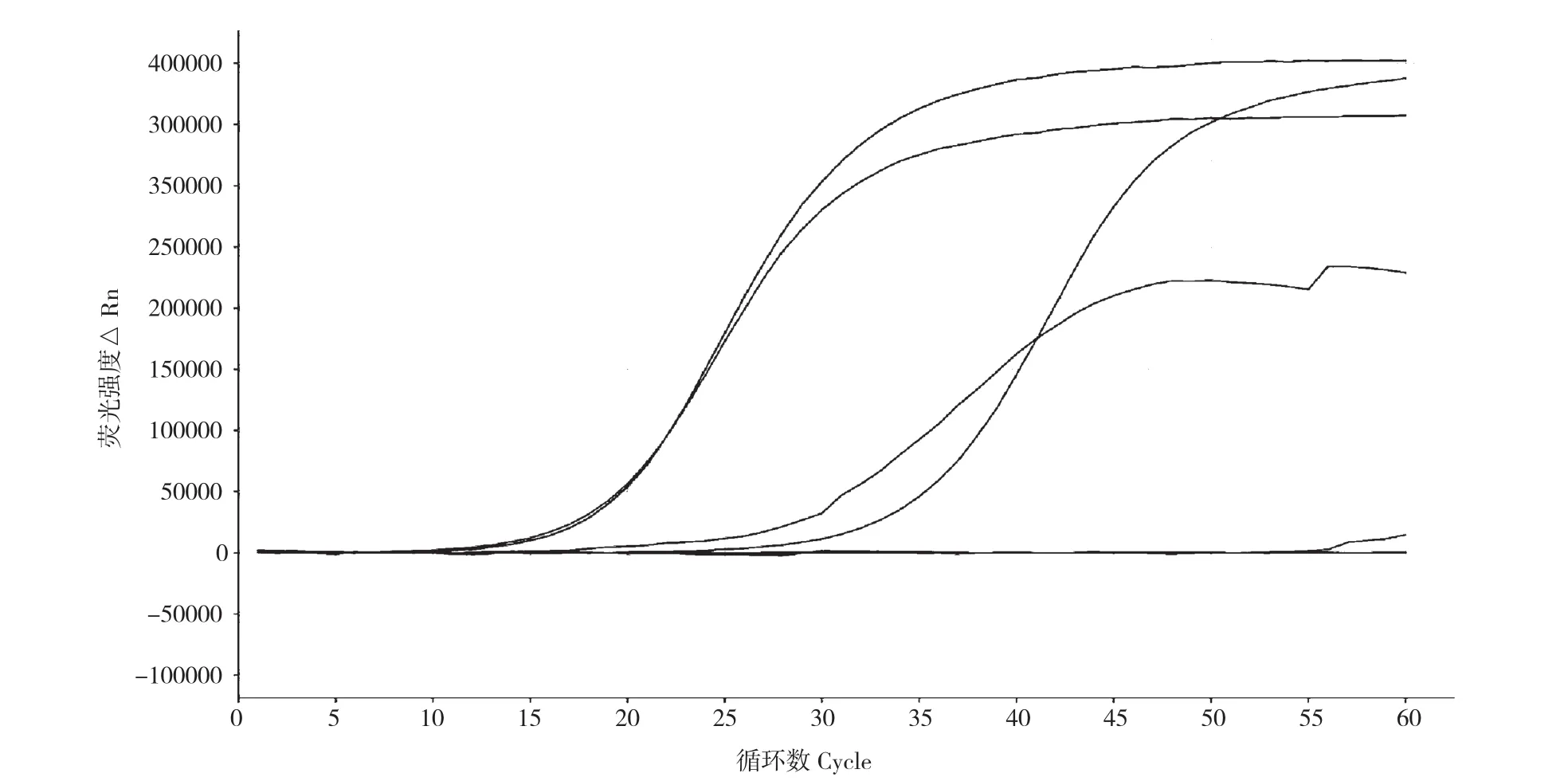
图3 实时荧光LAMP对RS2重复性检测结果Fig. 3 Results of repeatability of real-time fluorescent LAMP detection to RS2
2.3 实时荧光LAMP对RS2重复性评价
重复性实验结果(图3)表明,除阴性对照与空白对照外,样品组4个重复实验体系的检测结果都能出现“S”型曲线,说明本实验所建立的方法对RS2的DNA检测具有较高的重复性,结果稳定性好,实验方法可靠。
3 讨论
关于香蕉细菌性枯萎病菌的LAMP检测并未见报道,而LAMP方法作为一种新的快速检测手段在检测领域的应用越来越广泛,近几年来出现了井喷式的态势,并且陆续有一大批关于LAMP方法的行业标准发布。同样是在香蕉病原菌检测上,由真菌古巴尖胞镰刀菌引起的真菌性枯萎病,已经有LAMP检测的报道[33,36]。而实时荧光LAMP是在LAMP检测的基础上使用荧光信号检测仪器进行实时采集,免除了电泳过程,所使用的信号采集有浊度仪和实时荧光PCR仪等[37],其所使用的检测引物和普通LAMP检测使用的引物相同。本研究所设计的LAMP引物同样适用于普通LAMP检测,可以不使用大型的检测设备,而仅使用水浴锅和颜色终点判断进行野外快速初筛。但由于考虑到实验室内LAMP检测如果开盖电泳容易产生气溶胶污染,因气溶胶污染而导致的假阳性问题一直能够持续几周乃至几个月,属于实验室污染的重要事故,故而采用不必开盖的实时荧光LAMP方法,且同样该检测体系也可用浊度仪等设备进行检测信号采集。
本试验在开展特异性LAMP引物筛选时,尝试选用RS2的16SrDNA保守区序列作为目标序列进行引物的筛选设计,但经过多次尝试,所设引物并不能对RS2进行特异性区分,而且能扩增出所有的青枯菌。由此可以分析确证该菌命名时是先归类到青枯菌类,后划分至茄科劳尔氏菌,这一认知过程是基于该菌生理生化特征,并体现于其基因组序列。在细菌的分子生物学检测方法中,常用细菌16SrDNA保守区的碱基序列来设计引物,从而进行细菌种类的相关检测与鉴定。16SrDNA保守区使用于种间差别比较大的细菌间的区分,但对于香蕉性枯萎病菌来说,其相似的race型有5种,相似种及其相似race型的16SrDNA碱基序列几乎完全相同,故不能用作引物设计。
本试验在评价检测方法灵敏度时,采用目标病菌DNA为标准样品,并设置梯度稀释度进行分析。相比于王念武等[35]采用病菌的质粒DNA进行HRCA实验,采用破裂菌体所提的DNA在检测中受到其他物质的干扰会比较多,DNA的纯度一定程度上影响检测实验的灵敏度。从试验结果来看,本试验的灵敏度测试可达0.01 CFU/mL,经核酸含量测定仪测试为 702 pg/μL,而漆艳香等[34]采用实时荧光PCR法检测灵敏度为24.6 fg/μL,超分支滚环扩增更是能达500 fg/μL。故荧光LAMP法并不是最灵敏的检测方法,但其高效、稳定与不易污染的特点非常适用于青枯菌生理小种的定性检测,相比于传统LAMP与普通PCR还是具备一定优势。
本试验还发现,采用一系列稀释度的DNA检测灵敏度时,就其结果判断时,肉眼判断往往存在模棱两可的情况,尤其是在条带模糊不清的情况之下,而仪器判断就在此时显示了良好的分辨率和区分效果,荧光LAMP检测的灵敏度优于普通LAMP方法,与其他研究者的观点一致[12,38]。另外,本试验建立的方法可能并不是最灵敏的检测方法,但却更为稳定,不易污染;相比于传统LAMP方法和接种鉴定生理小种方法更为灵敏和高效。另外,在进行灵敏度测试时,发现不同浓度的模板检测结果显示“S”型曲线到达平台期的高度不同,说明最终的LAMP扩增产物积累量不同,扩增的效率有所不同,可能是扩增体系中初始量的极其细微差别造成的。初始极其细微的差别在经过LAMP扩增后所导致产物积累量的差别应当是逐步拉大的,且与出现平台期的早晚有直接关系。
4 结论
本研究使用了LAMP检测方法,该方法在香蕉细菌性枯萎病菌检测上尚未见报道。同时又结合实时荧光设备及技术,具有对目标序列的高特异性、重复性比较好的优点,较普通LAMP具有更高的灵敏度和更短的检测时间。采用实时荧光LAMP进行植物病原真菌的定性检测,具有比普通定性方法更灵敏且有效避免气溶胶污染的特点。这种LAMP进行定性检测方法在检测实践中应用广泛,在香蕉细菌性枯萎病菌初筛检测中的应用也发挥了该方法的优点,比普通PCR相比节约了检测成本,提高了检测效率。
本研究不足之处在于验证特异性的生理小种、专化型不够丰富,尤其对殴文氏菌属和黄单胞菌属等虽然经过网上序列比对,但若能够充分验证将会更好。
