高海拔地区传统牦牛酥油中抗氧化乳酸菌的筛选
2020-07-26李丹丹蒋婷婷
李丹丹 蒋婷婷 张 炎 罗 章
(1. 西藏农牧学院食品科学学院,西藏 林芝 860000;2. 甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
近年来,乳酸菌作为天然抗氧化剂,其缓解因氧化应激引发的各种疾病成为研究热点[1]。氧化应激即机体生成或清除自由基的能力失衡,导致机体氧化损伤,出现衰老或病变的现象[2],摄入外源性抗氧化剂是缓解机体氧化应激的重要途径[3]。经过长期的自然选择,西藏传统乳制品中富含优良的乳酸菌,蒋厚阳等[4]从西藏奶酪、酸奶中筛选得到12个乳酸菌菌种,验证了乳制品中乳酸菌的多样性。青藏高原严寒缺氧、强紫外辐射的恶劣环境胁迫机体长期处于氧化应激状态[5],近年来对西藏牦牛酸乳中抗氧化乳酸菌的研究较多,陈明等[6]从青藏高原牦牛酸乳中筛选出3株乳酸菌,对DPPH自由基、OH自由基及超氧阴离子自由基均有较高的清除力。由此表明,西藏传统乳制品中含有丰富的抗氧化乳酸菌。
牦牛酥油是藏区人民日常生活中必不可少的食物[7]。相较于牦牛酸乳中乳酸菌抗氧化活性的若干研究[8-9],对同为西藏传统牦牛乳制品的酥油中抗氧化乳酸菌的研究却未见报道,并且酥油低温加工的方式对乳酸菌的多样性具有保护作用。试验拟对采集自西藏高海拔地区牦牛酥油中的乳酸菌进行分离鉴定,筛选具备天然抗氧化发酵剂开发潜力的乳酸菌,以期丰富西藏牦牛酥油中乳酸菌的相关研究。
1 材料与方法
1.1 材料、试剂与培养基
西藏牦牛酥(样品详细信息见表1):采集自西藏地区;

表1 样品信息
细菌基因组DNA提取试剂盒:天根生化试剂公司;
MRS培养基(MRS固体培养基在MRS培养基基础上添加1.5%的琼脂;含7.5‰ CaCO3的MRS固体培养基是在MRS培养基基础上添加7.5‰CaCO3和1.5%的琼脂):北京奥博星生物技术有限责任公司;
DPPH无水乙醇溶液(0.2 mmol/L)、邻菲啰啉溶液(2.5 mmol/L)、pH 8.2 Tris-HCl(0.05 mol/L)、邻苯三酚(0.05 mol/L):上海源叶生物科技有限公司;
硫酸亚铁溶液(2.5 mmol/L)、pH 7.4磷酸缓冲液(PBS)、过氧化氢溶液(20 mmol/L):北京易秀博谷生物科技有限公司。
1.2 仪器与设备
紫外分光光度计:UV-1800型,上海美谱达仪器有限公司;
超声波破碎仪:JY88-IIN型,宁波新芝生物科技股份有限公司;
高速冷冻离心机:5810R型,德国Eppendorf公司;
PCR仪:BC-C57型,北京天林恒泰科技有限公司;
琼脂糖水平电泳仪:DYCP-31DN型,北京六一仪器厂;
凝胶成像系统:Tanon 1600型,上海天能科技有限公司。
1.3 方法
1.3.1 乳酸菌的分离与纯化 精确称取酥油样品5.00 g,置入装有45 mL生理盐水的无菌均质袋中,使用拍击式均质器拍打1~2 min(拍击速度6次/s)制成1∶9 (g/mL)的样品匀液。将梯度稀释后的样液在含有7.5‰ CaCO3的MRS固体培养基上均匀涂布,置于37 ℃培养箱中恒温培养48 h,选取有溶钙圈现象的单菌落进行镜检和革兰氏染色,将革兰氏阳性菌纯培养,置于-80 ℃保存备用[10]。
1.3.2 菌株分子生物学鉴定
(1) DNA提取:利用细菌DNA试剂盒提取分离得到的纯菌落菌株DNA。
(2) PCR扩增及测序:根据文献[11],修改如下:
PCR体系(25 μL):PCR Buffer 2.5 μL,d NTP 2 μL,DNA 模板1 μL,Taq酶0.3 μL,上游引物1 μL,下游引物1 μL,用超纯水定容至25 μL,备用。
PCR扩增条件:95 ℃预变性3 min,95 ℃变性45 s,50 ℃退火30 s,72 ℃延伸35 s(40次循环),最后72 ℃延伸5 min。
(3) 序列分析:利用Nucleotide Blast对比分析测序结果。
1.3.3 乳酸菌的耐酸性测定 将-80 ℃保存菌株以2%接种量接种于MRS液体培养基中,37 ℃培养16 h,获得试验菌株。调整其细胞浓度为1×108CFU/mL,以体积分数3%的接种量分别接种于初始pH为2.0,3.0,4.0,5.0,6.0的MRS液体培养基中,37 ℃培养16 h,测其不同pH值下600 nm处的OD值[12]。
1.3.4 乳酸菌耐过氧化氢性能测定 将-80 ℃保存菌株以2%接种量接种于MRS液体培养基中,37 ℃培养16 h,获得试验菌株。调整其细胞浓度为1×108CFU/mL,以体积分数1%的接种量分别接种于初始H2O2浓度为0.0,1.0,2.0,3.0 mmol/L的MRS液体培养基中,37 ℃培养8 h,测其不同H2O2浓度下600 nm处的OD值[13]。
1.3.5 菌株抗氧化能力的复筛 吸取15 mL试验菌株培养液与15 mL PBS缓冲液(pH 7.4)旋涡混匀,离心(4 ℃,5 000 r/min,10 min)洗涤3次,制得菌悬液,调整细胞浓度至109CFU/mL。将调整好细胞浓度的菌悬液平均分为两份,其中一份菌悬液为乳酸菌完整细胞组,将另一份菌悬液利用超声波破碎仪(变幅杆Φ6 mm,超声开1 s,超声关1 s,功率33%)冰浴破碎处理,取上清,即无细胞提取物。
(1) DPPH自由基清除力试验方法:根据文献[14],取1 mL待测样品(完整细胞组和无细胞提取物组),加入1 mL DPPH无水乙醇溶液(0.2 mmol/L),充分混匀后,室温下避光静置30 min,6 000 r/min 离心10 min。取上清液,517 nm下测定吸光度记录数值为A。用1 mL 无水乙醇代替1 mL待测样品,测定吸光度值为A0。用1 mL 无水乙醇代替1 mL DPPH无水乙醇溶液,测定吸光度值为A1。按式(1)计算DPPH自由基清除率。

(1)
式中:
X——DPPH自由基清除率,%;
A——样品组吸光度;
A0——对照组吸光度;
A1——空白组吸光度。
(2) OH自由基清除力试验方法:根据文献[15],取1 mL邻菲啰啉溶液(2.5 mmol/L),依次加入1 mL PBS缓冲液(pH=7.4),1 mL待测样品(完整细胞组和无细胞提取物组),充分混匀后加入1 mL硫酸亚铁溶液(2.5 mmol/L),混匀,加入1 mL过氧化氢溶液(20 mmol/L),37 ℃恒温水浴1.5 h,536 nm下测定吸光度记录数值为A1。用1 mL蒸馏水代替1 mL过氧化氢溶液,测定吸光度值记录为A0。用1 mL蒸馏水代替1 mL待测样品,测定吸光度值记录为A2。按式(2)计算OH自由基清除率。

(2)
式中:
X——OH自由基清除率,%;
A0——空白组吸光度;
A1——样品组吸光度;
A2——对照组吸光度。
(3) 超氧阴离子自由基清除力试验方法:根据文献[16],取0.1 mL待测样品(完整细胞组和无细胞提取物组),加入4.5 mL Tris-HCl缓冲液(pH 8.0),充分混合均匀后,置于25 ℃水浴预热20 min,加入0.4 mL邻苯三酚(25 mmol/L),再次于25 ℃水浴5 min后,立即滴入2滴HCl(8 mol/L)用以终止反应,320 nm下测定吸光度记录数值为A。用0.1 mL蒸馏水代替0.1 mL待测样品,测定吸光度值记录为A0。按式(3)计算超氧阴离子自由基清除率。
(3)
式中:
X——超氧阴离子自由基清除率,%;
A0——空白组吸光度;
A——样品组吸光度。
2 结果与分析
2.1 菌株的分离和初步鉴定结果
利用溶钙圈法从样品中分离得到61株菌株,对纯菌株进行革兰氏染色、镜检,菌株菌落形态为直径0.7~3.0 mm、圆形或椭圆形、白色或乳白色、湿润、突起或微隆起、边缘整齐;革兰氏染色无芽孢、均为阳性,溶钙圈为阳性;检出多为长杆状或短杆状,符合乳酸菌的特征。部分微生物菌落形态如图1所示。
图1 部分微生物的菌落形态
2.2 菌株分子生物学鉴定结果及系统发育分析
采用试剂盒法分离得到的单菌落纯菌株的DNA,部分纯菌株凝胶电泳图如图2所示。分离得到的61株菌株的电泳条带长度均在1 500~1 750 bp,符合细菌电泳条带长度要求。

M. DL5000 DNA Marker 1~7. 分别代表不同菌株
将61株菌株测序结果利用NCBI中的NucleotideBlast数据库进行比对分析。鉴定结果表明,从牦牛酥油中分离得到的61株菌分属乳酸菌属的7个种,其中副干酪乳杆菌亚种(Lactobacillusparacaseisubsp.tolerans)9株;副干酪乳杆菌(Lactobacillusparacasei) 26株;植物乳杆菌(Lactobacillusplantarum) 21株;德氏乳杆菌(Lactobacillusdelbrueckii) 3株;鼠李糖乳杆菌(Lactobacillusrhamnosus) 2株。菌株同源性均为99%。
将菌株测序结果,利用Mega 7.0软件构建菌株系统发育树如图3所示。由图3可知,菌株A4和B5,C10、C19和C20,D1、D2和D3等遗传距离较近,表明这些菌株的亲缘关系比较接近,而其他菌株的遗传距离较远,说明这些菌株之间差异较大。此外,通过系统发育树验证西藏牦牛酥油中乳酸菌的多样性。

图3 牦牛酥油中微生物的系统发育树
2.3 菌株耐受性试验初筛
2.3.1 菌株耐酸性试验 乳酸菌耐低酸特性是其发挥抗氧化作用的重要前提[17]。对分离得到的61株乳酸菌进行耐酸性试验,筛选出耐酸性能较好的16株乳酸菌,这16株乳酸菌在不同酸性条件下的生长情况见表2。
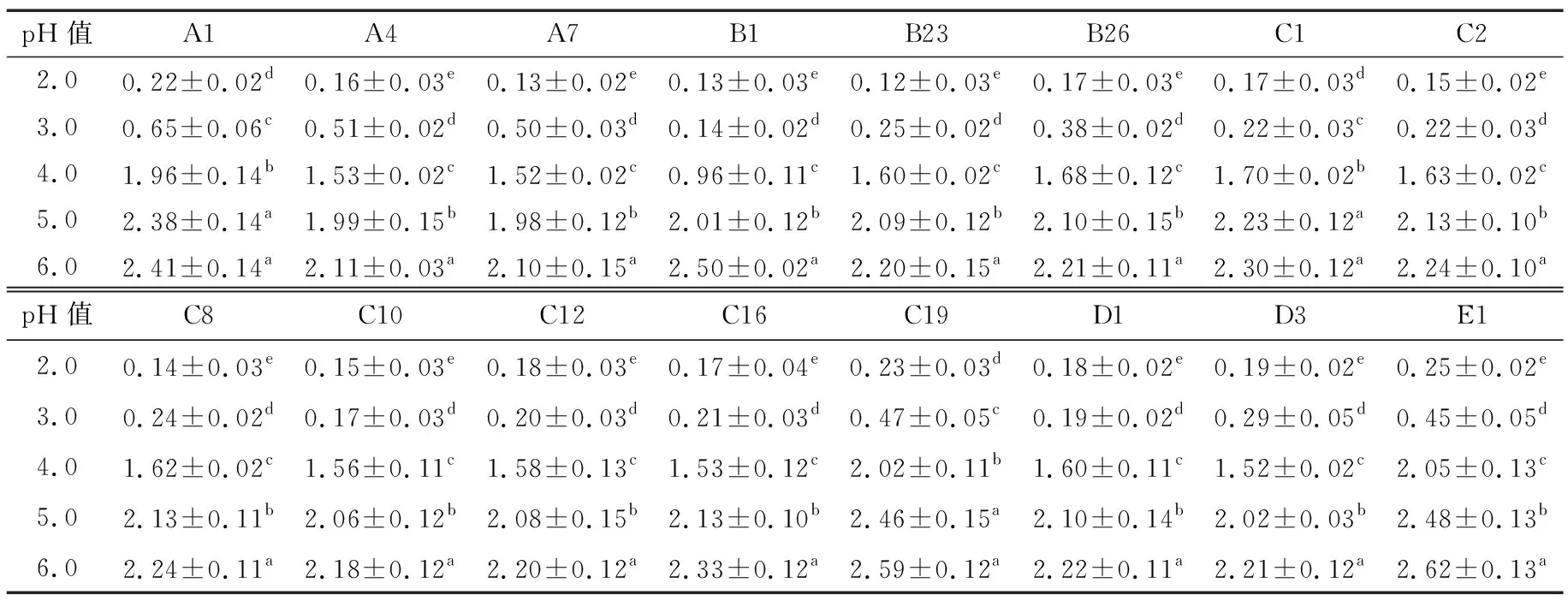
表2 初始 pH 对菌株生长的影响†
由表2可知,当培养基初始pH为5.0和6.0时,菌株OD值均较高,表示pH 5.0~6.0的培养基环境适宜菌株生长。其中E1和C19在pH 6.0时活性最高,OD600 nm分别为2.62和2.59。pH为5.0时,E1和C19的OD600 nm分别为2.48和2.46,活性仍然高于其他菌株。pH为4.0时,16株乳酸菌活性显著降低,OD600 nm均在0.96以上,其中A1、C19和E1活性较好,OD600 nm均在1.90以上。pH为3.0时,虽然其生长活性受到了抑制,但16株乳酸菌仍然可以生长,pH为2.0时,全部菌株无法正常生长。经过耐酸性试验筛选后发现:从西藏牦牛酥油中分离得到的61株乳酸菌中,有16株对低酸环境具有较好的耐受性,可进入下一阶段试验。
2.3.2 菌株耐过氧化氢试验 对上述16株乳酸菌进行不同H2O2浓度的耐受性试验,筛选得到7株H2O2耐受能力较好的乳酸菌,这7株乳酸菌在不同H2O2浓度下的生长情况见表3。

表3 过氧化氢对菌株生长的影响†
由表3可知,H2O2浓度变化对乳酸菌的生长产生显著性影响。当H2O2浓度为3 mmol/L时,7株乳酸菌均无法正常生长。当H2O2浓度为2 mmol/L时,5株乳酸菌生长情况较优,OD600 nm平均值为1.90,其中A1生长情况最好,OD600 nm为2.04。当H2O2浓度为0,1 mmol/L时,乳酸菌生长情况普遍较好且差异不显著,7株乳酸菌OD600 nm平均值分别为2.29,2.20。经过耐H2O2试验筛选后,发现从西藏牦牛酥油中分离得到的16株耐低酸的乳酸菌中有7株对H2O2有较好的耐受性。对这7株乳酸菌的抗氧化性能进行研究,以期找到具有较好抗氧化性能的乳酸菌,为乳酸菌天然抗氧化发酵剂的研究提供基础。
2.4 菌株抗氧化试验复筛
2.4.1 清除DPPH自由基能力 由图4可知,大多数乳酸菌的完整细胞组的DPPH自由基清除率大于无细胞提取物组,但也有部分乳酸菌的无细胞提取物组的DPPH自由基清除率反而更高。说明每株乳酸菌完整细胞组和无细胞提取物组的DPPH自由基清除率无对应关系,即受试乳酸菌清除DPPH自由基的活性物质存在于细胞的不同部位。完整细胞组的DPPH清除率平均达到15.59%,其中A1和C19两株乳酸菌DPPH自由基清除率较高,均为18.68%。无细胞提取物组的DPPH自由基清除率平均为16.18%,虽然平均值低于完整细胞组,但是C19的清除率最高为30.84%。吴石金等[12]分离得到的34株乳酸菌其DPPH自由基清除率最高不超过30%。针对DPPH自由基清除率对7株乳酸菌进行筛选,C19表现最优。

字母不同表示差异显著(P<0.05)
2.4.2 清除OH自由基能力 由图5可知,与乳酸菌DPPH自由基清除率表现相似,菌株完整细胞组和无细胞提取物组的OH自由基清除率无对应关系,即说明受试乳酸菌清除OH自由基的活性物质存在于细胞的不同部位,而非仅存在于细胞内或细胞外。7株乳酸菌完整细胞组和无细胞提取物组OH自由基清除率之间差异显著。完整细胞组平均清除率达到28.71%,其中E1的自由基清除率最高为47.87%,A1的自由基清除率最低仅为8.08%。

字母不同表示差异显著(P<0.05)
无细胞提取物组的自由基平均清除率为33.87%,其中E1的清除率最高为57.60%,C19的OH自由基清除率最低仅为11.46%。7株乳酸菌中E1的清除率最高为57.60%。刘亚东等[18]对从西藏曲拉、发酵乳中分离得到的23株乳酸菌OH自由基清除率进行测定,最高仅有27.62%,远低于试验所得菌株。Ding等[19]对从青藏高原牛乳中分离得到的菌株进行OH自由基清除率检测,最高为59.00%,相较之下,试验筛选得到的乳酸菌OH自由基清除率略低。针对OH自由基清除率对7株乳酸菌进行筛选,E1表现最优。
字母不同表示差异显著(P<0.05)
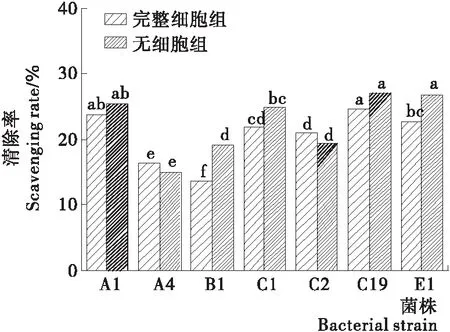
2.4.3 清除超氧阴离子自由基能力 由图6可知,受试乳酸菌清除超氧阴离子自由基的活性物质存在于细胞的不同部位。7株乳酸菌完整细胞组和无细胞提取物组的超氧阴离子清除率差异显著。完整细胞组超氧阴离子自由基平均清除率达到20.57%,其中C19的超氧阴离子的清除率最高为24.59%。无细胞提取物组的超氧阴离子自由平均清除率达到22.50%,其中C19的超氧阴离子的清除率最高为26.91%。刘珊春等[20]对18株乳酸菌的超氧阴离子自由基清除率进行测定,最高为28.78%。相较之下,试验筛选得到的乳酸菌虽然超氧阴离子自由基清除率略低。针对超氧阴离子自由基清除率对7株乳酸菌进行筛选,C19表现最优。
3 结论
对采集自西藏不同海拔的牦牛酥油进行菌株分离,共得到61株菌株,经分子生物学鉴定分别为:副干酪乳杆菌亚种(L.paracaseisubsp.tolerans) 9株;副干酪乳杆菌(L.paracasei) 26株;植物乳杆菌(L.plantarum) 21株;德氏乳杆菌(L.delbrueckii) 3株;鼠李糖乳杆菌(L.rhamnosus) 2株。
通过乳酸菌耐受性试验得到7株既耐低酸环境又对H2O2具有较好耐受性的乳酸菌,分别为A1、A4、B1、C1、C2、C19、E1。对7株乳酸菌的抗氧化性能分析发现,菌株的DPPH自由基、OH自由基和超氧阴离子自由基清除率无对应关系。C19的DPPH自由基清除力和超氧阴离子自由基清除力最优,分别为30.84%和26.91%,E1的OH自由基清除力最优,为57.60%。此外,C19和E1两株乳酸菌分别来自拉萨市当雄县[海拔(4 250±50) m]和拉萨市堆龙德庆区[海拔(3 790±50) m]的酥油样品中,研究发现,并非海拔越高乳酸菌的抗氧化活性越强。试验得到的C19(L.plantarum)和E1(L.rhamnosus)两株乳酸菌具备天然抗氧化发酵剂的开发潜力。
