金枪鱼骨胶原多肽螯合钙的制备
2020-07-24周小敏郑万源李澄
周小敏,郑万源,李澄
浙江兴业集团有限公司(舟山 316000)
金枪鱼为鲈形目(Pereiformes)鲭科(Scombridae),属大洋洄游鱼类[1],是世界重要远洋捕捞对象,据联合国粮农组织统计[2],金枪鱼年捕获量超6×106t[3]。我国金枪鱼捕捞量也逐年上升,已形成较为完整的加工产业链。
金枪鱼加工过程会产生超总质量10%的鱼骨,这类资源通常被丢弃,既浪费宝贵资源,又污染环境。鱼骨富含钙和胶原蛋白[4],且同陆生动物相比,这类胶原蛋白生物活性更强、抗原性更弱,赋予其良好的生物相容性,可广泛用于美容、烧伤烫伤等医疗领域[5-8]。
缺钙是人类共同的营养疾病,在亚洲地区尤为突出[9-10]。当前国内外钙补充剂包括无机钙和有机钙。这两种钙源普遍存在吸收率低、易引发受体机体紊乱等问题[11-13]。而随着营养学的进步,关于钙的吸收出现了新的理论[14],诸多研究发现动物体内存在独特的生物肽转运体系,能够完整吸收金属和肽的螯合物。在这一理论指导下,诸多学者通过螯合技术制备了钙螯合肽,在给机体补充蛋白的同时,也实现了矿物元素的高效吸收[15],给这类副产物的高值化利用提供了借鉴。
研究通过将下脚料鱼骨经酶解脱肉后碱法去脂,干燥成粉;经酶解后其酶解液与氯化钙进行螯合制备螯合钙,通过正交试验等手段确定金枪鱼骨的最佳酶解工艺和螯合工艺,为金枪鱼骨这类副产物的高值化利用提供借鉴,同时有望开发一款新型的钙补充剂。
1材料与方法
1.1 材料与试剂
金枪鱼骨由浙江兴业集团有限公司提供;Gly-Gly-Tyr-Arg(Sigma公司);氢氧化钠等均为分析纯,均购于国药集团上海公司。
1.2 仪器与设备
高效液相色谱仪(安捷伦);ELX808酶标仪(美国伯腾);Nicolet6700傅里叶红外光谱(美国Thermo Nicolet公司);原子吸收光谱仪(日本岛津);高分辨场发射透射电子显微镜(Tecnai G2 F20S-TWIN,美国FEI);纳米粒度表面电位分析仪(Nano-ZS90,Malvern英国马尔文仪器有限公司)。
1.3 试验方法
1.3.1 金枪鱼骨粉的制备工艺
将500 g金枪鱼骨下脚料掰开成3~4节的小段,加入10倍体积水,随后加入1‰胰蛋白酶+1‰风味蛋白酶于55 ℃水浴锅中酶解2 h(搅拌器500 r/min),
灭酶活后用清水将鱼骨冲洗干净,加入鱼骨量5%的NaOH,于40 ℃水浴中浸泡2 h,清水洗净后烘干打粉即制得鱼骨粉(过40目筛)。
1.3.2 金枪鱼骨胶原多肽制备工艺(参见图1)
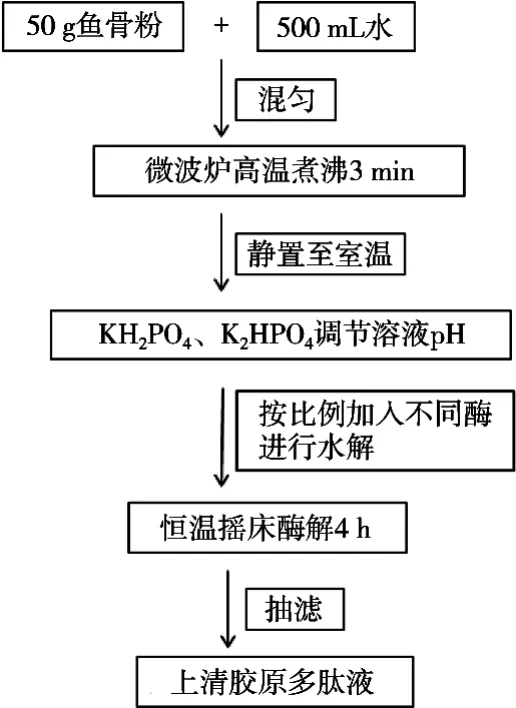
图1 金枪鱼骨胶原多肽制备工艺图
1.3.3 胶原多肽浓度的测定[16]
精确量取2.5 mL样品,加入2.5 mL 10 g/100 mL的三氯乙酸(TCA)后振荡混合,静置10 min,离心15 min(4 000 r/min),取上清液至50 mL容量瓶中,以5% TCA定容;量取6.0 mL该溶液于试管中,加入4.0 mL配制好的双缩脲溶液,混合振荡后静置10 min,2 000 r/min离心10 min,取上清液并测定上清液OD值(540 nm),对照标准曲线确定多肽含量。同时制作标准曲线。
1.3.4 螯合试验流程(参见图2)

图2 螯合试验流程图

式中:mb和ma分别表示反应前后体系中钙的质量,mg。
1.3.5 胶原多肽分子量的测定[17]
色谱条件:色谱柱TsK gel 2000 SWXL 300 mm×7.8 mm,流动相为乙腈-水-三氟乙酸(30∶70∶0.1,体积比)。
样品制备:以乙腈为溶剂配制浓度为5.00 mg/mL的样品,样品进样前用孔径为0.45 μm的微孔滤膜过滤。
标准品准备:标准品为牛血清蛋白(Mr66430)、RNase A(Mr13700)、抑肽酶(Mr6500)、维生素B12(Mr1355)、庆大霉素(Mr576),将标准品配制成混合标准溶液,每种物质含量均为5.00 mg/mL。
1.3.6 傅里叶红外光谱(FT-IR)分析
红外光谱分析的扫描波长范围为4 000~500 cm-1,所得数据利用Origin 7.0软件进行处理。
1.3.7 螯合肽投射电镜表征分析
样品先进行真空冷冻干燥,而后取适量样品溶解于乙醇中并超声处理10 min,后用滴管取适量样品上样于铜网,待乙醇挥发后,用透射电镜对螯合肽进行观测并拍照。
1.3.8 螯合肽粒度分析
用纯水为溶剂,溶解适量样品后,利用表面电位分析仪测定悬浮样品粒度。
2 结果与讨论
2.1 金枪鱼骨胶原多肽制备最佳酶解条件的确定
金枪鱼骨粉酶解单因素试验的基本条件为料液比1∶3(g/mL)、起始pH 7.0、酶解温度55 ℃、试验用酶添加比例1∶1、酶解时长4 h。各试验因素水平分别为:pH 6.0,6.5,7.0,7.5和8.0;温度45,50,55,60和65 ℃;酶制剂的复合比(某蛋白酶与风味蛋白酶质量比)1∶3,1∶2,1∶1,2∶1和3∶1。每个水平重复2次,结果取平均值。
2.1.1 水解酶类的确定
表1是不同酶制剂对骨粉的水解结果。从表1中可知,胰蛋白酶+风味蛋白酶复合水解所得的胶原多肽浓度最高且分子量小于4 000 Da胶原多肽占比最大,故综合选择第1组即胰蛋白酶+风味蛋白酶(FM)复合水解金枪鱼骨粉制备骨胶原多肽。
2.1.2 水解起始pH的确定
选用胰蛋白酶与风味蛋白酶质量比1∶1进行酶解,继续后续试验,改变起始pH,测定胶原多肽浓度。
如表2所示,胶原多肽的浓度同pH呈正相关关系,当pH为7.0~7.5时,胶原多肽浓度最高,而后胶原多肽浓度随pH增大反而降低。这是由于在较高和较低的pH下,生物活性酶的分子构象发生变化,其催化活性降低[18];在生物酶的最佳pH条件下,酶的化学反应速度达到顶峰,反之,pH距离其最佳pH越远,催化活性越低。因此选择pH为7进行后续的试验。

表2 酶解pH对多肽浓度的影响
2.1.3 胰蛋白酶与风味蛋白酶复合比的确定
将胰蛋白酶与风味蛋白酶进行表3所示的比例进行复合酶解,测定胶原多肽浓度。如表3所示,胰蛋白酶与风味蛋白酶复配比2∶1时,多肽浓度最高,随着风味蛋白酶比例增多,多肽浓度降低,因此选择复配比2∶1进行后续试验。

表3 生物酶比例对多肽浓度的影响
2.1.4 酶解温度的确定
不同酶解温度得到的胶原多肽浓度也不同,分别在表4所示温度下进行酶解,测定胶原多肽浓度。
如表4所示,随着温度的升高,胶原多肽浓度随之升高,60 ℃时多肽浓度最高,这是因为温度也是影响酶活性的重要因素,温度过高同样会影响酶的空间构象,进而影响酶的生物催化能力,严重时会造成酶的失活。因此选择60 ℃进行后续的试验。
综上所述,金枪鱼骨粉酶解的最适条件为:料液比1∶3(g/mL)、起始pH 7.0、酶解温度60 ℃、2种酶复配比2∶1、酶解时间4 h。
2.2 最佳螯合条件的确定
骨胶原多肽与氯化钙螯合的单因素试验的基本条件为:温度50 ℃、螯合时间40 min、pH 6.0、胶原蛋白与氯化钙质量比1∶1。改变其中1个条件,固定其他条件以分析各单因素对螯合率的影响。各因素水平为:温度40,45,50,55和60 ℃;螯合时间30,40,50和60 min;pH 5.0,5.5,6.0,6.5和7.0;质量比3∶1,2∶1,1∶1,1∶2和1∶3。每个水平重复2次,结果取平均值。
2.2.1 螯合温度对螯合率的影响
螯合率结果如表5所示。螯合率同温度呈较为典型的峰状,以55 ℃为反应峰值,低于该温度时,螯合率随温度上升而增加,高于该温度时,螯合率随温度增加而降低,表明温度过高不利于螯合物的形成。由此确定55 ℃为最适螯合温度。

表4 酶解温度对多肽浓度的影响

表5 螯合温度对螯合率的影响
2.2.2 螯合时间对螯合率的影响
改变螯合时间,测定螯合率,结果如表6所示。螯合率随螯合时间增加而增加,当40 min后螯合率达到最大且保持稳定,表明40 min为最佳螯合时间。有研究表明:反应时间过长反而会导致螯合物释放矿物元素,发生解螯合效应[22-23],故螯合时间不应过长。由此确定反应时间为40 min。

表6 螯合时间对螯合率的影响
2.2.3 起始pH对螯合率的影响
反应起始pH对螯合率的影响如表7所示。随着pH的增加,螯合率也随之增加,在pH为6.0时螯合率达到最大,随后螯合率反而下降。这是由于在pH较低条件下,氢离子同钙离子存在竞争关系,抢夺供电基团,阻碍螯合肽形成[24],反之,当pH较高时,溶液中羟基基团又会形成不溶的氢氧化钙[25]。由此确定pH 6.0为最适pH。
2.2.4 肽钙比对螯合率的影响
螯合反应所加入的胶原多肽与氯化钙质量比对螯合率有显著影响。如表8所示,随着肽钙比的增加,螯合率也随之增加,当肽钙比为1∶1时螯合率达到最大值,继续增加肽钙比,螯合率不再增加。这是由于配位比对螯合率影响较为显著,不合适的料液比使得螯合物的供体数量不平衡,造成原料浪费,增加成本。由此确定1∶1为最适螯合比例。
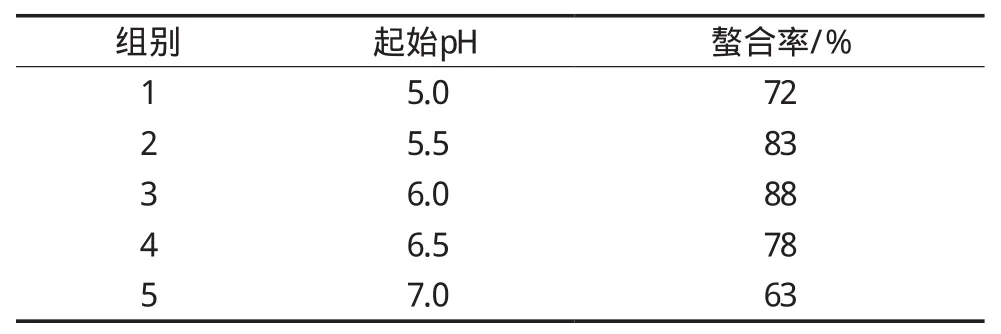
表7 起始pH对螯合率的影响

表8 不同肽钙比对螯合率的影响
2.3 螯合肽的透射电镜结果
图3是金枪鱼骨胶原螯合肽在不同倍数下的透射电镜图。从图3中可知,大多数螯合肽虽个体较小(微米级别),但能清晰分辨。此外,研究还发现螯合肽的微结构同其分子量相关(图4),分子量过大则难以顺利螯合。这可能是由于部分活性肽存在侧链,对螯合具有一定的阻碍效应,使得活性肽无法顺利螯合钙离子。
2.4 螯合肽的粒度分析
图5是金枪鱼骨胶原螯合肽的粒径和数量的关系。在最佳螯合工艺条件下制备的螯合肽的粒径分布范围较窄,大部分螯合肽直径均低于1 μm,其中90%以上的螯合肽粒径分布范围为0.5~0.7 μm;螯合物粒径是其能否被吸收的关键。研究制备的螯合肽颗粒为微米级,不仅粒度小,而且具有较强乳化潜力,可完美融入各种食品体系中,赋予其优良的加工特性,为其在食品加工中的应用奠定了基础。

图3 金枪鱼骨胶原螯合肽在不同倍数下的透射电镜图(分子量约4 000 Da)

图4 金枪鱼骨胶原螯合肽在不同倍数下的透射电镜图(分子量约10 000 Da)

图5 螯合肽粒径与数量的关系
3 结论
结果显示,金枪鱼骨粉最佳酶解条件为:胰蛋白酶与风味蛋白酶复合比2∶1、pH 7.0、温度60 ℃。此时酶解鱼骨粉所得的胶原多肽含量最高。最佳螯合条件为:pH 6.0、螯合温度55 ℃、螯合时间40 min、胶原多肽与氯化钙质量比1∶1。此时螯合率最高,胶原多肽利用率也最高;此条件下制备的金枪鱼骨胶原螯合肽呈均匀的颗粒状分布,粒径分布范围0.5~0.7 μm,赋予其良好的食品加工特性。
