L型细菌与抗生素耐药
2020-07-24陈代杰
刘 蔷, 杨 萍, 卢 明, 陈代杰
L型细菌是一种细菌细胞壁形成受到抑制的特殊生长形式,可在体内自发形成。本综述主要阐述L型细菌与感染及其耐药机制。
1 L型细菌与感染
L型细菌的基本形状是球形的,但具有高度的可塑性,可在周围环境的影响下呈现出一系列不规则的形状。L型细菌在1935年由Klieneberger[1]在研究杆状革兰阴性菌莫尼链球菌时首次发现,并以其当时工作的李斯特菌研究所(Lister Institute)命名[2]。
许多细菌都能形成L型,如枯草芽孢杆菌、博氏疏螺旋体(Borrelia burgdorferi)[3]等。自20世纪40年代起,L型细菌与一系列传染病的联系已有大量研究[4-6],大多数研究主要集中于泌尿系统、心血管系统和中枢神经系统感染。不少文献也报道了呼吸道、胃肠道、表皮和生殖系统感染。
人肾髓质呈高渗生理环境[7]。此外,在泌尿系统细菌感染的患者中,尿液的渗透压通常高于健康人[8]。因此,许多研究集中于L型细菌在复发性尿路感染(urinary tract infection, rUTI)中的重要性及导致疾病的可能性。
根据L型细菌可通过0.45 mm滤过器,而有壁细菌无法滤过的原理,研究者可从尿液或肾脏中分离出两种L型细菌,将过滤后的样品接种于有或无渗透保护的培养基中,并进行长时间的培养。采用这种方法,20世纪60年代的研究者们从泌尿系统感染患者中成功分离出L型细菌[9-12]。
Domingue[4]综述了20世纪60-80年代一系列的研究,这些研究通过显微镜方法对患有肾脏疾病和尿路感染患者的尿液和血液中的细菌结构进行了检测。利用人类胚胎肾成纤维细胞(HEK)和感染大肠埃希菌、奇异变形杆菌或大肠埃希菌L型的无菌动物,研究L型细菌在宿主组织中的存活能力,提出宿主细胞中小的、电子密度高的、非泡状的形式是细菌持留性的关键所在。Wittler等[13]在使用抗生素治疗的亚急性心内膜炎患者的血液中也检测到小颗粒状的形式。颗粒在渗透保护介质中呈L型生长,随后又回复到有壁杆菌。Almenoff等[14]从20例结节病患者中19例的血液标本中分离出L型结核分枝杆菌,而健康对照组的血液中没有生长。对慢性葡萄球菌感染、布鲁菌病以及A群链球菌引起的风湿热患者进行了相似的研究 [15- 19]。
20世纪早期的科学研究表明,引起rUTI的细菌可以通过采取细胞壁缺陷型或L型状态幸存于细胞壁特异性抗生素的治疗中。但由于缺乏分子诊断工具,这些研究难以令人信服[20]。而且,由于常规的微生物培养基是低渗的,并且不支持L型生长,因此L型细菌在临床中几乎被完全忽略。近期Mickiewicz等[21]发现在30例rUTI老年患者中29例的新鲜尿液中存在L型细菌。从rUTI患者中分离出的L 型细菌可以在有磷霉素的情况下在尿液中存活,并且在停用抗生素后能够再生其细胞壁。同样在斑马鱼幼虫感染模型中也能发现同样的转换。Rojas等[22]发现,革兰阴性细菌外膜对细胞的机械稳定性起了重要作用,这也许可以解释为何L型细菌可在尿液中存活。
Beaman等[23-28]报道L型诺卡菌在疾病中可能的作用,发现在一个小鼠模型中的L型诺卡菌是从有壁细菌转变而来。L型参与了持留性以及慢性肌瘤特征性颗粒的发展。有趣的是,L型细菌仅在免疫功能强的小鼠身上观察到,而免疫系统不全(无脾无胸腺)的小鼠则不能检测到,这表明体内免疫系统对L型细菌有诱导作用。此外,他们成功地使用渗透保护型培养基从1例后来死于脑脓肿患者的脑脊液中分离出了多个L型细菌。且重要的是在无渗透保护的情况下培养时,并没有观察到任何细菌生长,提示L型是患者脑脊液中诺卡菌的主要或唯一的变异。其他研究也在寻找L型细菌与中枢神经系统慢性感染之间的联系,但结果并没有定 论。
Zhang等[29]对62例合并糖尿病的结核病痰涂片阳性患者和89例非糖尿病结核病患者进行回顾性分析,发现在这62例研究对象中,46.77%结核分枝杆菌L(MTB-L)型呈阳性。糖尿病合并肺结核患者的耐药性明显高于单纯肺结核患者,因此在确定结核病治愈的细菌学证据时,应更严格地测试MTB-L型涂片染色检查。
Akimoto等[30]在结节病患者Hamazaki-Wesenberg淋巴结中检测到L型痤疮丙酸杆菌。这可能是首次在结节病组织中证实的痤疮丙酸杆菌L型感染病例报告,结节病组织发展为孤立性肉芽肿性厚脑膜炎。该研究提示,用PCR方法定量检测血液或脑脊液中痤疮丙酸杆菌的DNA有助于孤立性神经瘤样病变的诊断,而用抗生素二甲胺四环素和强力霉素治疗是有效的。
L型细菌虽然与许多感染相关,但Schnell等[31]发现虽然未激活的巨噬细胞会使L型李斯特菌持留,但可以通过预激活干扰素(IFN)-γ或骨髓来源的巨噬细胞(BMM)有效地消除细菌。缺乏IFN-β触发表明L型细菌无法从巨噬细胞逃逸到细胞质中。这些结果表明由于毒力因子的表达减少和先天免疫识别,L型李斯特菌的致病性会大大减 弱。
2 L型细菌的耐药机制
2.1 L型细菌表面结构的改变与抗生素耐受
在体外,L型细菌形成困难,会因为产生活性氧(ROS)而致死。Kawai等[32]进一步研究发现L型细菌的转化与中心碳代谢相关。缺乏细胞壁或用β内酰胺类抗生素阻止其合成,会导致糖酵解的通量增加,导致呼吸链中产生活性氧,阻止了L型细菌的生长。通过减慢糖酵解,激活糖异生或消耗氧气来补偿代谢失衡,可使L型枯草芽孢杆菌、单核细胞增生李斯特菌和金黄色葡萄球菌生长,而这些作用在缺乏呼吸链途径的粪肠球菌中则不会发生。
L型细菌细胞壁的缺失会使其对细胞壁靶向药物产生耐药性。事实上,细胞壁靶向抗生素甚至促进了有壁细胞向L型细菌的转变[32]。例如,在渗透压平衡的条件下,大多数革兰阴性细菌中通常可以防止β内酰胺类抗生素引发的灾难性鼓胀和细胞死亡,这些细菌倾向于失去其肽聚糖层,因此采用球形形态,即原生质球形态[33-34]。原生质球由于承受压力的外膜而保持完整[22,35]。研究显示,在包括铜绿假单胞菌、霍乱弧菌、阴沟肠杆菌和克雷伯菌在内的一系列致病菌中都观察到了这一现象[33-34]。用美罗培南(5 MIC)处理铜绿假单胞菌PA14菌株后,Monahan等[33]发现整个种群从正常杆状细胞迅速转变为明显的球形细胞,在24 h内整个种群仅由球形细胞组成。在标准培养基(MH培养基)及与感染和体内环境有关的条件(合成痰液和胎牛血清)下,均能观察到此现象。用透射电镜(TEM)观察到球形细胞的细胞壁被破坏,表明当用靶向细胞壁的抗生素攻击时,铜绿假单胞菌可以转化为L型,且此过程为可逆过程,去除抗生素压力后,L型可转变为原来的有壁细胞状态。
Slavchev等[36]在体外通过低温应激处理产生MTB-L型。低温胁迫处理后,使用Canetti绝对浓缩法对表型进行评估,评估了亲本菌株及其L型培养物对乙胺丁醇的敏感性,并通过PCR-RFLP分析针对embB306基因突变的分段。与对乙胺丁醇(2 mg/L)敏感的亲本菌株相比,其L型表现出对高浓度乙胺丁醇(16 mg / L)的抗性。值得注意的是,在L型变异体中未发现embB306突变。此外,通过扩增和测序16S rRNA基因片段,亲本菌株和L型均无遗传差异。在测试的特定位点,L型变异体缺乏遗传变化,这促使它们通过展示非特异性防御机制和形成L型独特的形态结构来寻求其对乙胺丁醇的表型耐药性的解释。他们观察到,在压力下,结核分枝杆菌会发生剧烈的形态和功能变化,导致L型转化。TEM和扫描电镜观察发现壁分离的碎片和无定形物质围绕着细胞呈胶囊状物质分布,使球形L体或球状L型细胞的微菌落位于丰富的生物膜样基质中。Slavchev等[36]认为结核分枝杆菌对乙胺丁醇的耐药表型可能与L型细菌细胞壁的改变或丢失有关,从而导致乙胺丁醇对其作用缺乏明确的靶点。L型细菌产生的胶囊状结构和生物膜基质有助于其在抗菌药物存在下的耐药性和存活率。这两种物质会完全包围L型细菌,起到屏障的作用来阻止抗生素的渗透。在无法杀死细胞壁缺陷L型细菌的情况下,抗结核治疗无效。
2.2 L型细菌表面结构的改变与免疫逃逸
最近的证据已经明确证明革兰阳性细菌可以在哺乳动物巨噬细胞内的β内酰胺类药物治疗中存活,它们通过转化为L型来实现,L型是由宿主裂解酶(例如溶菌酶)的活性刺激的过程。这不仅在巨噬细胞中观察到,而且能在动物模型中观察到[32]。Kawai等[32]用枯草芽孢杆菌感染蜡螟(Galleria mellonella)的幼虫(该模型具有先天免疫系统,其中包含与人类巨噬细胞类似的吞噬细胞,是一种使用越来越广泛的简单动物模型)时,能观察到在血淋巴中悬浮着许多球形枯草芽孢杆菌细胞。他们认为幼虫吞噬细胞会影响细菌细胞状态,这可能是由于幼虫产生分解酶的作用而产生的。为了进一步验证猜想,他们将经过细菌感染的血淋巴涂在含有青霉素G的等渗琼脂上,对照组为血淋巴相同孵育条件下但无细菌感染。结果如预期,在孵育2 d后,对照组未出现菌落,而实验组观察到大量枯草芽孢杆菌的L型菌落,用金黄色葡萄球菌也获得类似的结果。基于这些结果,研究者认为宿主环境中的免疫效应物(可能包括溶菌酶)可以驱动L型转变,从而有助于对β 内酰胺类药物耐受。
细胞壁缺陷细胞的可延展状态甚至可能通过有壁细胞难以通过的孔洞促进菌体细胞在宿主内的扩散。由于它们缺乏与病原体相关的模式识别受体识别的各种分子,尤其是磷壁酸和肽聚糖[37-38],因此先天免疫系统不易检测到细胞壁缺陷形式。因此,细胞壁缺陷也可以使细菌在对壁靶向抗生素不敏感的状态下逃脱先天免疫杀伤。至关重要的是,在抗生素治疗终止后,这些细菌(特别是革兰阴性细菌)可以有效地恢复到其有壁状态,并重新导致宿主感染[20,39]。
3 小结
L型细菌是一种细菌细胞壁形成受到抑制的特殊的生长形式,可在体内自发形成。见图1。随着分子诊断技术的发展,发现其在rUTI等感染中起着重要作用。由于细胞壁缺失以及随之带来的表面抗原减少,L型细菌可逃避壁靶向类抗生素以及巨噬细胞杀伤,产生抗生素耐受以及免疫逃逸现象,给临床治疗带来不小的挑战。将靶向细胞壁的抗生素与其他类别的抗生素(例如针对细菌膜的抗生素)组合使用可能是临床治疗细菌感染的新方向。
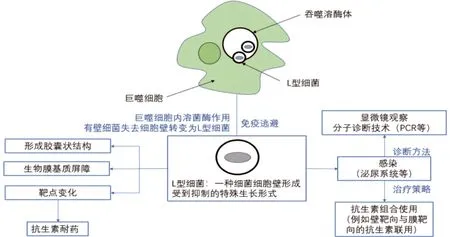
图1 L型细菌感染及免疫逃逸与抗生素耐药关系
