厦门地区脑梗死患者氯吡格雷代谢酶CYP2C19基因多态性的分布特征及临床检测意义
2020-07-24林小青欧阳华
林小青,丁记者,欧阳华
(1.厦门大学附属中山医院药学部,福建 厦门 361004; 2.厦门大学药学院,福建 厦门 361002; 3.福建医科大学药学院,福建 福州 350004)
近年来,脑卒中已成为全球第二大、我国第一大死亡原因[1-2]。脑梗死即缺血性脑卒中,其发病率、致残率、复发和死亡率高,为恢复正常血流,尽早溶栓和(或)进行抗血小板治疗尤为重要[3]。氯吡格雷(前体药物)作为《中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2014》[4]中推荐的防治药物,需经肝药酶CYP2C19的代谢活化后才能发挥抗血小板功能。研究结果表明,氯吡格雷的抗血小板功能与CYP2C19遗传多态性密切相关[5-6]。在已发现的34种CYP2C19等位基因变异中,*2(c.681G>A;rs4244285)和*3(c.636G>A;rs4986893)是东亚人最常见的会使CYP2C19酶活性减弱或失活导致氯吡格雷药效学差异的变异等位基因[7-9]。近年来有研究结果发现,部分脑梗死患者在进行氯吡格雷治疗中,对药物反应性低,出现氯吡格雷抵抗(clopidogrel resistance,CR)现象,影响临床获益,同时也使得探寻CR相关因素的研究成为热点[10-14]。研究结果发现,CYP2C19*2突变是产生CR的独立危险因素[12,15-16]。既往CYP2C19基因多态性在不同地区、种族的分布特征及与CR的相关性研究多集中在急性冠脉综合征,而关于脑梗死方面的研究较少。本研究旨在回顾性分析和探讨厦门地区脑梗死患者氯吡格雷代谢酶CYP2C19基因型、等位基因和表型的分布特征及其临床检测意义,为指导脑梗死个体化精准用药提供参考。
1 资料与方法
1.1 资料来源
选取2017年1月至2019年8月厦门大学附属中山医院神经内科住院患者。纳入标准:汉族,籍贯为福建省厦门市;临床诊断为脑梗死;进行CYP2C19基因型检测。排除标准:未获得基因型检测结果。根据代谢状态将表型分为快代谢型(extensive metabolizers,EM)、中间代谢型(intermediate metabolizers,IM)和慢代谢型(poor metabolizers,PM)3种[5]。
1.2 方法与统计学分析

2 结果
2.1 患者基本情况及Hardy Weinberg平衡评估
按照纳入、排除标准,共纳入符合筛选条件的脑梗死患者425例,其中男性274例,女性151例;年龄24~91岁,平均(69.43±12.51)岁。*2 Hardy Weinberg平衡检验,χ2=4.95,P=0.026,存在偏差;*3 Hardy Weinberg平衡检验,χ2=0.42,P=0.52,符合该平衡。*2、*3等位基因发生频率为33.53%和5.53%,见表1。

表1 患者基本情况及Hardy Weinberg平衡评估Tab 1 Basic information of patients and Hardy Weinberg equilibrium assessment
2.2 CYP2C19基因型和表型分布
数据处理结果显示,425例患者中,*1/*1(39.06%)检出率最高,*3/*3(0.47%)检出率最低;不同表型对应的基因型分别为EM(*1/*1)、IM(*1/*2和*1/*3)和PM(*2/*2、*2/*3和*3/*3),3种表型中,EM、IM和PM患者所占比例分别为39.06%、43.76%和17.18%,见表2。

表2 CYP2C19基因型和表型分布Tab 2 Distribution of CYP2C19 genotypes and phenotypes
2.3 不同性别患者的CYP2C19基因型和表型分布
不同性别患者基因型和表型分布的差异无统计学意义(P>0.05),见表3。
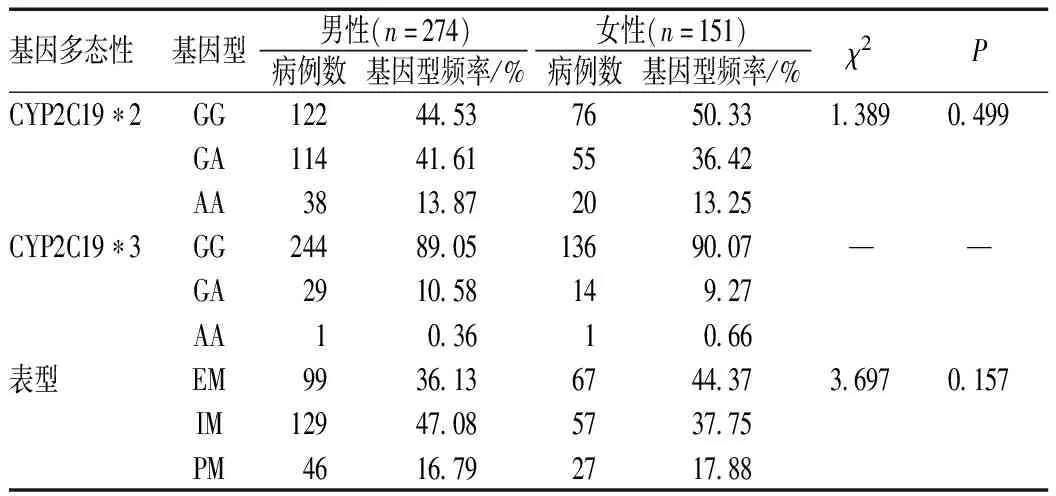
表3 不同性别患者的CYP2C19基因型和表型分布Tab 3 Distribution of CYP2C19 genotypes and phenotypes by gender
2.4 不同年龄患者的CYP2C19基因型和表型分布
根据患者年龄分为3个年龄段:<55岁(60例);55~75岁(213例);>75岁(152例)。χ2分析结果显示,不同基因型和表型在不同年龄段间的分布均无统计学意义(χ2=1.999,P=0.736;χ2=3.008,P=0.556);各年龄段内,不同基因型在性别间的分布无统计学意义(P>0.05);>75岁患者中,不同性别间EM的分布具有统计学意义(χ2=4.435,P=0.035),见表4。

表4 不同年龄患者的CYP2C19基因型和表型分布Tab 4 Distribution of CYP2C19 genotypes and phenotypes at different ages
3 讨论
药物代谢过程中,相关代谢酶的遗传多态性可能影响药物疗效的发挥,甚至产生药品不良反应,如何提高药物疗效和减少药品不良反应是临床面临的重要问题。氯吡格雷作为常见的脑梗死基础防治药物,其个体化的抗血小板聚集功能与CYP2C19基因多态性密切相关,不同基因型引起表型不一,具体表现为氯吡格雷的活性代谢产物不一。当前,*2和*3是东亚人最为关注的功能缺失等位基因,药理作用上二者均可降低血中氯吡格雷活性药物浓度,使氯吡格雷生物利用度降低,临床获益不佳。据报道,临床>30%的患者发生CR事件,近6%的患者发生出血事件,药物反应个体差异大[17]。随着脑卒中成为我国第一大致死病因,临床工作者开始聚焦于基因多态性与血小板异常激活和集聚情况,关注治疗过程中出现的CR事件,力图在氯吡格雷精准个体化合理用药的道路上有所前进。目前,厦门地区脑梗死患者的CYP2C19基因多态性未见详细分析,因此,探讨其分布特点及临床检测意义对该地区脑梗死疾病的治疗具有重要临床意义。
越来越多关于CYP2C19基因多态性与CR事件及临床疗效相关性的研究报道。有研究探讨了CR机制及临床治疗研究进展,提及多数学者认同CYP2C19*2、*3与CR存在相关性[3];严骏等[12]的研究结果发现,CYP2C19*2基因型AG、AA与CR密切相关;冯芹等[15]的研究结果发现,CYP2C19*2变异是CR和原发终点事件发生的独立危险因素;江秀龙等[16]经研究发现,CYP2C19*2、*3是氯吡格雷低应答的独立危险因素;郑艳娥等[18]经研究发现,CYP2C19基因多态性与脑梗死治疗和预后有关;Lan等[19]在探讨CYP2C19代谢状态对脑梗死临床疗效的影响时,发现CYP2C19代谢状态与氯吡格雷的临床疗效密切相关,表明依据CYP2C19代谢状态调整抗血小板治疗方案是很有必要的;Pan等[20]经研究发现,缺血性脑卒中患者在氯吡格雷治疗中,CYP2C19功能缺失等位基因携带者罹患中风和复合血管事件的风险较非携带者高。由此可见,CYP2C19基因多态性与CR事件及临床疗效相关,临床治疗前选择做CYP2C19药物基因检测有其重要价值。
表1统计的425例脑梗死患者CYP2C19基因检测结果显示,带有*2基因的人群未能符合Hardy Weinberg平衡,带有*3基因的人群符合该平衡,与文献报道部分一致[21],可能与不同地区人群基因型和等位基因的分布差异有关。*2、*3等位基因中1个或2个发生突变,将会使患者携带1个或1个以上功能缺失等位基因,导致表型变为IM或PM,意味着该类脑梗死患者在服用标准剂量氯吡格雷时可能会出现疗效不佳。由表1可见,*2(33.53%)等位基因发生频率显著高于*3(5.53%),将二者与其他地区(*2发生频率为31.95%;*3发生频率为4.87%)等位基因发生频率相比[22],厦门地区具有较高频率的*2等位基因突变。由表2可见,表型IM、PM患者所占比例分别为43.76%、17.18%,即代谢异常的患者高达60.94%。药物代谢状态不同,可影响治疗方案的选择[19]。建议脑梗死患者在使用氯吡格雷前,应注意根据遗传特征制订药物治疗方案,通过基因分型选择合适的治疗药物;同时,密切关注血小板聚集功能检测,调整合适的用药剂量,以发挥更好的临床疗效,减少CR及不良事件发生。
通过表3—4比较不同性别、年龄患者间基因型和表型的分布情况,发现脑梗死患者在基于CYP2C19基因多态性的个体化精准用药方面与性别、年龄的相关性不大。据文献报道,东亚人群的脑卒中年龄标化发病率最高(特别是我国),<55岁人群中,男性、女性脑卒中年龄特异性发病率相似;55~75岁人群中,男性发病率明显高于女性[1]。基于上述报道,本研究将患者分为3个年龄段,以进一步探讨各年龄段人群“性别与基因型”和“性别与表型”的分布差异,结果发现,各年龄段内不同性别患者基因型分布的差异无统计学意义(P>0.05);>75岁年龄段,不同性别患者间EM分布的差异具有统计学意义(χ2=4.435,P=0.035),表明在高龄人群中,性别可能成为药物代谢差异化的一个因素,但仍需进一步大样本研究分析。
综上所述,厦门地区脑梗死患者CYP2C19*2等位基因突变比较常见,非EM患者所占比例高。建议有条件者先行氯吡格雷代谢酶CYP2C19药物基因检测,治疗过程中密切关注血小板聚集功能检测,以助于指导脑梗死个体化精准用药。
