多靶点酪氨酸激酶抑制剂安罗替尼的临床应用及安全性评价
2020-07-24解放军总医院医疗保障中心药剂科北京00853重庆医科大学重庆40006
(.解放军总医院医疗保障中心药剂科,北京 00853;2.重庆医科大学,重庆 40006)
安罗替尼是我国自主研发的新型口服多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可作用于血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(platelet derived growth factor receptor,PDGFR)、纤维母细胞生长因子受体(fibroblast growth factor receptor,FGFR)和c-Kit等多个靶点,发挥抑制肿瘤生长、肿瘤血管生成等作用,抗癌谱较为广泛[1-2]。2018年5月盐酸安罗替尼(商品名称:福可维)经CFDA批准上市,用于晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的三线治疗;并于2019年6月、2019年9月分别获批新增“软组织肉瘤”、“三线治疗小细胞肺癌”适应证。已完成的安罗替尼Ⅱ期、Ⅲ期临床试验结果显示[3-4],其推荐剂量(12 mg,qd,早餐前口服;连续服药2周,停药1周,即3周/21 d为1个疗程)下的主要药品不良反应(adverse drug reaction,ADR)包括手足皮肤反应、高甘油三酯血症、高血压、总胆固醇升高、疲劳、蛋白尿、腹泻等,发生率较低的ADR包括ALT升高、AST升高、腹痛、咳嗽、恶心、皮疹、甲状腺功能减退等。鉴于Ⅰ~Ⅲ期临床试验存在病例数有限、患者准入标准较高等局限性,为进一步真实了解安罗替尼的临床使用及安全性情况,本研究收集2018年5月- 2019年4月我院使用盐酸安罗替尼住院患者的基本信息、用药情况以及安全性资料,对其临床实际应用及安全性进行评价分析,以期为临床合理使用安罗替尼提供参考。
1 资料与方法
1.1 临床资料
通过我院医院信息系统(HIS),实时收集2018年5月- 2019年4月使用盐酸安罗替尼胶囊(商品名称:福可维,正大天晴药业集团股份有限公司。国药准字:H20180004。规格:12 mg;10 mg;8 mg。)的住院患者资料,并通过以下3个途径获取盐酸安罗替尼相关ADR:①主动随访:对患者住院期间和出院后的用药情况及ADR发生情况进行随访,直至患者停药(完成治疗周期)后一个月;②病例查阅:基于HIS病历系统,查阅病历中是否有盐酸安罗替尼所致的可疑ADR记载;③ADR报告:通过军队药品不良反应监测管理系统收集上报的盐酸安罗替尼相关ADR。
1.2 安全性评价
按照国家药品不良反应监测中心的关联性评价标准[4],对安罗替尼相关ADR进行关联性评价,分为“肯定”、“很可能”、“可能”、“可能无关”、“无关”5级。关联性评价结果为“可能”及以上的病例确认为阳性病例。ADR名称按照《WHO药品不良反应术语集》[5]进行整理,并对其累及的系统/器官进行分类,对同一病例累及多个系统/器官,涉及多个临床表现的分别计算频次。ADR严重程度评估根据美国癌症研究所常见不良反应评价标准(NCI-CTCAE 4.0)进行,3级及以上为严重的ADR[3]。说明书中未记载的ADR为新的ADR[4]。
1.3 数据处理
采用Excel 2017对患者性别、年龄、肿瘤类型、用药剂量、ADR出现时间、临床表现、转归等数据资料进行汇总分析。
2 结果
2.1 患者基本情况
本研究期间,共收集82例使用盐酸安罗替尼的住院患者,年龄范围18 ~ 89岁,平均年龄(58.60±12.11)岁,男性48人,女性34人,男女比例为1.4∶1。平均BMI(23.07±3.54)kg·m-2,具体详见表1。
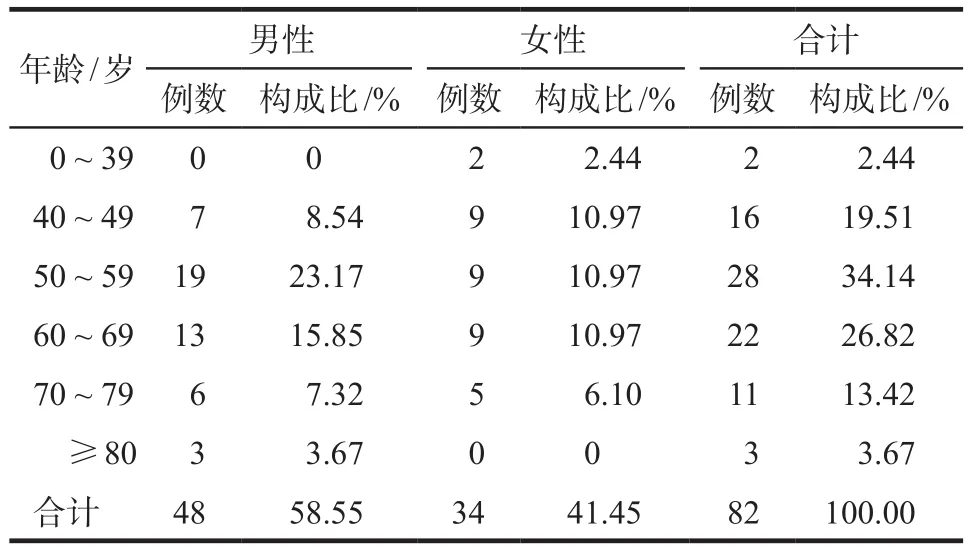
表1 82例安罗替尼住院患者的性别、年龄分布情况Tab 1 Distribution of age, sex of 82 inpatients using anlotinib hydrochloride
2.2 安罗替尼的用药情况
82例住院患者中,应用安罗替尼治疗的肿瘤类型共10余种,其中排名前3位的是NSCLC 26例(31.70%)、食管癌 11例(13.41%)、小细胞肺癌8例(9.76%);“其他”包括直肠癌3例,胆囊癌、胰腺癌、卵巢癌、输卵管癌、宫颈癌、上颌鳞癌各1例。24例(29.27%)患者首次给药时未使用说明书推荐标准剂量(12 mg,qd, po)。41例(50.00%)患者的总用药周期≤5,24例(29.27%)患者总用药周期> 10。详见表2。
2.3 安罗替尼的安全性评价
2.3.1 ADR关联性评价结果 82例住院患者中,关联性评价结果为“可能”及以上的阳性ADR共有31例患者、56例次,总ADR发生率为37.80%。56例次ADR中关联性评价为“肯定”的3例次(5.36%)、3例患者,包括2例高血压、1例鼻出血;“很可能”20例次(35.71%)、14例患者,包括高血压7例次、出血事件5例次、手足皮肤反应1例次、皮疹3例次、腹部不适2例次、蛋白尿1例次、心脏毒性1例次;“可能”33例次(58.93%)、14例患者。
2.3.2 ADR临床表现 56例次安罗替尼相关ADR中,最常见为高血压,共13例次(23.21%);其次为胃肠道反应(11例次,19.64%)、出血事件(10例次,17.85%;包括鼻出血4例次、咯血3例次、便血1例次、吐血1例次、阴道出血1例次,其中1例次咯血、1例次吐血为严重ADR。)、乏力(8例次,14.28%)等。其他ADR共5例次,包括头痛、黏膜损伤、全身酸痛、声音沙哑、腿疼各1例次。详见表3。

表2 82例住院患者的安罗替尼用药情况Tab 2 Application of anlotinib hydrochloride in 82 inpatients
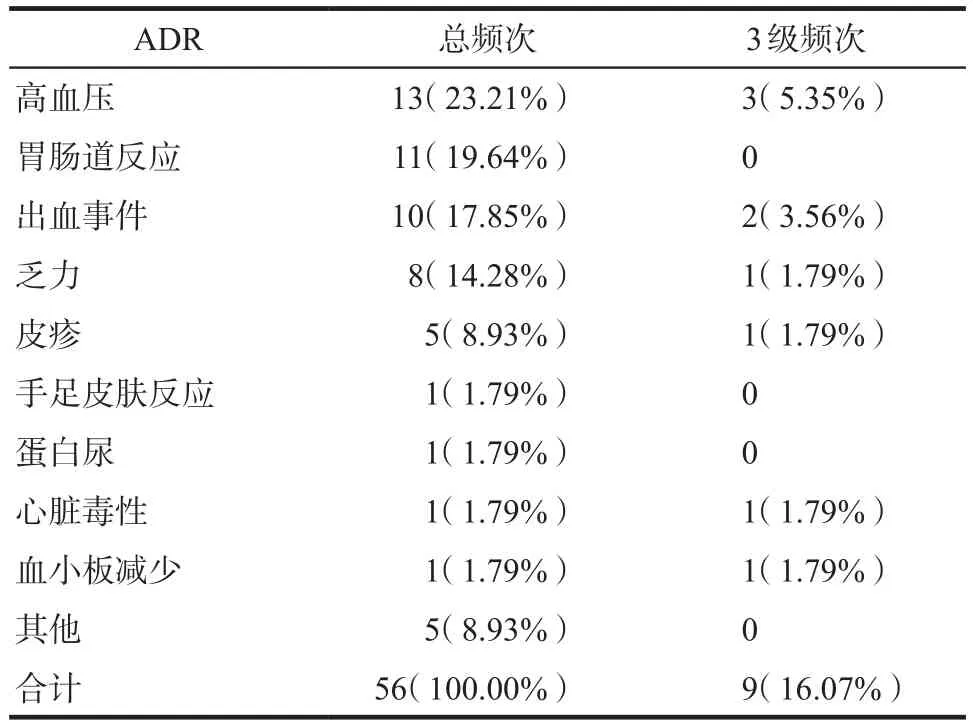
表3 56例次安罗替尼相关ADR的临床表现Tab 3 The clinical manifestation of 56 cases of ADRs induced by anlotinib hydrochloride
2.3.3 ADR相关用药剂量分布 56例次安罗替尼相关ADR中,标准剂量(12 mg·d-1)下ADR发生率最高,共39例次(69.64%);其次为10 mg·d-1、8 mg·d-1,分别为8例次(14.29%)、5例次(8.93%)。详见表4。

表4 56例次安罗替尼相关ADR的用药剂量分布Tab 4 Dose distribution of 56 cases of ADRs induced by anlotinib hydrochloride
2.3.4 ADR发生时间及转归 56例次安罗替尼相关ADR中,33例次(58.93%)为首次用药后发生。ADR发生时间(指在ADR发生的服药周期内,自开始服药至ADR出现的时间)最短为给药后即发生,最迟为给药后2周。详见表5。从转归情况看:56例次安罗替尼相关ADR中,治愈20例次(35.71%),好转17例次(30.36%),持续16例次(28.57%),3例次(5.36%)结局不详,无ADR致死亡病例。
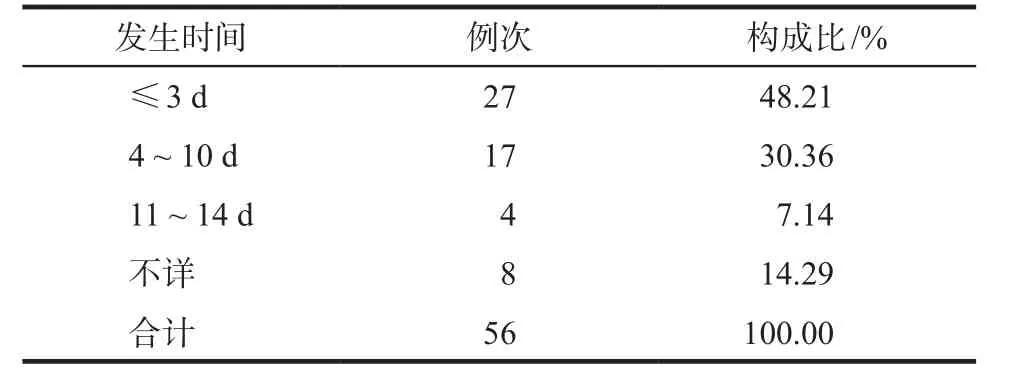
表5 56例次安罗替尼相关ADR的发生时间分布Tab 5 Distribution of occurrence time of 56 cases of ADRs induced by anlotinib hydrochloride
2.3.5 严重、新的ADR 56例次安罗替尼相关ADR中,严重ADR(3级)共9例次,发生率为16.07%,未发现4级及以上ADR。具体详见表3。
新的ADR 1例次,关联性评价为“很可能”,表现为心肌梗死,且为严重ADR。该患者为女性,36岁,入院诊断为左肺上叶中分化腺癌(PT2aN0M0Ⅰb期→Ⅳ期)。2015年6月4日、2018年6月24日行第1、2周期化疗[培美曲塞二钠(0.8 g,ivgtt,D1)+顺铂(120 mg,ivgtt,D1)],2015年7月- 2018年7月口服克唑替尼(250 mg,bid),病情稳定。2018年7月复查胸部CT考虑肺部病灶缓慢进展,评价PD,加用安罗替尼(12 mg,qd,po)。用药11 d后,患者出现胸闷、憋气、血压明显升高,血生化示肌钙蛋白T 0.439 ng·mL-1↑、乳酸脱氢酶405.9 U·L-1↑、肌酸激酶同工酶8.05 ng·mL-1↑、脑利钠肽前体9326.0 pg·mL-1↑,心电图示“窦性心动过速、T波异常,考虑下壁、前侧壁心肌缺血”,心内科会诊考虑为药物相关急性心肌梗死、高血压。立即停用安罗替尼,给予硝酸异山梨酯、美托洛尔、阿司匹林、氯吡格雷等药物治疗,4 d后症状缓解,继续复查肌钙蛋白T、肌酸激酶同工酶、脑利钠肽前体等逐渐降至正常。患者未再继续服用盐酸安罗替尼。
3 讨论
安罗替尼作为我国研发的具有自主知识产权的Ⅰ类新药,有效填补了晚期或转移性NSCLC三线治疗的空白,为肿瘤患者减轻病痛、延长生命周期、改善生活质量提供了新的药物选择。且安罗替尼对比舒尼替尼一线治疗迁移性肾细胞癌(migrating renal cell carcinoma,mRCC)的多中心、随机、对照Ⅱ期研究(NCT02072031)结果证实[6],安罗替尼与舒尼替尼疗效相似,而3 ~ 4级ADR发生率显著低于舒尼替尼(28.9% vs 55.8%,P < 0.01),提示了安罗替尼良好的应用前景。本研究借助我院HIS系统,共纳入82例使用安罗替尼的住院患者,对其临床实际应用及安全性进行初步评价。
3.1 临床用药分析
盐酸安罗替尼(福可维)目前已获批的适应证具体如下:(1)本品单药适用于既往至少接受过2种系统化疗后出现进展或复发的局部晚期或转移性非小细胞肺癌患者的治疗。(2) 本品单药适用于腺泡状软组织肉瘤、透明细胞肉瘤以及既往至少接受过含蒽环类化疗方案治疗后进展或复发的其他晚期软组织肉瘤患者的治疗。(3)本品单药适用于既往至少接受过2种化疗方案治疗后进展或复发的小细胞肺癌患者的治疗。另外,安罗替尼在食管鳞癌二线及以上治疗获得《中国临床肿瘤学会(CSCO)食管癌诊疗指南》(2019)Ⅱ级推荐(2A类证据)[7]。本研究中,82例住院患者的平均年龄为(58.60±12.11)岁,40岁以下仅占2.44%,提示该药的主要用药人群为中老年患者,这与肿瘤高发年龄及疾病进展特点相符。从肿瘤类型分布看,使用该药治疗的肿瘤类型共10余种,主要为NSCLC(26例)、食管癌 (11例)、小细胞肺癌(8例),与目前说明书获批适应证基本符合,提示在真实世界中,鉴于其多靶点抗肿瘤分子机制、广泛抗癌谱的特性,并基于说明书及肿瘤临床试验新进展,安罗替尼已广泛应用于肺癌、食管癌、肝癌、软组织肉瘤、乳腺癌等多种肿瘤的治疗中。
盐酸安罗替尼说明书推荐标准给药方案为:12 mg,qd,po,连续服用2周,停药1周,即3周(21 d)为一个疗程。直至疾病进展或出现不可耐受的ADR。建议在用药过程中密切监测ADR,并根据ADR情况调整剂量以使患者能够耐受治疗。推荐剂量调整方案为:①第一次:10 mg,qd,连用2周,停药1周;②第二次:8 mg,qd,连用2周,停药1周;如8 mg,qd仍无法耐受,则永久停药。本研究分析了82例患者的首次用药方案,发现29.37%的患者首次用药即采用调整剂量方案,其中8 mg,qd方案最多,占58.30%,且存在12 mg qod、8 mg qod的超说明书给药方案。同时对其总用药周期进行分析,发现50%的患者总用药周期不超过5个疗程,提示安罗替尼虽已在临床广泛应用,但具体用药相对谨慎,推测可能与用药时机(三线治疗)、终末期肿瘤患者病情重、耐受性差、生存周期短等相关。鉴于超说明书用药存在风险,建议临床医生应在充分权衡利弊、保障患者利益最大化、并充分告知患者的情况下谨慎选择超说明书用药。
3.2 安全性评价
3.2.1 总ADR发生情况 盐酸安罗替尼胶囊(福可维)说明书基于9项临床实验(主要为ALTER-0303Ⅲ期试验[8]、ALTER0302Ⅱ期试验[9])的835例患者(起始剂量为12 mg,连服2周,停药1周方案)的最常见ADR(≥20%)包括高血压、乏力、手足皮肤反应、肝功能异常、甲状腺功能异常、高血脂、蛋白尿等。其他多项临床试验,如转移性肾细胞癌(mRCC)的Ⅱ期临床试验[10]、甲状腺癌的Ⅱ期临床试验(NCT0187833)[11-12]、软组织肉瘤的Ⅱ期临床试验(NCT0187844)[13-14]等的安全性数据也表明,安罗替尼常见ADR涉及高血压、手足皮肤反应、腹泻及出血事件。由于临床实验是在不同条件下进行,一个临床试验的ADR发生率不能与另一个临床试验的ADR发生率直接比较,也不能反映临床实践中的实际发生率。因此,本研究采集了82例使用安罗替尼患者的相关资料,观察其在真实世界中的安全性:发现安罗替尼相关ADR的总发生率为37.80%(31例患者、56例次),最常见为高血压(13例次,23.21%),其次为胃肠道反应(11例次,19.64%)、出血事件(10例次,17.85%)、乏力(8例次,14.29%)、皮疹(5例次,8.93%)等,与说明书及临床试验报道ADR类型基本相符。58.93%的患者首次使用安罗替尼后出现ADR,标准剂量(12 mg,qd)下ADR发生率最高(69.64%),ADR最快为给药后即发生、最迟为给药后2周发生。66.10%的患者经对症干预后治愈或好转,无ADR致死病例。结合安罗替尼的给药周期(连服2周、停药1周)特点,建议在临床用药中,特别是首次应用安罗替尼并采用标准剂量方案者,应在服药期间(2周)密切监测相关ADR,一旦发现,及时给予对症处理并依据ADR情况调整剂量。
3.2.2 严重以及新的ADR发生情况 安罗替尼NSCLC的Ⅲ期临床试验(ALTER-0303)结果表明,其严重ADR主要表现为高血压(13.6%)、皮肤毒性(3.7%)、出血事件(3.1%)[8]。且其说明书明确指出,发生2级及以上出血事件、3级及以上非出血事件时应停药并依据ADR恢复情况调整剂量。本研究82例患者、56例次安罗替尼相关ADR中,共有严重ADR(3级)9例次(16.07%),亦表现为高血压(3例次)、出血事件(咯血1例次、吐血1例次)、皮疹(1例次)等,未发现4级及以上ADR。提示临床使用安罗替尼时,应严格按照说明书提示,用药期间严密监测凝血酶原时间、国际标准化比值(INR),具有出血风险、凝血功能异常者慎用。开始用药6周内每天监测血压,此后每周监测2 ~ 3次。出现2级手足皮肤反应时应给予对症处理。
特别需要关注的是,本研究发现1例次安罗替尼相关严重心脏毒性反应,关联性评价为“很可能”。该类ADR未在其说明书中记载,判定为安罗替尼新的ADR。患者于服药11 d后出现心肌损害表现,经停药、对症处理4 d后症状缓解,此后未再服用安罗替尼。提示安罗替尼的安全性资料仍需要上市后的进一步完善,建议在用药期间密切关注患者反应,及时发现并处理相关不良事件。
综上,本研究基于我院82例使用安罗替尼患者的病历资料,发现其临床应用广泛、具体用药相对谨慎、ADR表现与说明书及临床试验报道类似、存在一定的超说明书用药现象,且发现1例严重的、新的ADR(心脏毒性),为安罗替尼的临床合理应用提供了一定的参考。但本研究存在单中心、病例纳入时限较短;ADR信息多由随访、病历查阅等方式获取,主观因素影响较大;患者多院外服药,未能持续监测相关检验指标等不足,安罗替尼临床实际应用的安全性仍需多中心、大样本研究结果加以验证。
