薏仁多糖的提取工艺优化及其抗氧化与透皮吸收作用
2020-07-23李树萍彭俊超李萌安全王昌涛赵丹
李树萍 彭俊超 李萌 安全 王昌涛 赵丹

摘要:对薏仁多糖的水提和发酵的提取条件进行了优化,并研究了薏仁多糖提取液抗氧化活性和透皮吸收效果。结果表明,薏仁多糖水提的最佳条件为料液比0.11(g/mL),温度90 ℃,时间7 h;发酵最佳条件为酿酒酵母,料液比0.1(g/mL),时间54 h,pH 4.5;薏仁多糖发酵提取率约为水提的3倍。薏仁多糖发酵液抗氧化性优于水提液;薏仁多糖发酵液24 h透过率为1.14 mg/cm2,水提液24 h透过率为0.53 mg/cm2。
关键词:薏仁多糖;水提;发酵;抗氧化;透皮吸收
中图分类号:TQ464.1; R284 文献标识码:A
文章编号:0439-8114(2020)07-0174-06
DOI:10.14088/j.cnki.issn0439-8114.2020.07.035
薏仁(Coix seed)又名薏苡仁、苡米、苡仁等,在河北、陕西、河南等地区产量丰富,被称为“世界禾本科植物之王”[1]。薏仁中含人体所需的亮氨酸、精氨酸等必需氨基酸以及矿物质 [2],且薏仁中的薏八醇及β、γ两种谷甾醇具有很高的药用价值,这也是薏米具有防癌作用的秘密所在 [3]。薏米淀粉糊性质稳定,沉降速度较缓慢,较之其他淀粉类的成品不易老化[4]。薏仁不饱和脂肪酸含量较高,且含有具有抗氧化性很强的奇数碳链脂肪酸,具有减轻血液中超量胆固醇、加大细胞膜透性、阻遏心肌组织与动脉硬化等功能[5]。薏仁多糖是薏仁的主要有效成分之一,徐梓辉等[6]运用四氧嘧啶破坏胰岛细胞,建立了糖尿病小鼠的模型,研究发现薏仁多糖对阻遏肝糖原分解、肌糖原酵解和抑制糖异生具有一定效用,由此达到降低血糖浓度的作用[6]。植物多糖有许多药理作用如免疫调节、抗肿瘤作用[7-13],降血糖、血脂作用[14-17],抗辐射、抗菌、抗病毒作用[18-20],抗氧化、抗衰老作用[21-23]等。本研究旨在通过对薏仁的水提、发酵试验,优化薏仁多糖的提取条件,以达到对薏仁的充分利用。同时,研究其抗氧化性,并通过透皮吸收实验,对发酵与水提多糖的透皮吸收效果进行比较,为其在人体抗衰老及透皮吸收中的应用提供参考。
1 材料与方法
1.1 材料与仪器
鼠皮购自北京海淀区兴隆实验动物养殖厂,薏仁为市售;维生素C购自国药集团化学有限公司;Tris碱、浓HCL、硫酸、苯酚、葡萄糖、DPPH、焦性没食子酸购自北京化工厂。
BS2202S型电子天平(北京赛多利斯仪器系统有限公司);RJ-TGL-16B型离心机(无锡市瑞江分析仪器有限公司);T6新世纪型紫外可见分光光度计(北京普析通用仪器有限公司);DSHZ-300型恒温水浴振荡器(江苏省太仓市实验设备厂);HH.S21-Ni4型电热恒温水浴锅(北京长安科学仪器厂);YT-CJ-1ND型超净工作台(北京亚泰科隆仪器技术公司);HC-268型透皮扩散池(天津正通科技有限公司);A2492型分析天平(北京福海科技技术有限公司);HH·SY21-Ni4型恒温水浴锅(北京精科华瑞仪器有限公司)。
1.2 试验方法
1.2.1 薏仁多糖提取工艺 热水浸提法:薏仁粉碎后过40目筛,热水浸提,以1 800 r/min的转速离心10 min后量取上清液;微生物发酵法:取乳酸菌/酵母菌进行菌种活化,待菌种生长至对数期,取200 μL菌液进行接种,发酵提取,并在121℃下灭菌30 min,1 800 r/min离心10 min后量取上清液。
1.2.2 薏仁多糖样品含量测定 多糖含量的测定参考文献[24]。
1.2.3 水提薏仁多糖的单因素探究 料液比对提取率的影响:提取温度80 ℃,时间6 h,pH 5。选 取 5个液料比梯度 0.050、0.075、0.100、0.125、0.150 (g/mL),取一定量的多糖溶液测定多糖含量,从而得到提取率。
温度对提取率的影响:料液比0.1 (g/mL),pH 5,时间6 h,选取5个温度梯度50、60、70、80、90 ℃。取一定量的多糖溶液测定多糖含量,从而得到提取率。
pH对提取率的影响:料液比0.1 (g/mL),提取温度80 ℃,时间6 h,选取5 个pH梯度 4、5、6、7、8 。取一定量的多糖溶液测定多糖含量,从而得到提取率。
提取时间对提取率的影响:料液比0.1 (g/mL),提取温度80 ℃,pH 5。选取5个时间梯度2、4、6、8、10 h。取一定量的多糖溶液测定多糖含量,从而得到提取率。
薏仁多糖提取率=薏仁多糖浓度×提取液总体积/薏仁干重×100%
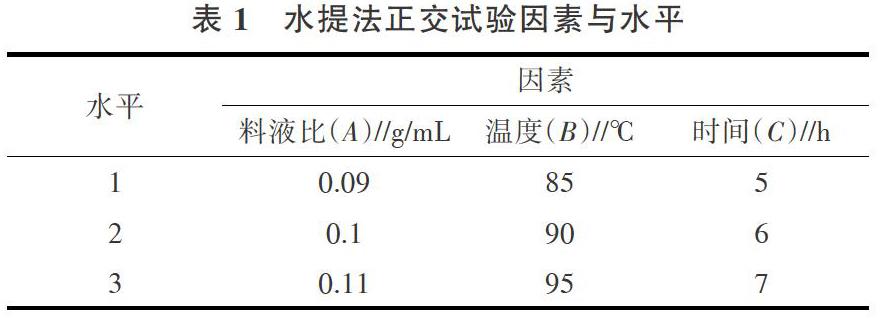
正交试验设计:在单因素优化的基础上进行正交试验,采用三因素三水平法进行设计,以确定提取多糖的最佳工艺(表1)。
1.2.4 发酵法提取薏仁多糖的单因素探究 菌种对提取率的影响:料液比0.1 (g/mL),时间36 h。乳酸菌:温度37 ℃,pH 6.5;酵母菌:温度28℃,pH 5.0。取一定量的多糖溶液测定多糖含量,从而得到提取率。
料液比對提取率的影响:时间36 h,pH 5.0(酵母菌)和6.5(乳酸菌)。料液比梯度0.050、0.075、0.100、0.125、0.150 (g/mL)。取一定量的多糖溶液测定多糖含量,从而得到提取率。
提取时间对提取率的影响:料液比0.1 (g/mL),pH 5.0(酵母菌)和6.5(乳酸菌)。时间梯度12、24、36、48、60 h。取一定量的 多糖溶液测定多 糖 量,从而得到提取率。
pH对提取率的影响:料液比0.1 g/mL,时间36 h。pH梯度4、5、6、7、8。取一定量的 多糖溶液测定多糖含 量,从而得到提取率。
薏仁多糖提取率=薏仁多糖浓度×提取液总体积/薏仁干重×100%
正交试验设计:在单因素优化的基础上进行正交试验,采用三因素三水平法进行设计,以确定提取薏仁多糖的最佳工艺(表2)。
1.2.5 薏仁多糖提取液抗氧化活性检测 对DPPH自由基清除作用的测定:取3 mL薏仁多糖提取液(不同梯度:稀释至1、2、4、8、16倍)与2×10-4 mol/L的DPPH溶液3 mL混匀,作为A1管;取3 mL的无水乙醇与浓度为2×10-4 mol/L的DPPH溶液3 mL混匀,作为A2管;取3 mL的无水乙醇与薏仁多糖提取液3 mL混匀,作为A3管;反应30 min,在517 nm下分别测定A1、A2、A3管吸光度。清除率计算公式:清除率(%)=[(A2+A3)-A1]/A2×100%
对超氧阴离子清除作用的测定(邻苯三酚自氧化法):取0.05 mol/L pH 8.2的Tris-HCl缓冲液4.5 mL于试管中,在25 ℃水浴中预热20 min;加入0.1 mL不同浓度梯度的薏仁多糖提取液和0.4 mL的25 mmol/L邻苯三酚溶液,混匀后于25 ℃水浴中反应5 min;滴加8 mol/L 盐酸1.0 mL,终止反应;将Tris-HCl缓冲液作参照,以0.1 mL蒸馏水代替薏仁多糖提取液作为空白对照组,在299 nm处测定吸光度,计算其清除率。取不同浓度薏仁多糖提取液各0.1 mL,加超纯水5.9 mL,测量其在299 nm处的吸光度,读数为A本底。超氧阴离子自由基清除率= (A1-A2+A本底)/A1×100%(A1为空白组平均吸光度,A2为试样组平均吸光度)。
1.2.6 透皮吸收试验 制备鼠皮:将豚鼠麻醉后断颈致死,处理其腹部毛发,涂抹脱毛膏并放置5 min后刮去,生理盐水清洗,后剥取其腹部皮肤,去除皮下脂肪并洗净,用保鲜膜包裹,置于-20 ℃冷藏备用。将豚鼠皮肤固定于扩散池上下室之间,接受池盛取生理盐水,样品池(没有多糖)则盛取5 mL薏仁多糖提取液。在32 ℃下以400 r/min不间歇搅拌,之后于0、1、2、4、6、8、10、12、24 h分别吸取1 mL接受液,并补充1 mL的生理盐水。每个样品做3个平行试验。
2 结果与分析
2.1 水提法单因素优化结果
2.1.1 料液比对提取率的影响 水提薏仁多糖的提取率受多种因素影响,料液比就是其中之一。料液比是指薏仁的质量与作为浸提液水的体积的比(g/mL)。如图1所示,在薏仁多糖的料液比作为变量时,可以发现薏仁多糖的提取率受到其影响较大。在料液比0.05~0.10 (g/mL)时,提取率急剧地上升,在0.10 (g/mL)时,其提取率达到峰值,而在0.10 (g/mL)以后,其提取率却逐渐下降,这可能是由于薏仁溶液相对过于浓稠,导致其提取率下降。
2.1.2 温度对提取率的影响 温度的高低是影响水提薏仁多糖提取率的又一因素。如图2所示,在薏仁多糖的提取温度为变量时,提取率变化范围较大,在80 ℃以前提取率不高,而在90 ℃时则急剧上升,薏仁多糖的提取率随温度升高而升高,这可能是因为温度达到一定值时,其相关反应较为剧烈。
2.1.3 pH对提取率的影响 pH对水提薏仁多糖的提取率也有影响(图3)。pH为4~6时,提取率是缓慢上升的;当pH为6时,其提取率达到巅峰,之后提取率有所下降。可能薏仁多糖对偏酸性的环境较为适应,故提取率较高。不过总体来说,pH对薏仁多糖提取率的影响不大。
2.1.4 提取时间对提取率的影响 提取时间的长短也会影响水提薏仁多糖的提取率。由图4可知,薏仁多糖的提取时间为2~6 h时,薏仁多糖的提取率是逐渐升高的,其在6 h时达到峰值,6 h后其提取率逐渐下降,原因可能是随着时间的增加薏仁多糖降解,从而导致其提取率降低。
2.2 发酵法提取单因素优化结果
2.2.1 不同菌种对提取率的影响 不同的菌种对发酵法提取薏仁多糖的提取率影响不同。由图5可知,从保加利亚乳杆菌和酿酒酵母这两种常见菌种中选取,酿酒酵母在适宜环境下的提取率较保加利亚乳杆菌更高,因此,发酵提取的3个单因素条件的菌种选取酿酒酵母。
2.2.2 液料比对提取率的影响 在其他条件固定的情况下,以薏仁多糖的料液比作为惟一的变量时,由图1可知,当料液比在0.10 (g/mL)时,薏仁多糖的提取率达到峰值,之后薏仁多糖的提取率逐渐降低,这可能是由于在料液比较高时发酵不够充分。
2.2.3 提取时间对提取率的影响 当其他条件固定、薏仁多糖的提取时间为惟一的变量时,由图6可知,在时间为48 h时,提取率达到峰值,在12~48 h,随时间的增加而提取率升高,48 h后则有所下降。推测其提取率下降的原因可能是部分多糖分解,也可看出提取时间对发酵法的影响较大。
2.2.4 pH对提取率的影响 在發酵提取薏仁多糖时,若保持其他条件不变,仅pH变化时,由图7可知,在pH 4~5时提取率是升高的,在pH 5时达到峰值,而后有所衰减,表明pH对发酵提取薏仁多糖具有一定的影响。
2.3 水提法和发酵法提取薏仁多糖的正交条件优化结果
2.3.1 水提法正交试验 由表3的极差分析可知,水提法提取薏仁多糖最佳组合为A3B2C3,即料液比0.11(g/mL)、温度90 ℃、提取时间7 h。水提法提取薏仁多糖因素的排序为:料液比>提取温度>提取时间。最后,根据优化结果提取薏仁多糖,提取率为3.83%。
2.3.2 发酵法正交优化 由极差分析可知,发酵法提取薏仁多糖最佳组合为A3B2C1,即提取时间54 h、pH 4.5、料液比0.1(g/mL)。影响发酵法提取薏仁多糖因素的排序为:提取时间>pH>料液比。按照优化结果提取薏米多糖,提取率为11.50%。
2.4 薏仁多糖抗氧化性研究试验结果
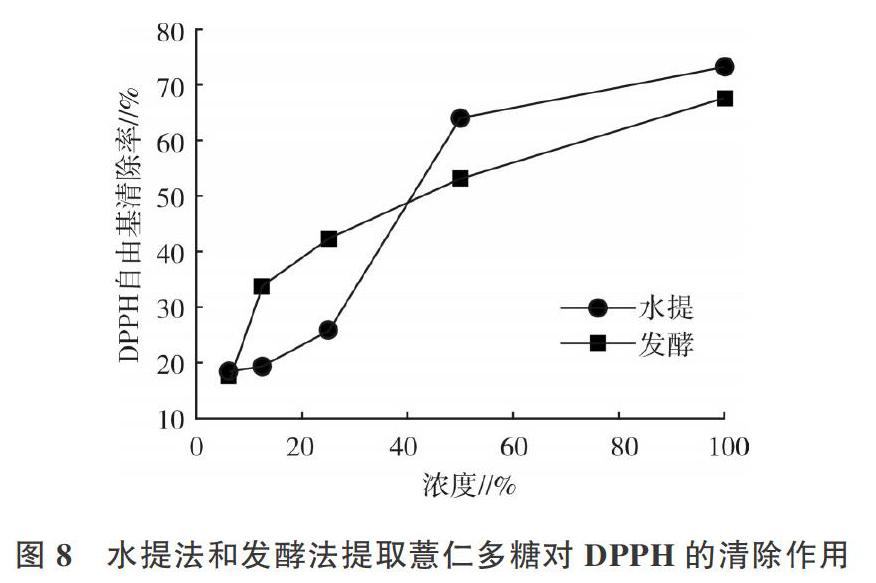
2.4.1 DPPH清除率 由图8可知,薏仁多糖水提液的DPPH清除效率较高,在未稀释时可达到约68%,而在稀释约4倍后清除率小于50%,随着其稀释比例增加其清除率降低较多。发酵法所得的薏仁多糖的DPPH清除率较高,其在未稀释时可达到约74%,而在稀释约4倍后清除率小于50%,随着稀释比例增加其清除率降低较多。
2.4.2 超氧阴离子清除率结果分析 超氧阴离子具有免疫和信号转导的作用,但积累过多会对细胞膜及生物大分子产生破坏作用,导致机体细胞和组织代谢异常,从而引起多种疾病。由图9可知,水提所得薏仁多糖的超氧阴离子清除效率较低,其在未稀释时可达到约47%的清除率。薏仁多糖发酵液的超氧阴离子清除效率较高,其在未稀释时可达到约66%的清除率,稀释2倍后则清除率小于50%,其后清除率随着稀释比例的增加而逐渐下降。
2.5 透皮吸收试验结果
2.5.1 水提最優条件透皮结果 透皮吸收是指外用制剂(薏仁提取液)施于正常的皮肤表面(鼠皮)后,吸收进入全身血液循环的过程。由图10可知,试验时间为0~8 h时,其吸收效果迅速上升,在8 h时达到峰值,而在8 h之后其吸收则是有所衰减,直至趋于不变。薏仁多糖水提液24 h透过率为0.53 mg/cm2。
2.5.2 发酵最优条件透皮结果 由图10可知,发酵法的吸收效果比较反复,其在10 h时达到峰值,之后吸收效果则是有反复。薏仁多糖发酵液24 h透过率为1.14 mg/cm2。
3 结论
通过正交优化薏仁多糖的条件发现:水提薏仁多糖最佳条件为料液比0.11(g/mL),温度90 ℃,时间7 h。水提法薏仁多糖影响因素的排序为料液比>提取温度>提取时间。最后,根据优化结果提取薏仁多糖,提取率为3.83%。发酵法提取薏仁多糖最佳条件为酿酒酵母,料液比0.1(g/mL),时间54 h,pH 4.5,发酵法薏仁多糖影响因素的排序为提取时间>pH>料液比。最后,根据优化结果提取薏仁多糖,提取率为11.50%。发酵法提取薏仁多糖的提取率约为水提法的3倍,此结果为薏仁的充分利用提供了技术依据。根据薏仁多糖对DPPH和超氧阴离子的清除作用可知,薏仁多糖发酵液抗氧化性优于水提液。薏仁多糖发酵液24 h透过率为1.14 mg/cm2,水提液24 h透过率为0.53 mg/cm2。表明薏仁多糖发酵液透皮效果优于薏仁水提液。由于小鼠存在个体吸收效果差异,同时需要3只小鼠,其生理状况也不同,均会导致试验结果受到影响。
本研究通过对薏仁提取多糖的水提法和发酵法工艺进行优化,并对两种多糖的抗氧化效果和透皮吸收效果进行了检测。结果表明,发酵法提取薏仁多糖提取率更高,同时发酵法提取得到的薏仁多糖在抗氧化性和透皮吸收方面效果均优于水提法,以上结果为发酵薏仁多糖作为潜在的抗氧化化妆品、食品的开发提供了一定的数据参考。
参考文献:
[1] 汪开治. 国外科技简讯[J]. 植物杂志,2004(1):48-48.
[2] 赵晓红. 薏米的营养、医用价值及制作饮料的发展前景[J]. 山西食品工业,2002(3):35-36.
[3] 刘月好. 薏米的营养及其在食品中的开发应用[J]. 食品科技,2003(9):47-49.
[4] 吴雪辉,何淑华,谢炜琴. 薏米淀粉的颗粒结构与性质研究[J]. 中国粮油学报,2004,19(3):35-37.
[5] 雷正杰,张忠义,王 鹏,等. 薏苡仁油脂肪酸组成分析[J]. 中药材,1999 (8):405-405.
[6] 徐梓辉,周世文,黄林清. 薏苡仁多糖的分离提取及其降血糖作用的研究[J]. 第三军医大学学报,2000,22(6):578-581.
[7] 李 毓,邱健行,熊带水,等. 薏苡仁酯和顺铂抑制人鼻咽癌细胞增殖的协同作用[J]. 广东药学院学报,1999(4):285-287.
[8] LIN G M,LIU L,SHAO W. Microcalorimetry studies on the antibacterial effect of crude monkshood polysaccharide[J]. Journal of Zhejiang university science B,2011,12(7):563-567.
[9] WANG T,LI Y,WANG Y,et al. Lycium barbarum polysaccharide prevents focal cerebral ischemic injury by inhibiting neuronal apoptosis in mice[J]. PloS One,2014,9(3): e90780.
[10] 付书婕,王乃平,黄仁彬. 植物多糖免疫调节作用的研究进展[J]. 时珍国医国药,2008,19(1):99-101.
[11] 褚珊珊,左绍远. 植物多糖抗肿瘤作用机制研究进展[J]. 中国民族民间医药,2017,26(24):45-46.
[12] 张彩群,计建军,王长江. 半夏多糖体内抗肿瘤作用与机制研究[J]. 海峡药学,2016,28(7):22-24.
[13] ZHENG Y,WANG Q,ZHUANG W,et al. Cytotoxic,Antitumor and immunomodulatory effects of the water-soluble polysaccharides from lotus (Nelumbo nucifera Gaertn.) seeds[J]. Molecules,2016,21(11):1465.
[14] 罗祖友,胡筱波,吴谋成. 植物多糖的降血糖与降血脂作用[J]. 食品科学,2007,28(10):596-600.
[15] 吴建芬,冯 磊,張春飞,等. 茶多糖降血糖机制研究[J]. 浙江预防医学,2003,15(9):10-11,13.
[16] 冯 磊,张春飞. 茶叶多糖对实验性高脂血症大鼠脂质代谢的影响[J]. 浙江中医杂志,2003,38(5):221-222.
[17] 曾志将,汪礼国,饶 波,等. 蜂花粉多糖对大鼠降血脂效果研究[J]. 江西农业大学学报,2004,26(3):406-408.
[18] 骆传环,王作华,程鲁榕,等. 柴胡多糖抗辐射作用的实验研究[J]. 中草药,1995,26(12):645-646.
[19] 林雄平,林彬彬,卓雄标,等. 南五味子果实多糖和脂溶性物质抗菌抗氧化作用研究[J]. 安徽农业科学,2017,45(4):119-121,168.
[20] 蔡双璠,杨 扬,吴 蓉,等. 夏枯草多糖及凝胶抗单纯疱疹病毒的药效学研究[J]. 世界科学技术-中医药现代化,2017,19(2):247-253.
[21] 孙高军,洪深求,周小兵,等. 不同产地烟叶多糖体外抗氧化活性研究[J]. 合肥工业大学学报(自然科学版),2018,41(2):260-265.
[22] 朗 杰,郑玉光. 西瓜皮多糖对衰老小鼠抗衰老及降血糖作用[J]. 中国老年学杂志,2015,35(8):2196-2198.
[23] YOSHIOKA Y,SANO T,IKEKAWA T. Studies on antitumor polysaccharides of Flammulina velutipes (Curt.ex Fr. ) Sing. I[J]. Chemical & pharmaceutical bulletin,1973,21(8):1772-1776.
[24] 刘志明,唐彦君,吴海舟,等. 苯酚-硫酸法测定葡萄酒中总糖含量的样品处理[J]. 中国酿造,2011(2):158-161.
