基于Label-free技术的汉麻籽不同发芽时期蛋白质组学分析
2020-07-23张正海孙宇峰魏连会宋淑敏姬妍茹杨庆丽
董 艳,张正海,王 宁,孙宇峰,*,魏连会,宋淑敏,姬妍茹,杨庆丽,石 杰,田 媛
(1.黑龙江省科学院大庆分院,黑龙江 大庆 163319;2.黑龙江省八一农垦大学,黑龙江 大庆 163319)
汉麻籽又称工业大麻籽或火麻籽,属于四氢大麻酚含量低于0.3%的大麻科、大麻属一年生草本植物大麻的果实[1]。自古以来汉麻籽一直是食品、油脂以及精神药物的重要来源[2],也被用于中药预防便秘[3]、降低胆固醇[4]、免疫调节[5]、抗衰老[6]、改善记忆[7]等。汉麻籽不仅含有β-谷甾醇、生育三烯酚、木质酰胺等生物活性成分,也是良好的蛋白质来源,非常适合人类和动物食用[8-9],但因其质地坚硬、不易煮熟的特点,制约了加工利用。目前,发芽萌动的方法己广泛用于南瓜籽、萝卜籽、亚麻籽等改善加工特性和适口性、提高其营养价值并降低抗营养因子的含量等方面[10-12]。近年来,有关汉麻籽发芽的研究己有报道,Werz等[13]认为汉麻籽发芽既不会诱导大麻素的形成,也不会改变不饱和脂肪酸的有益特征,但可以诱导产生抗炎化合物。Frassinetti等[14]对汉麻籽发芽0、3、5 d的抗氧化作用进行了评价,发现汉麻籽发芽后总多酚、类黄酮和黄酮醇含量提高,抗氧化能力增强。但迄今为止,汉麻籽发芽过程的分子机制仍鲜有研究,蛋白质组学的发展,为研究汉麻籽萌发过程中不同时期蛋白质的差异和功能提供了有效手段。本研究以自然发芽0、12、24、36、48 h的汉麻籽为研究对象,利用非标记(Label-free)定量技术和液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术构建出汉麻籽发芽过程中的表达谱,对比发芽前后汉麻籽蛋白质组学的变化,并对各时间点鉴定出的差异蛋白进行生物学分析,研究其基因本体(gene ontology,GO)富集功能和KEGG代谢通路,旨在更好地了解汉麻籽发芽不同时期的功能蛋白,为优化汉麻籽营养水平给于一定参考,为进步一开发汉麻籽萌动食品提供理论数据。
1 材料与方法
1.1 材料与试剂
火麻1号汉麻籽采自黑龙江省科学院大庆分院东风农场,使其自然萌发,萌发时间分别为12、24、36、48 h;二硫苏糖醇(dithiothreitol,DTT) 比利时Acros Organics公司;BCA定量试剂盒 上海碧云天生物技术有限公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)饱和酚 美国Promega公司;胰蛋白酶、Tris-HCl、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Q-Exactive质谱仪、EASY-n1000高效液相色谱(high performance liquid chromatography,HPLC)仪 赛默飞世尔科技有限公司;5430R低温高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 蛋白质提取和肽段酶解
参考曹晓林等[15]报道的酚提取法对样品总蛋白提取,冷冻干燥后,采用SDT(0.04 mg/mL SDS,1 mmol DTT,溶解于pH 7.6的Tris-HCl)溶液裂解[16],超声破碎,离心后取上清液,经0.22 µm滤膜过滤,BCA定量试剂盒对样品定量。各组样品采用超滤辅助样品制备法进行胰蛋白酶酶解[17],通过C18Cartridge固相萃取柱对酶解肽段脱盐,冻干后加入40 μL体积分数0.1%甲酸溶液复溶,测定280 nm波长处的OD值,对肽段定量[18]。
1.3.2 LC-MS/MS条件及数据分析
参考董飞等[19]方法,样品酶解后,采用纳升级液相系统EASY-nLC1000进行LC-MS/MS分析。
色谱柱:赛默飞EASY column SC200(RP-C18,150 μm×100 mm);流动相:A为0.1%甲酸-2%乙腈溶液,B为0.1%甲酸-84%乙腈溶液;色谱柱以100%的A液平衡,样品依次经上样柱和分析柱分离,流速为300 nL/min;梯度洗脱:0~85 min,100%~55%A,0%~45% B;85~87 min,55%~0% A,45%~100% B;87~90 min,100% B。
酶解产物经毛细管HPLC分离后用Q-Exactive质谱仪进行ESI质谱鉴定[20]。分析时长60 min;检测方式:正离子;母离子扫描范围:m/z 300~1 800;一级质谱分辨率:70 000@ m/z 200;二级质谱分辨率:17 500@ m/z 200;多肽和多肽碎片的质荷比按照下列方法采集:每次全扫描后采集20 个碎片图谱,得到LC-MS/MS原始数据,再用Maxquant软件查库鉴定并进行Lable-free定量分析[21]。
1.4 生物信息学分析
将未萌发的汉麻籽作为比较组,通过差异倍数大于1.5作为筛选标准得到差异蛋白,采用Omicsbean软件和R verision 3.5.0软件对目标蛋白进行GO功能注释、KEGG通路注释和蛋白聚类分析,生成层次聚类热图,基于STRING(http://string-db.org/)数据库中的信息查找蛋白之间的直接和间接相互作用关系,生成相互作用网络图。
2 结果与分析
2.1 差异表达蛋白质的鉴定及统计分析结果
按照表达倍数变化1.5 倍以上的标准筛选差异表达蛋白质,表达倍数变化大于1.5 倍表现为上调,表达倍数变化小于0.67 倍表现为下调。由此筛选出差异蛋白质的结果如表1所示,汉麻籽发芽12、24、36、48 h与原点相比分别鉴定出差异蛋白86、106、135、158 种,其中发芽48 h后上调蛋白质数量为103,占差异蛋白质总数的65.2%。
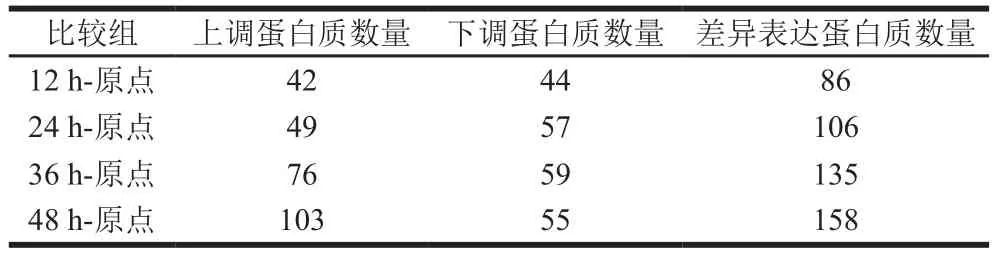
表1 差异蛋白质分析结果统计Table 1 Statistics results of differential protein analysis
2.2 差异表达蛋白质聚类分析
利用R version 3.5.0软件分析发芽汉麻籽差异蛋白集合的定量信息,同时对样品和蛋白质的表达量2 个维度进行分类,根据层次聚类算法对4 个时间点的差异表达蛋白质分别进行聚类分析。如图1所示,显著性上调蛋白质主要是蛋白/S10、短链脱氢/还原酶、果糖二磷酸醛缩酶(酶代码EC4.1.2.13)、11-S种子贮藏蛋白等,显著性下调蛋白质主要为豆荚蛋白、IQ基序、非特征蛋白质、新生多肽相关复合物α亚单位等。

图1 差异表达蛋白质聚类分析结果Fig. 1 Clustering analysis of differentially expressed proteins
2.3 差异表达蛋白质标准化分类体系功能富集分析
差异表达蛋白质标准化分类体系,它从生物过程、细胞组分和分子功能3 个角度对蛋白质功能进行分类[22]。利用蛋白质组学分析软件对鉴定的所有蛋白质进行标准化分类体系功能注释,如图2所示。4 组比较组中,参与的生物学过程主要涉及代谢过程、细胞过程、单一生物过程,说明发芽过程对汉麻籽细胞内蛋白质的代谢影响很大。细胞组分主要分布在细胞、细胞组分、细胞器、大分子复合物、细胞器组分,差异倍数最高的为乙醛酸循环体,差异倍数为8。乙醛酸循环是油料植物种子脂类代谢的重要途径,在发芽过程中脂肪酸经乙醛酸循环产生琥珀酸,后者经三羧酸循环进入糖异生途径转化为葡萄糖,为种子萌发提供更多的能量[23]。差异表达基因的分子功能主要包括催化活性和结合,此外发芽48 h与三羧酸循环相关的琥珀酰辅酶A连接酶活性、柠檬酸合成酶活性、异柠檬酸脱氢酶活性以及糖酵解中的关键酶6-磷酸果糖激酶活性均为原点的7 倍。

图2 功能富集分析Fig. 2 Functional enrichment analysis
2.4 差异表达蛋白质代谢和信号转导通路富集分析


图3 通路富集分析Fig. 3 Pathway enrichment analysis
常用代谢和信号转导通路研究数据库分析差异表达蛋白质代谢和信号转导通路富集[24-26]。如图3A所示,通过费希尔精确检验方法对比较组12 h-原点的差异表达蛋白质进行代谢和信号转导通路富集分析,结果显示,氨基酸的生物合成、碳代谢、代谢途径、次生代谢产物的生物合成、2-氧羧酸代谢、糖酵解/糖异生等重要通路发生了显著变化。如图3B所示,24 h-原点的差异表达蛋白质中氨基酸的生物合成、碳代谢、代谢途径、次生代谢产物的生物合成、三羧酸循环、蛋白酶体和2-氧羧酸代谢等重要通路发生了显著变化。如图3C所示,36 h-原点的差异表达蛋白质中碳代谢、氨基酸的生物合成、代谢途径、次生代谢产物的生物合成、光合作用-天线蛋白、蛋白酶体、糖酵解/糖异生和核糖体等重要通路发生了显著变化。如图3D所示,48 h-原点的差异表达蛋白质中碳代谢、三羧酸循环、氨基酸的生物合成、代谢途径、次生代谢产物的生物合成、乙醛酸和二羧酸代谢和2-氧羧酸代谢等重要通路发生了显著变化。
2.5 蛋白质相互作用网络分析
基于蛋白质相互作用数据库中的信息查找目标蛋白质之间的直接和间接相互作用关系,生成相互作用网络并对网络进行分析。在生物体中,蛋白质并不是独立存在的,其功能的行使必须借助于蛋白质间的相互作用调节和介导[27]。因此,研究蛋白质相互作用形成的网络,对不同发芽时间与原点探索蛋白质发挥功能的分子机制具有重要意义。如图4所示,通路节点为差异蛋白所属的标准化分类体系/代谢和信号转导条目,颜色由黄色渐变为蓝色,P值随之增大。与蛋白关联的线条数量越多,表明该蛋白在网络中越关键,汉麻籽不同发芽时间的差异蛋白彼此间及与互作网络数据库收录的其他蛋白间联系紧密,主要相关通路为核糖体、碳代谢、三羧酸循环、光合生物的固碳作用、氨基酸的生物合成和糖酵解/糖异生等。

图4 差异表达蛋白质相互作用网络图Fig. 4 Differentially expressed protein interaction network diagram
3 结 论
汉麻籽发芽时蛋白质的变化非常复杂,是影响和提高其营养价值的重要因素[27]。在酶的作用下,蛋白质水解为多肽和氨基酸,这些产物又参与分解代谢或合成新的氨基酸,从而使蛋白质和氨基酸含量发生变化[28-30]。本实验基于Label-free技术和LC-MS/MS技术分析汉麻籽在不同发芽时期的差异表达蛋白质,并对分离鉴定出来的差异蛋白质进行蛋白质聚类分析、标准化分类体系注释和代谢和信号转导注释的富集分析以及蛋白质相互作用网络分析。实验共鉴定到蛋白质为485 个,由蛋白质层次聚类分析热图可以看出,本实验得到的差异蛋白质信息合理;经代谢和信号转导功能注释分类和代谢和信号转导注释的富集分析后,可以看出多数蛋白质与碳代谢及氨基酸的生物合成有关。由蛋白质相互作用网络分析可以得到全面系统的分子层面的细胞活动模型,以便于今后对分子机制进行深入研究。由于汉麻籽的基因组十分庞大,目前还存在许多未知的基因组鉴定尚未完成,所以汉麻籽的蛋白质组学研究将成为探索其萌发机制的重要途径。本实验利用蛋白组学手段确定了汉麻籽中的部分蛋白质,并完成了汉麻籽部分自身萌发的相关代谢通路及蛋白质的差异表达,这为汉麻籽后期在食品、药品等方面的工业化发展提供了有效的参数。
