食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味
2020-07-23张楠笛向文良
张楠笛,祝 林,许 琴,向文良
(西华大学食品与生物工程学院,四川 成都 610039)
四川泡菜是中国极具代表性的传统发酵蔬菜,具有独特风味及脆嫩清香口感,因此常被用作川菜的主要调味料或餐前开胃菜[1]。传统四川泡菜以小规模或家庭式生产为主。近年来,随着川菜产业的快速发展,小规模泡菜生产己不能满足市场需求,大规模工业化生产四川泡菜己成为目前四川泡菜生产的主流[2]。然而,依赖于自然发酵为主的工业化泡菜生产常出现产品风味不稳定等问题[3]。四川泡菜发酵的本质是乳酸菌介导的各类生化反应,乳酸菌的种类及其活动是形成四川泡菜风味品质的关键,利用乳酸菌作为发酵剂生产四川泡菜是未来工业化生产四川泡菜的发展趋势,其具有发酵周期短、产品风味稳定和抑制杂菌生长等优点,因此被认为是解决目前四川泡菜工业化自然发酵导致产品不稳定的最有效方案[4]。肠膜明串珠球菌、植物乳杆菌和双歧杆菌等作为四川泡菜的发酵菌株,常用于工业化四川泡菜生产[5]。
发酵食品的风味是影响产品感官品质和消费者接受度的重要因素之一。传统四川泡菜发酵包括异型乳酸发酵和同型乳酸发酵[4],二者协同形成了四川泡菜的风味特点[6]。异型乳酸菌在泡菜发酵初期占优势,其代谢除产生乳酸外,还会生成大量的乙醇、乙酸、甘露醇等风味物质,赋予泡菜愉悦风味[7]。同型乳酸菌在泡菜发酵过程中迅速取代异型乳酸菌,其发酵特点是产酸能力强、发酵速度快,能够快速给予泡菜酸爽感觉,但由于其代谢产物种类少,风味较为贫乏[8]。因此,异型和同型发酵菌株的选择是决定发酵菌剂生产四川泡菜风味的关键[9]。
植物乳杆菌(Lactobacillus plantarum)发酵泡菜以生成乳酸为主,同时可产生少量乙酸,具有耐酸和产酸能力强的特点,在泡菜成熟中后期占主导地位,是目前工业化泡菜生产使用最普遍的菌株[10]。食窦魏斯氏菌(Weissella cibaria)是自然发酵泡菜前期的异型乳酸发酵优势菌,具有发酵复杂性和产物多样性的特点,能产生更多的风味物质,赋予泡菜更好风味[11]。大多数研究泡菜接种发酵,仅接种了单一乳酸菌,然而接种单一乳酸菌发酵的泡菜,口感平淡[12-16]。目前,关于食窦魏斯氏菌协同植物乳杆菌发酵蔬菜的研究鲜有报道。因此,本研究选取四川泡菜常用蔬菜-豇豆为原料,探索食窦魏斯氏菌协同植物乳杆菌发酵对四川泡菜风味和感官品质影响,以期为丰富四川泡菜发酵菌种和食窦魏斯氏菌在四川泡菜生产中的应用提供理论和技术基础。
1 材料与方法
1.1 材料、菌种与试剂
豇豆为四川某泡菜企业提供,选择色泽正、无破损、无虫害、无霉变的新鲜豇豆;食窦魏斯氏菌、植物乳杆菌为西华大学食品与生物工程学院实验室保藏菌种。
MRS肉汤培养基 杭州微生物试剂有限公司;柠檬酸、乙酸、苹果酸、乳酸(均为分析纯) 成都科龙化工试剂厂;C7~C40饱和烷烃标准品 美国Sigma公司。
1.2 仪器与设备
TB-214电子天平 德国Sartorius公司;DHP-9082电热恒温培养箱 上海一恒科技有限公司;PHS-2C酸度计成都世纪方舟科技公司;Alliance 2695高效液相色谱(high performance liquid chromatography,HPLC)仪美国Waters公司;QP2010 Plus气相色谱-质谱联用仪日本岛津公司;HPX-87H树脂柱 美国Bio-Rad公司。
1.3 方法
1.3.1 泡菜制作
食窦魏斯氏菌和植物乳杆菌接种于MRS液体培养基中,37 ℃培养至菌体浓度达到约1×108CFU/mL,4 500 r/min离心10 min,收集菌体后用0.85 g/100 mL无菌生理盐水清洗2 次,并加入无菌生理盐水制成菌悬液备用。
豇豆原料(500 g)经整理、清洗、沥干、切分后,用75%食用酒精喷撒杀菌。无菌水清洗残留食用酒精后,在超净工作台紫外线下沥干,装入2.0 L陶瓷泡菜坛。按照下列不同接种方式进行发酵:蔬菜与6.0%食盐水质量体积比(g/mL)为1∶2装9 坛,3 坛为1 组。一组接入5.0 mL植物乳杆菌悬液;一组接入5.0 mL食窦魏斯氏菌悬液;一组接入2.5 mL植物乳杆菌和2.5 mL食窦魏斯氏菌混合菌液。坛沿封水,25 ℃发酵7 d。每坛每隔1 d取样6 份,3 份用于测定酸度、有机酸和菌落数。发酵豇豆最优时,测定泡菜发酵液中的挥发性物质。
1.3.2 菌落计数和pH值测定
参照GB 4789.2—2016《食品微生物学检验 菌落总数测定》[17]进行菌落总数测定。1.0 mL发酵液用0.85%无菌生理盐水经10 倍梯度稀释后涂布于MRS平板上,37 ℃倒置培养48 h。酸度计测定泡菜液pH值。
1.3.3 有机酸分析
采用HPLC仪测定泡菜发酵液中乳酸、柠檬酸、乙酸和苹果酸。收集发酵盐卤,6 000 r/min离心5 min后取上清液,经0.45 μm微孔滤膜过滤后备用。色谱条件基于Xiong Tao等[5]的方法进行优化改进。柱温40 ℃,流动相为6.00 mmol/L H2SO4溶液,流速0.5 mL/min,紫外吸收检测波长210 nm,进样量10.0 μL。4 种有机酸标准品作外标,比较保留时间和峰面积,表征和定量泡菜发酵液中有机酸种类和含量。
1.3.4 挥发性物质分析
挥发性物质提取和检测条件参照蒋丽等[18]的方法进行优化改进。顶空固相微萃取法提取挥发性化合物,气相色谱-质谱法对其进行分离和定性。
挥发性物质富集:15 mL顶空进样瓶中加入5.00 mL样品、2.00 g NaCl和C7~C40饱和烷烃标准品,加盖密封,40 ℃水浴平衡5 min后,将75 μm CAR/PDMS萃取头插入顶空瓶吸附40 min,萃取后将纤维头插入气相色谱系统解吸3 min。
色谱-质谱条件:D B-5 M S毛细管色谱柱(30 m×250 μm,0.25 μm),进样口温度250 ℃;程序升温40 ℃保持3 min,然后15 ℃/min升温至120 ℃,保持5 min,以20 ℃/min升温至230 ℃,保持5 min。He为载气,流速1.0 mL/min,不分流。电子电离源;电子能量70 eV;离子源温度230 ℃,接口温度280 ℃;扫描范围m/z 40~400。
数据分析:由气相色谱-质谱分析得到的质谱数据经计算机在NIST、Wiley检索比对,要求匹配度大于800(最大值为1 000)。C7~C40饱和烷烃为混标,采用半定量的方法计算各挥发性物质含量。
1.3.5 感官分析
组织有品评经验的品评员(男10 名,女10 名)对泡菜样品进行感官评定。感官指标包括色泽(具有四川泡菜应有的色泽)、香气(具有四川泡菜应有的香气(蔬菜香味和复合香味)、滋味(滋味可口、酸咸适宜、无涩味和腐败等异味)、体态(液汁清亮、组织致密、质地脆嫩)4 个方面8 个指标(色泽、形态、涩味、酸度、脆性、腐败气味、复合香味和蔬菜香味)。评分强度0~9(0:无;1~2:非常弱;3~4:普通;5~6:较好;7~8:好;9:很好)。
1.4 数据统计
2 结果与分析
2.1 pH值和微生物分析
在接种发酵过程中,3 种接种方式泡菜液的pH值在发酵前3 d呈快速下降趋势,然后缓慢下降,直至稳定在3.0~3.5间波动(图1A)。其中,接种食窦魏斯氏菌的泡菜液pH值从8.0下降至3.44;接种植物乳杆菌的泡菜液pH值从7.70下降至3.16,而二者混合发酵的四川泡菜液pH值从7.80下降到3.02。该研究结果与张其圣等[19]报道的泡菜pH值变化规律一致。然而,在发酵前期(0~3 d),食窦魏斯氏菌单独发酵和其协同植物乳杆菌发酵的pH值下降速度明显比植物乳杆菌单独发酵快。Xiong Tao等[10]认为异型发酵乳酸菌在泡菜早期酸化速度比同型发酵乳酸菌快。食窦魏斯氏菌是典型的异型乳酸发酵菌株,在蔬菜发酵过程中能够快速发酵多种底物生成有机酸。因此,接种食窦魏斯氏菌泡菜的pH值,比单独接种植物乳杆菌的泡菜pH值下降更快。

图1 四川泡菜发酵过程中pH值(A)和菌落总数(B)的变化趋势Fig. 1 Changes in pH (A) and total bacterial count (B) in Sichuan pickle during fermentation
泡菜发酵初期,食窦魏斯氏菌和植物乳杆菌都能够很好地代谢豇豆中的有机质,表现了较强的生长能力。初期单独接种食窦魏斯氏菌的菌落总数高于单独接种植物乳杆菌;协同发酵的菌落总数明显高于二者单独接种(图1B)。蔬菜启动发酵阶段,异型乳酸菌繁殖快[20],因此单独接种食窦魏斯氏菌的菌落总数高于单独接种植物乳杆菌。但由于食窦魏斯氏菌的耐酸性较植物乳杆菌弱[19-21],故随着发酵进行,其菌落数由8.02(lg(CFU/mL))逐渐减少到5.87(lg(CFU/mL))。异型乳酸发酵是蔬菜发酵的重要环节,不仅可以快速启动发酵,还可以快速改变发酵环境,促进同型乳酸菌的快速繁殖[22]。尽管随着发酵进行,食窦魏斯氏菌的数量会降低,但其代谢产物促进了植物乳杆菌的快速繁殖,因此协同发酵液中的菌落总数不会随食窦魏斯氏菌数量降低而降低,相反其菌落总数会维持在一定数量,直至发酵结束。
2.2 有机酸分析
有机酸在发酵蔬菜的整体风味中起着重要作用,其含量和种类会影响泡菜品质,包括味道、颜色和风味[23]。乳酸、柠檬酸、苹果酸和乙酸是泡菜发酵过程中生成的主要有机酸,不仅赋予泡菜酸爽味道和特殊的清新风味,更重要的是还能控制发酵过程中腐败微生物的生长和繁殖[24]。

图2 四川泡菜发酵过程中有机酸含量变化Fig. 2 Changes in organic acid contents in Sichuan pickle during fermentation
乳酸是四川泡菜发酵过程中生成的最主要有机酸。同型发酵乳酸菌通过糖发酵途径产生唯一代谢终产物乳酸[25],异型发酵乳酸菌通过6-磷酸葡萄糖代谢途径不仅生成乳酸,还产生乙酸、乙醇等其他代谢产物[3]。接种食窦魏斯氏菌,能够明显促进发酵前期协同代谢组中乳酸的生成,在第3天,协同发酵泡菜液中的乳酸质量浓度达到10.9 g/L,高于其他两组(图2A)。食窦魏斯氏菌是异型发酵乳酸菌,在泡菜发酵初期非常活跃,尽管产生乳酸能力较弱,但它的代谢活动会促进植物乳杆菌的快速繁殖和乳酸代谢,因而乳酸含量高。随着发酵进行,协同发酵中乳酸含量呈现下降趋势,发酵结束后与植物乳杆菌单独发酵四川泡菜中的乳酸含量基本相当。
柠檬酸和苹果酸也是发酵蔬菜中的重要有机酸。在发酵过程中,柠檬酸可进一步分解成某些利于氨基酸和风味物质形成的终产物[22],如乙醛和二乙酰等。接种食窦魏斯氏菌,能够明显提高协同发酵组对柠檬酸的利用率(图2B),发酵第7天时,协同发酵组中柠檬酸质量浓度为0.235 g/L,低于单独接种植物乳杆菌和食窦魏斯氏菌。接种食窦魏斯氏菌的协同发酵组,初始产生较多的苹果酸(图2C)。苹果酸在发酵过程中可进一步转化成乳酸和二氧化碳[5]。因此,伴随发酵进行,3 组发酵液中苹果酸均表现出下降趋势(图2C)。发酵结束后,协同发酵组、植物乳杆菌和食窦魏斯氏菌组中的苹果酸质量浓度分别为0.055、0.050 g/L和0.033 g/L。
泡菜中的乙酸主要来源于乳酸菌的异型发酵[22],由图2D可知,乙酸含量变化趋势在3 种泡菜中相似。但是,协同发酵组乙酸含量在发酵过程中整体高于植物乳杆菌组。发酵后期,一部分乙酸参与酯化反应,生成一系列酯类等风味物质[26],导致发酵结束后三者差异不大,但食窦魏斯氏菌与植物乳杆菌协同发酵的终产物更丰富,对泡菜风味影响更大。
2.3 挥发性物质分析
风味是发酵食品最重要的特性之一,也是决定其消费可接受性和偏好性的重要因素[27]。在当前研究中,发酵7 d的3 种泡菜液中共检测到32 种挥发性物质,包括酯类、醇类、醛类、烯类、酮类和其他化合物(表1)。食窦魏斯氏菌协同植物乳杆菌发酵,不仅可以增加挥发性物质的种类,同时还能明显提高挥发性物质含量。食窦魏斯氏菌组和植物乳杆菌组中分别检出挥发性物质20 种和22 种;协同发酵组中检出挥发性物质27 种,新增乙酸异戊酯、丙酸-2-丙烯酯、乙酸松油脂、2,4-二甲基苯甲醛、大马酮和4-乙基-2-甲氧基苯酚6 种挥发性化合物。协同发酵液中挥发性化合物的总量为6.096 mg/L,高于植物乳杆菌组(3.188 mg/L)和食窦魏斯氏菌组(2.01 mg/L)。图3为共有挥发性物质含量差异性分析。

表1 接种不同发酵剂对四川泡菜挥发性成分含量的影响Table 1 Effects of different starter cultures on volatile components in Sichuan pickle
醇类是构成四川泡菜特征风味的一类重要化合物,是酯化反应的重要前体物质[28],还可进一步氧化成醛类、酸类等。醇主要来源于微生物发酵和氨基酸代谢,在泡菜中通常呈现出令人愉快的香味及甜味。在发酵7 d的泡菜液中,植物乳杆菌代谢产生了8 种醇,食窦魏斯氏菌代谢产生了9 种醇,二者协同并没有增加醇的种类,但是明显增加了醇类含量。协同发酵组中醇类总量为5.18 mg/L,食窦魏斯氏菌组和植物乳杆菌组则分别为1.742 mg/L和2.800 mg/L。4-萜烯醇、桉叶油醇、芳樟醇和松油醇是含量较高的醇类(表1),这些醇不仅能够赋予泡菜柔和香味,而且还能与乳酸菌代谢氨基酸生成的苯乳酸和乙酸苯酯、苯乙醇等物质协同或反应,呈现更为愉悦的风味或生成更加复杂的呈味物质[29]。在4 种含量较高的醇中,4-萜烯醇含量最高,在协同发酵组中约为1.642 mg/L,植物乳杆菌组中为1.014 mg/L,食窦魏斯氏组中为0.585 mg/L;桉叶油醇协同增效最明显,协同发酵组中桉叶油醇(1.835 mg/L)含量比植物乳杆菌组(0.794 mg/L)和食窦魏斯氏组(0.376 mg/L),分别增加131.11%和388.03%。正辛醇呈现油脂、草香味,植物乳杆菌代谢不能生成正辛醇,食窦魏斯氏菌代谢生成0.002 mg/L的正辛醇,但二者协同提高至0.006 mg/L。

图3 共有挥发性物质含量的差异分析Fig. 3 Analysis of volatile components that differed between mixed and pure fermentations
酯类是泡菜中的另一类重要化合物,在泡菜中呈现怡人的甜味、水果香和花香[28]。在3 种发酵液中,协同发酵组中酯类质量浓度为0.417 mg/L,显著高于单独发酵组(表1)。乙酸乙酯、异丁酸丁酯、丁酸丁酯在协同发酵组中的含量明显高于单独发酵组的含量。其中,乙酸乙酯(水果香)在协同发酵组质量浓度最高,为0.139 mg/L。此外,具有明显的水果香味和花香的乙酸异戊酯、丙酸-2-丙烯酯和乙酸松油酯只在协同发酵组中检出。因此,食窦魏斯氏菌与植物乳杆菌协同发酵促进了泡菜中酯类物质的生成。
研究者认为,C8~C12的饱和醛具有较好的风味[30]。在协同发酵组中,没有检测到具有刺激性味道的低碳乙醛,但检测到了2,4-二甲基苯甲醛,尽管其质量浓度低(0.008 mg/L),但它的存在对风味具有重要影响[29]。
此外,豇豆原料本身还含有某些挥发性物质,如左旋香芹酮、水芹烯和莰烯等,这些物质在协同发酵过程中尽管有所消耗,但并未消耗殆尽。因此,协同发酵不仅赋予了泡菜特有的香味,也使泡菜具有一定的蔬菜原香。
2.4 感官品质评价
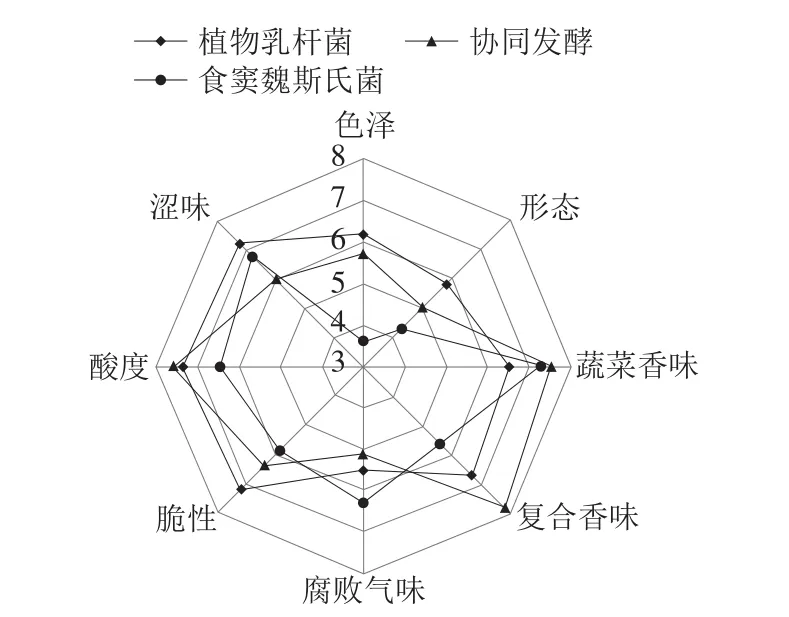
图4 不同发酵剂发酵的四川泡菜感官品质评价Fig. 4 Sensory characteristics of Sichuan pickles fermented with different starter cultures
对实验组四川泡菜进行感官分析,评价其感官品质,图4表明,食窦魏斯氏菌协同植物乳杆菌发酵泡菜,尽管脆性、涩味描述分数低于接种植物乳杆菌组,但其具有明显成熟泡菜酸鲜口感。同时,协同发酵组比单独发酵组的泡菜更具愉悦香气与和谐口感。此外,协同发酵组在蔬菜香味(7.5 分)和复合香味(7.8 分)方面也优于单菌发酵组。说明食窦魏斯氏菌协同植物乳杆菌能够明显改善植物乳杆菌发酵泡菜的风味。
3 结 论
异型乳酸发酵食窦魏斯氏菌协同植物乳杆菌用于四川泡菜生产时,能够快速启动泡菜发酵,促进乳酸菌快速繁殖,增加发酵初期乳酸含量,防止腐败菌滋生。同时,食窦魏斯氏菌协同植物乳杆菌发酵四川泡菜,能够明显提高泡菜产品中挥发性风味物质的种类和含量,明显改善植物乳杆菌发酵泡菜的风味,赋予更加爽口、酸香口感。本研究为四川泡菜工业化生产,应用食窦魏斯氏菌改善植物乳杆菌泡菜产品风味、提高产品质量,提供了前期基础和理论依据。
