盐应激对大肠杆菌O157:H7存活和毒力基因表达的影响
2020-07-23余兰林姬赛赛禹金龙付文静李蛟龙
余兰林,姬赛赛,禹金龙,付文静,张 林,李蛟龙,高 峰,江 芸,*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.南京师范大学食品与制药工程学院,江苏 南京 210023)
大肠杆菌O157:H7(Escherichia coli O157:H7)是主要食源性致病菌之一,可通过污染的食物和水源传播,其感染剂量低、致病力较强,人体感染后引起腹泻、出血性结肠炎和溶血性尿毒综合症等[1-2]。该菌最主要毒力因子是志贺毒素(Shiga toxin,Stx),由stx1和stx2基因编码,可造成内皮细胞和肾小管细胞的损伤,导致急性肾功能衰竭。此外,eae基因编码的紧密茹附素,可使病原菌茹附在肠细胞上从而引起茹附-脱落损伤;hly编码肠溶血素,是引起肠外损伤的重要毒力因子,对淋巴细胞、粒细胞、红细胞及静脉管状细胞等都有影响[3-4]。
食品加工和贮藏过程中涉及多种处理方法,如加热、干燥、冷藏冷冻、酸化、腌制、使用防腐剂等,这些处理对微生物造成胁迫,抑制甚至杀灭有害微生物,从而延长食品货架期。添加食盐是其中常见的一种手段,可降低水分活度,低水分活度可导致细菌质壁分离,影响大肠杆菌糖类主动转运和DNA复制[5],不利于微生物的生长繁殖,但也有研究发现大肠杆菌O157:H7等致病菌在低水分活度食品中可长期存活[6]。研究表明,环境应激不仅影响致病菌的存活,还使其毒力特性发生改变,有研究发现应激可导致致病菌毒力基因的表达增加,但也有研究报道应激后致病菌毒力基因的表达下降或无显著变化[3,7-8]。含盐食品中肠出血性大肠杆菌引发人群感染事件时有发生,如发酵香肠、奶酪、腌菜、沙拉等[9-12],这些事件表明盐应激下大肠杆菌O157:H7仍存在较大安全风险,探讨盐应激下大肠杆菌O157:H7存活与毒力的相关性,具有重要的科学意义。盐应激对大肠杆菌O157:H7毒力特性的影响也有不同报道,Harris等[13]发现LB(Luria-Bertani)肉汤培养基中添加2% NaCl增加了stx2基因表达,但添加3% NaCl对stx2表达量无影响。Olesen等[14]研究发现4.5%盐应激24 h显著增加了大肠杆菌O157:H7 EDL933菌株毒力基因(eae、stx1A、stx2A和tir)的表达,但却抑制了另外2 株STEC(O157:H7和O157:H-)毒力基因表达,存在菌株差异。目前,关于较高NaCl添加量对食源性致病菌毒力的影响少见报道,如一些腌制肉制品、酱料中含盐量高达15%以上。因此本研究以本实验室收集的3 株大肠杆菌O157:H7产毒菌株为对象,探讨较高NaCl添加量应激对菌株存活和毒力基因表达的影响,进一步分析其存活与毒力变化之间的相关性,以期为实际含盐食品风险评估提供科学依据。关于NaCl添加量应激水平的设立有不同报道,在胰蛋白胨大豆肉汤(tryptic soy broth,TSB)或LB培养基基础上,设有1%~3%[13]、2%~5.5%[15]、3.5%~8.5%[16]、0.5%~8.5%[17]、3%~18%[18]等不同NaCl水平,因此本实验设立6、12、18 g/100 mL NaCl水平作为较高NaCl添加量应激条件。
1 材料与方法
1.1 材料与试剂
3 株大肠杆菌O157:H7来源及携带毒力基因情况如下:大肠杆菌O157:H7菌株CICC21530(stx1+、stx2+、eae+、hly+)购于中国工业微生物菌种保藏管理中心;大肠杆菌O157:H7菌株95(stx1+、hly+)和菌株109(eae+、hly+)由南京农业大学江苏省动物源食品生产与安全保障重点实验室惠赠。
TSB、胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、酵母浸粉(yeast extract,YE) 北京陆桥技术股份有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、pH值校正缓冲溶液、乳酸(分析纯) 南京化学试剂有限公司;Trizol试剂、mRNA反转录试剂盒RR036A、实时聚合酶链反应(real-time polymerase chain reaction,real-time PCR)试剂盒RR430A 大连宝生物工程有限公司;实验用引物均由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
2-16KL型高速冷冻离心机 美国Sigma公司;HD-3A型水分活度测量仪 无锡市华科仪器仪表有限公司;GL-ZZM型高速冷冻离心机 赛特湘仪离心机仪器有限公司;DHP-9052型电热恒温培养箱 上海一恒科技有限公司;ZQTY-70型台式振荡培养箱 上海知楚仪器有限公司;SW-CJ-2F型超净工作台 苏州安泰空气技术有限公司;SG403A型生物安全柜 美国Baker公司;NANODROP-2000核酸蛋白分析仪 美国Thermo Scientific公司;ABI7500荧光定量PCR仪 美国Applied Biosystems公司;Mastercycler普通PCR仪 德国Eppendorf公司。
1.3 方法
1.3.1 盐溶液制备及水分活度测定
正常TSB培养基中分别添加0、6、12、18 g/100 mL NaCl,高压蒸汽灭菌后备用。按水分活度仪操作说明,将上述样品置于25 ℃环境中平衡6 h,然后在该环境下用水分测量仪测量每组样品的水分活度值,每组设3 个重复,取平均值。
1.3.2 菌株活化和菌悬液制备
将-80 ℃冰箱保藏的3 株大肠杆菌O157:H7于TSA培养基划线,37 ℃培养24 h;挑取TSA平板中的单菌落于TSB液体培养基中,37 ℃摇床振荡培养18~20 h(200 r/min),然后吸取1 mL菌液于100 mL TSB液体培养基中,继续37 ℃摇床振荡培养18 h。
1.3.3 盐应激处理
取10 mL菌悬液,9 000×g、4 ℃离心5 min,去除上清液,沉淀用等体积PBS洗涤2 次,10 mLPBS重悬。吸取100 μL菌液于10 mL上述4 种TSB培养基中,涡旋均匀,初始菌量约为7(lg(CFU/mL))。静置于25 ℃生化培养箱中,分别于0、3、6、9、12、24、36、48 h和72 h取出,立即离心,沉淀用PBS洗涤重悬2 次,终止应激。梯度稀释后涂布于TSA-YE,37 ℃培养24 h平板计数。实验重复3 次,取平均值。
1.3.4 毒力基因表达测定
大肠杆菌O157:H7按1.3.3节方法进行盐应激处理,涡旋,静置于25 ℃生化培养箱中,培养时间根据上述存活情况确定,离心洗涤,收集菌株沉淀,液氮速冻后,-80 ℃保存备用。
总RNA提取:按照试剂盒说明书提取菌体RNA,并用NANODROP 1000分光光度计检测所提取的总RNA浓度和纯度,使RNA样本OD260nm/OD280nm在1.8~2.0之间。
反转录用PrimeScriptTMRT Master Mix反转录试剂盒进行。为保证反转录效应,RNase-free DNase I去除基因组DNA。反转录体系为30 μL,其中6 μL PrimeScrept RT Master Mix,total RNA终质量浓度50 ng/μL,RNase Free dH2O补足体积。反转录条件:37 ℃反转录反应15 min;85 ℃反转录酶失活反应5 s;4 ℃,∞。合成的cDNA置于-20 ℃冰箱长期保存。
real-time PCR用SYBR Premix ExTaqTMII(Perfect Real Time)试剂盒(大连宝生物工程有限公司),在real-time PCR仪上进行。采用Primer Primer 6.0和Beacon designer软件进行荧光引物的设计,由生工生物工程(上海)有限公司负责引物的合成,引物序列如表1所示[19],用于扩增大肠杆菌O157:H7的stx1、stx2、eae、hly4 种毒力基因,内参基因为16S rRNA基因。PCR扩增体系(20 μL)为:10 μL SYBR Premix ExTaq(2×),0.4 μL ROX Reference Dye II(50×),1.0 μL cDNA模板,上下游引物:各0.4 μL,7.8 μL RNase Free水。PCR程序:95 ℃预变性30 s(1 次循环);95 ℃变性5 s,60 ℃退火和延伸34 s(40 个循环);熔解:95 ℃、15 s,60 ℃、1 min,95 ℃、15 s(1 次循环)。

表1 引物序列及产物大小Table 1 Primer sequences and size of PCR amplification products
1.4 数据分析
菌株存活数用lg(CFU/mL)表示,荧光定量毒力基因相对表达水平以2-ΔΔCt进行统计分析。所有实验均做3 次重复。采用SPSS V17.0 ANOVA进行单因素方差分析,结果显著性使用Duncan多重比较检验,P<0.05,差异显著。
2 结果与分析
2.1 水分活度

表2 不同NaCl添加量TSB培养基的水分活度Table 2 Water activity in TSB medium with different concentrations of salt
由表2可知,NaCl的添加降低了TSB培养基水分活度,且NaCl添加量越高,水分活度越低,添加12 g/100 mL和18 g/100 mL NaCl的TSB培养基水分活度显著低于正常TSB培养基(P<0.05)。
2.2 盐应激对大肠杆菌O157:H7存活的影响
由图1A可知,当TSB培养基添加一定量NaCl时,菌株CICC21530随应激时间延长存活菌数均逐渐下降,与正常TSB培养基(0 g/100 mL NaCl组)相比,NaCl添加量越高菌数下降越明显,应激36 h后18 g/100 mL NaCl组己检测不出菌数,显著低于其他2 个TSB培养基加盐组(P<0.05)。由图1B可知,各TSB培养基加盐组菌株95的存活菌数随时间延长低于正常TSB培养基组,其中18 g/100 mL NaCl组菌数逐渐呈下降趋势,而其他2 个加盐组呈现波动变化,应激36 h后NaCl添加量越高存活菌数越低。由图1C可知,各TSB培养基加盐组菌株109的存活菌数随时间延长低于正常TSB培养基组,3 个加盐组均呈现波动变化,应激36 h后6 g/100 mL NaCl组菌数显著低于12 g/100 mL和18 g/100 mL NaCl组。
综合3 株大肠杆菌O157:H7存活情况,结果表明盐应激显著抑制了细菌生长,但抑制效应呈现明显菌株差异。另外,不同NaCl添加量对3 株菌的影响亦不同,菌株CICC21530 NaCl添加量越高抑制越明显,18 g/100 mL NaCl组抑制效应最显著,而其他两株菌则呈现波动性变化。
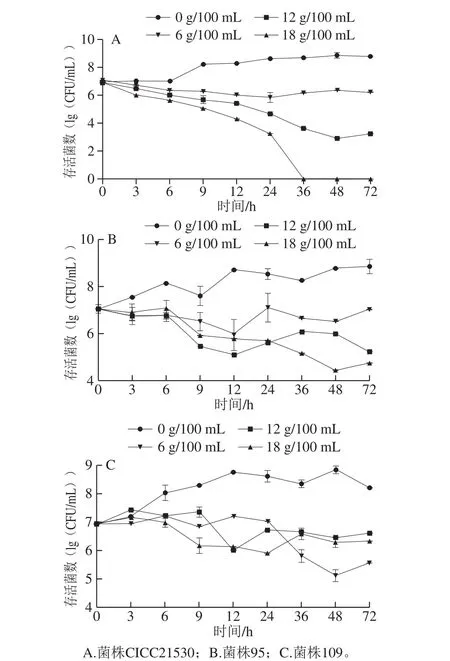
图1 大肠杆菌O157:H7不同NaCl添加量TSB培养基中的存活菌数Fig. 1 Survival curves of E. coli O157:H7 in TSB medium with different amounts of salt added
2.3 大肠杆菌O157:H7毒力基因表达情况


图2 大肠杆菌O157:H7菌株CICC21530在不同NaCl添加量TSB培养基中应激24 h的毒力基因表达水平Fig. 2 Expression levels of virulence genes of E. coli O157:H7 strain CICC21530 cultured in TSB medium with different concentrations of salt for 24 h
根据上述存活情况,应激36 h的菌株CICC21530 18 g/100 mL NaCl组己检测不出,其他两株菌应激过程中呈波动变化,故进一步分析盐应激24 h的毒力基因表达情况。菌株CICC21530盐应激24 h后毒力基因表达情况如图2所示。与正常TSB培养基(0 g/100 mL组)相比,应激24 h的6 g/100 mL和18 g/100 mL NaCl组stx1表达量均显著增加(P<0.05),而12 g/100 mL NaCl组无显著差异;应激24 h的12 g/100 mL和18 g/100 mL NaCl组stx2表达量均显著高于对照组(P<0.05),6 g/100 mL NaCl组无显著差异;盐应激组eae和hly表达量均显著增加(P<0.05),且表达量随NaCl添加量增加而增加。结果表明,盐应激导致菌株CICC21530四种毒力基因表达量普遍增加,但NaCl添加量不同对毒力基因的影响不完全一致,18 g/100 mL NaCl组4 种毒力基因表达量均显著高于其他处理组。
由图3可知,与对照组相比,应激24 h的18 g/100 mL NaCl组stx1表达量显著增加(P<0.05),而6 g/100 mL和12 g/100 mL NaCl组显著低于对照组(P<0.05);18 g/100 mL NaCl组eae表达量显著高于对照组(P<0.05),而6 g/100 mL和12 g/100 mL NaCl组无显著变化。结果表明,菌株95盐应激24 h后,不同NaCl添加量对其毒力基因产生了不同的影响,18 g/100 mL NaCl组2 种毒力基因表达量均显著高于其他处理组。

图3 大肠杆菌O157:H7菌株95在不同NaCl添加量TSB培养基中应激24 h的毒力基因表达水平Fig. 3 Expression levels of virulence genes of E. coli O157:H7 strain 95 cultured in TSB medium with different concentrations of salt for 24 h

图4 大肠杆菌O157:H7菌株109在不同NaCl添加量TSB培养基中应激24 h的毒力基因表达水平Fig. 4 Expression levels of virulence genes of E. coli O157:H7 strain 109 cultured in TSB medium with different concentrations of salt for 24 h
由图4可知,与对照组相比,6 g/100 mL NaCl组无显著性差异(P>0.05),而12 g/100 mL和18 g/100 mL NaCl组eae和hly表达量均显著增加(P<0.05),且12 g/100 mL NaCl组表达量最高。
综合3 株大肠杆菌O157:H7毒力基因表达情况,结果表明盐应激对毒力基因的表达产生了影响,不同NaCl添加量导致的影响不同;另外,不同菌株表达量的变化亦不完全一致,其中菌株CICC21530和菌株95于18 g/100 mL NaCl组各毒力基因表达量最高,而菌株109则于12 g/100 mL NaCl组毒力基因表达量最高。
进一步综合存活菌数和毒力基因表达两方面,发现添加盐显著抑制了细菌存活,但毒力基因表达有加盐组显著增加,即相对毒性增强。另外不同NaCl添加量应激时细菌存活和毒力基因表达存在菌株差异,18 g/100 mL NaCl组菌株CICC21530存活数显著下降,但毒力基因的相对表达量反而显著增加;其他两株菌存活菌数呈波动性变化,菌株95的18 g/100 mL NaCl组表达量亦最高,菌株109却是12 g/100 mL NaCl组表达量最高,表明盐应激时大肠杆菌O157:H7存活与毒力基因表达的变化不完全一致。
3 讨 论
食盐不仅是最重要的调味料,食品加工中添加盐,通过降低水分活度还可抑制微生物,一直被广泛用于食品保鲜,且普遍认为高浓度盐抑制效应更好,能够完全杀死或抑制污染的细菌生长[20-21]。盐的添加造成微生物应激反应,一方面,微生物都有其生长的最适水分活度,NaCl添加量增加导致水分活度降低,微生物生长速率也随之下降;另一方面,NaCl添加量增加引起的渗透压升高会导致水分子单方向从细胞质向细胞内膜移动,造成细胞失水,影响微生物生长代谢[20,22]。关于盐应激对大肠杆菌O157:H7存活影响己有较多报道,Hosein等[23]指出LB肉汤中添加2%和4%的NaCl降低了大肠杆菌O157:H7的数量,但未对菌株产生完全致死效应。Glass等[24]研究发现该致病菌在NaCl添加量为2.5%的TSB培养基中正常生长,但NaCl添加量为4.5%和6.5%时生长受到抑制,大于6.5%时(即8.5%和10.5%)无法生长。Stasic等[25]则发现大肠杆菌O157:H7在NaCl添加量12%的LB培养基中可以存活。本实验TSB培养基添加NaCl后3 株大肠杆菌O157:H7存活数均下降,但3 株菌下降程度不相同,18 g/100 mL加盐组菌株CICC21530处理第36小时检测不出,而其他2 株菌仍存活。上述不同研究报道表明NaCl对大肠杆菌O157:H7的抑制作用,与不同菌株、NaCl添加量及培养条件有关。本实验还发现盐应激过程中存活菌数有波动,且高质量浓度NaCl添加组存活菌数并不一定低于低质量浓度NaCl添加组,这与Osaili等[26]研究大肠杆菌O157:H7在含10%、15% NaCl奶酪盐水中的存活情况相似。大肠杆菌O157:H7在盐应激环境中,可能通过自身渗透压调控系统将应激信息传递,激活相关酶和膜上转运蛋白的活性,同时对特定基因表达进行调整,从而维持细胞渗透压稳定,缓解应激反应[25,27-28]。
当致病菌处于一种应激环境时,会诱导一系列应激反应,应激反应将会引起细菌生长动力学、营养代谢、细胞结构、应激反应和毒力特性的变化[8,14,29],毒力特性的变化必将进一步影响食品安全。关于食品中不同应激环境对致病菌毒力的影响有不同报道,如:Elhanafi等[3]报道大肠杆菌在酸性培养基生长时增加了eaeA和hlyA基因表达,但冷或冷-酸应激对Stx2毒素量没有影响。Huang等[30]指出酸应激增加了大肠杆菌O157:H7菌株毒力特性。氧化应激增加了大肠杆菌O157:H7毒力基因stx1和stx2表达水平,但对eae表达量无影响[31]。而热休克大肠杆菌O157:H7与室温对照组相比,多数毒力基因(stx1、stx2、hly等)表现为下调[19]。关于盐应激对产Stx大肠杆菌毒力特性影响报道中,Vero细胞实验表明,产Stx大肠杆菌O157:H7接种香肠,发酵和干燥(pH 4.9,水分活度0.92)8 d增加了肠毒素(Stx1和Stx2)产生[32]。与环境应激相关的渗透压应激(水分活度0.95~0.98)增加了non-O157菌株stx1、stx2和eae的mRNA表达水平,但对O157:H7菌株毒力影响不显著[16]。Park等[33]转录组学结果显示盐应激(0.6 mol/L NaCl)对大肠杆菌O157:H7 Stx相关基因表达均有下调作用。且Olesen等[14]结果表明,盐应激显著增加了大肠杆菌O157:H7 EDL933菌株毒力基因表达,但却抑制了另外2 株STEC毒力基因表达,存在菌株差异。因此盐应激可能影响菌株毒力基因的表达,但研究报道不完全一致,分析原因可能是毒力变化情况与不同NaCl添加量等应激条件、菌种、菌株有关。本研究结果显示,与对照组相比,盐应激24 h时,3 株菌株6 g/100 mL NaCl组毒力基因变化没有明显的规律,而菌株CICC21530、菌株95的18 g/100 mL NaCl组和菌株109的12、18 g/100 mL NaCl组均显著高于其他各应激组,即高盐应激时对菌株毒力有增强作用。致病菌相关毒力基因的转录表达可能与盐应激相关基因的调控有关[14,19],其具体机制有待进一步研究。本实验结果表明大肠杆菌O157:H7有毒菌株在含盐食品中的存活及其毒力特性的增强,将对食品安全造成潜在威胁。
4 结 论
盐应激显著抑制大肠杆菌O157:H7的存活,抑制效应与菌株、NaCl添加量有关。盐应激时大肠杆菌O157:H7毒力基因表达的变化也与菌株、NaCl添加量有关,较高盐量时,3 株菌存活数显著降低的同时,毒力基因表达量却显著增加,即相对毒性增强。上述结果表明在实际含盐食品风险评估中,不仅要关注存活菌量,还需重视残存菌的毒力水平,从而更科学全面地评估大肠杆菌O157:H7的安全风险。
