基于菌株水平肠道内植物乳杆菌定性定量研究方法的建立
2020-07-23姜帅铭马臣臣游政凯张家超
姜帅铭,马臣臣,游政凯,张家超
(海南大学食品科学与工程学院,海南 海口 570228)
随着近年对益生菌[1]研究的不断深入,益生菌在医学、食品行业以及畜牧业等领域都有广泛应用[2-3],而益生菌的主要作用靶点便是肠道,在近十年里对肠道微生物的认知更是有了极大提高。肠道微生物数量庞大,基因数量大约是人类基因组数量的100 倍[4],这些微生物的结构和组成同时影响着宿主的营养加工、免疫功能、胃肠道发育及其他多种生理活动[5-6],且可以通过饮食、手术或抗生素人为干预改变[7]。肠道微生物的失衡与各类疾病有着千丝万缕的联系,如肾脏疾病[8]、代谢疾病[9]、心血管疾病[10]及神经疾病[11]等。目前,肠道成为了预测疾病甚至干预疾病的新“靶点”[12],而益生菌更是成为塑造微生物群落组成和功能、预治疾病的“新工具”。
双歧杆菌和乳杆菌为最常见的益生菌菌属[13],其中,属于乳杆菌属的植物乳杆菌(Lactobacillus plantarum),具有免疫调节、降低血清胆固醇含量、抑制动脉粥样硬化、维持肠道内菌群平衡[14]、促进营养物质吸收及缓解乳糖不耐症等功能[15]。而益生菌是否真正发挥益生作用还要基于菌株水平进行考量,L. plantarum ZDY04菌株可以通过调节小鼠中Lachnospiraceae、Erysipelotrichaceae、Bacteroidaceae科和Mucispirillum属的相对丰度,显著降低血清氧化三甲胺和盲肠三甲胺水平,从而抑制动脉粥样硬化[16]。Malik等[17]对20 例冠心病患者每日补充L. plantarum菌株299v持续6 周,发现可改善患者冠心病血管内皮功能、降低炎症。L. plantarum P8被证明可缓解压力和焦虑,改善记忆认知[18]。以上研究对L. plantarum益生功效的研究都基于菌株水平进行评估。而益生菌是否能够活着进入肠道,并在其中发挥作用,甚至定植于肠道[19],是判断益生菌是否具有益生功效的主要标准。
鉴于目前业界对菌株水平益生菌功效评价的共识[20-22],在开展肠道内益生菌相关研究时,需要基于菌株水平对其进行定性定量分析,定性判断是否活着进入肠道,定量判断是否达到一定剂量。目前基于菌株水平对益生菌在肠道内定性和定量评价相关研究报道仍较匮乏,也尚未建立合理有效的评价方法。而传统分离培养的方法效率低且无法从外观形态鉴定到菌株水平,因此建立对益生乳杆菌基于菌株水平的定性定量分析方法尤为重要。
本研究以1 株具有潜在益生功效的L. plantarum HNU082为例,对其在菌株水平上基于肠道定性以及定量分析,建立宿主肠道内L. plantarum HNU082菌株水平的定性定量研究方法,每个菌株都具有自己独特的基因特征,这也是从肠道内能够将该菌株找到的理论依据[23]。首先从基因层面找到该菌株特异性片段,设计特异性引物,同时注释抗生素相关抗性基因,并对其进行验证,找到其能耐受的抗生素及最小耐受浓度[24],利用抗生素对粪便中的微生物进行第一步筛选,并分离筛选疑似菌落,而后用特异性引物扩增该菌株用于在肠道水平上的定性,并通过实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)定量分析。real-time PCR用于特定基因片段的定量研究己经有大量文献报道,有一定的准确性[25]。最后用实例对该定性定量方法验证。本研究旨在建立完善宿主肠道内L. plantarum HNU082定性定量研究方法,为肠道内对益生菌的益生功效评价以及益生菌产品功效评价提供新的衡量指标,也将为益生乳杆菌的体内研究方法提供重要理论支持。
1 材料与方法
1.1 材料与试剂
L. plantarum HNU082于2016年分离自海南特色发酵鱼茶样本[26],23 种参考菌株分离自海南特色发酵蔬菜[27]及海南特色发酵海产品样本中[28],保藏于海南大学食品学院热带有益微生物菌种资源库,用于特异性引物筛选。
MRS肉汤培养基 广东环凯微生物科技有限公司;诺氟沙星、盐酸克林霉素、红霉素、罗红霉素、盐酸四环素、氧四环素、盐酸万古霉素、羧苄青霉素钠、头孢唑啉钠、氯霉素、利福平 北京索莱宝科技有限公司;无水乙醇、氢氧化钠、氯化钠、酚、乙酸钠(均为分析纯) 广州化学试剂厂;甲醇、异丙醇、硼酸、氯仿、异戊醇(均为分析纯) 西陇科学股份有限公司;6×DNA loading buffer 北京康为世纪生物科技有限公司;2×Taq Master Mix 南京诺唯赞生物科技有限公司;核酸染料(Goldview) 美国Amerco公司;琼脂糖北京天根生化科技有限公司;琼脂 上海百赛生物技术有限公司;三羟甲基氨基甲烷(Tris)、十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)上海吉至生化科技有限公司;pUC-T TA cloning kit北京康为世纪生物科技有限公司。
1.2 仪器与设备
A300 Fast Thermal Cycler PCR扩增仪 杭州朗基科学仪器有限公司;SW-CJ-1C标准型双人净化工作台 苏州苏净集团公司;DYY-8C型电泳仪 北京市六一仪器厂;FA-1604电子天平 上海良平仪器仪表有限公司;AlphaImage HP型Cell Biosciences凝胶成像分析系统 美国Alpha Innotech公司;UV759紫外-可见分光光度计上海奥谱勒仪器有限公司;G154DW高压蒸汽灭菌锅厦门致微仪器有限公司;FST-RO精密型超纯水机 普利菲尔应用材料有限公司;85-1恒温磁力搅拌器 常州澳华仪器有限公司;生化培养箱 上海一恒科学仪器有限公司;StepOne Plus real-time PCR仪 美国应用生物系统公司;G20电动组织研磨器 生工生物工程(上海)股份有限公司。
1.3 方法
1.3.1L.plantarumHNU082定性分析
1.3.1.1L.plantarumHNU082基因水平分析
采用CTAB冻融法提取菌株DNA[29],并溶于TE(Tris-EDTA)缓冲液中,于-80 ℃保存,而后送样至上海美吉生物有限公司进行单分子PacBio测序分析,经过质控拼接后组装并进行基因预测,并与抗生素抗性基因数据库进行比对,找到其存在的抗生素抗性基因,注释后选取对应抗生素进行验证。与23 株NCBI数据库中己鉴定且有完整基因序列的L.plantarum进行同源基因聚类,找到L.plantarumHNU082特有的特异性片段用于特异性引物设计。
1.3.1.2 特异性片段设计及定性分析
同源基因聚类找到L.plantarumHNU082的特异性片段,通过Primer软件设计特异性引物,并利用实验室保存的其他菌株进行PCR扩增验证。经引物设计、验证等过程,选用A7作为HNU082的特异性引物,上游引物序列5’-TGTTTCGGTTAGATAGCGTGTC-3’,下游引物序列5’-TTAGCCCAACTACCTTCCTG-3’,扩增片段长度190 bp。反应体系50 μL:1 μL DNA模板,1 μL上游引物,1 μL下游引物,20 μLTaqMix,27 μL dd H2O。PCR条件:94 ℃预变性5 min;94 ℃变性1 min,62 ℃退火45 s,72 ℃延伸20 s,循环26 次;72 ℃末端延伸10 min。PCR扩增结果用1%琼脂糖凝胶进行检测。
1.3.2L.plantarumHNU082定量分析
1.3.2.1L.plantarumHNU082基因水平分析
实验步骤同1.3.1.1节。
1.3.2.2 real-time PCR和定量反应系统特异性评定
在ABI StepOne Plus real-time PCR仪上以待测样本DNA为模板,进行L.plantarumHNU082特异性引物的PCR扩增和检测。扩增程序:94 ℃预变性20 s;94 ℃变性5 s,58 ℃退火35 s,72 ℃延伸50 s,循环40 次。将溶解曲线设定从60 ℃缓慢加热至95 ℃,温度每增加0.2 ℃检测一次信号强度,进行连续荧光采集,得到熔融曲线。
2 结果与分析
2.1 L. plantarum HNU082全基因组水平分析
对菌株全基因组进行测序及基因预测(表1),该菌株基因组由1 条染色体和4 个质粒组成。染色体长度为3 303 679 bp,总GC含量为44.51%,共编码3 203 个开放阅读框。该菌株基因组编码了丰富的碳水化合物代谢基因和磷酸转移酶基因复合体,这些特点有利于该菌株在营养限制的环境中生长,也有利于该菌株在肠道内参与碳水化合物竞争时更具优势。

表1 基因预测结果Table 1 Gene prediction results
文献中己经测序全基因组L.plantarum的平均基因组大小约为3 200 kb,编码基因数量为3 000 个左右,平均GC含量为44.5%左右[30]。本实验所用参考菌株的基因组大小,编码基因数量更为丰富,而GC含量与其他NCBI中己鉴定的L.plantarum菌株基本一致。

图1 L. plantarum HNU082基因组图Fig. 1 Genome-wide map of L. plantarum HNU082
根据基因预测结果,用Circos v0.64软件绘制基因组圈图(图1)。圈图的最外圈为基因组大小的标识,每一个刻度为0.1 Mb;第2圈和第3圈为正链、负链上的编码区,不同颜色表示编码区不同的COG(clusters of orthologous groups of proteins)功能分类;第4圈为rRNA和tRNA;第5圈为GC含量,向外的红色部分表示该区域GC含量高于全基因组平均GC含量,峰值越高表示与平均GC含量差值越大,向内的蓝色部分表示该区域GC含量低于全基因组平均GC含量,峰值越高表示与平均GC含量差值越大;最内一圈为GC skew值,即为(G-C)/(G+C),在生物意义上该值为正值时正链越更倾向于转录编码区,为负值时负链更倾向于转录编码区。
2.2 抗性基因注释与验证
将L.plantarumHNU082的拼接序列与抗性基因数据库CARD(Comprehensive Antibiotic Research Database)比对,注释抗性基因并选取对应抗生素验证结果,由图2可见,L.plantarumHNU082对万古霉素及诺氟沙星的耐受性较好,最大耐受质量浓度可达到1 280 μg/mL,经平板验证后选取万古霉素与诺氟沙星作为屏蔽肠道中其他微生物的抗生素,具体验证过程见文献[24]。

图2 培养12 h不同抗生素浓度下L. plantarum HNU082吸光度Fig. 2 Absorbance of L. plantarum HNU082 with different concentrations of antibiotics after culture for 12 hours
多数乳酸菌都存在对万古霉素的先天性抗性基因,L.plantarum的细胞壁上一种五肽末端的D-丙氨酸残基被D-乳酸或D-丝氨酸取代,而D-乳酸或D-丝氨酸对糖肽类抗生素产生耐药性,阻止了万古霉素的结合,从而使菌株对万古霉素产生抗性[31]。因此,抗生素的选用只能杀灭部分粪便中的微生物,不能作为对粪便中L.plantarumHNU082定性筛选的指标。粪便中微生物经抗生素培养筛选后的单菌落仍需要特异性引物进行特异性扩增鉴别。
2.3 特异性引物设计及验证
首先从NCBI(National Center for Biotechnology Information)数据库选取与L.plantarumHNU082进化距离相近的23 株L.plantarum,并下载完整基因序列与标准菌株进行同源基因聚类,聚类结果如图3所示,中间重叠的部分指24 株菌株共有的基因,每一片“花瓣”边缘位置数字表示该菌株独有的基因数量,L.plantarumHNU082与其他菌株相比具有大量菌株特异性片段。

图3 同源基因聚类韦恩图Fig. 3 Venn map of homologous gene clustering
以L.plantarumHNU082独有的200 个基因片段为模板设计特异性引物,以实验室保存的L.plantarum提取的DNA为特异性检测模板,以L.plantarumHNU082提取的DNA为阳性对照,进行PCR扩增,检测方法的特异性。并利用实验室保存的L.plantarum进行验证(图4),L.plantarumHNU082在250 bp左右有明亮条带,其他L.plantarum菌株在250 bp未出现明亮条带,证明引物特异性良好,可用于肠道内容物的定性研究。

图4 特异性引物验证情况Fig. 4 Verification of the primer specificity
从菌株水平看,尽管各个菌株在种水平上进化距离相近,但每一个菌株在基因水平上都会有其独特的序列作为身份标签,需要找到该菌株独特的序列,根据其设计大小合适的特异性引物用作肠道内定性的筛选标准。
2.4 L. plantarum HNU082 定量方法的建立
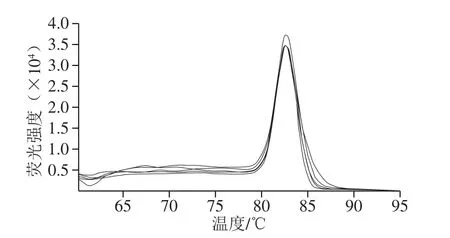
图5 样本扩增溶解曲线Fig. 5 Dissociation curves of samples
以初始模板量为横坐标(X),Ct值为纵坐标(Y),绘制出L.plantarumHNU082的real-time PCR标准曲线,方程Y=-3.192X+38.536,建立的L.plantarumHNU082标准曲线符合real-time PCR的要求。为区分产物中的特异性产物以及非特异性产物,绘制了L. plantarum HNU082的扩增熔解曲线,表示随温度升高DNA的双螺旋结构降解程度。从图5可以看出,扩增产物的熔解曲线一致,在82.74 ℃达到最高峰,且曲线都为单一峰形,证明荧光定量反应的特异性良好,无特异性引物,可以用于L. plantarum HNU082的荧光定量。
2.5 肠道内L. plantarum HNU082定性定量结果实例验证
对大鼠进行为期4 周的灌胃,每周对粪便进行采样,停止灌胃后,仍在每周对粪便进行采样,持续到第8周。粪便分为2 份,一份用于定性分析,选用MRS乳酸菌限制性培养基混合万古霉素及诺氟沙星对粪便进行稀释涂布,稀释梯度选择10-3~10-6,37 ℃培养24 h,对单菌落进行特异性引物PCR扩增,琼脂糖凝胶电泳图谱验证,图6为大鼠粪便中稀释梯度为10-6时,37 ℃培养24 h的菌落以及用特异性引物进行菌落PCR后的凝胶电泳图。从培养结果看,平板无明显杂菌,菌落呈白色圆形凸起且边缘整齐,符合乳杆菌属形态特征,可见抗生素对杂菌的屏蔽效果较好,凝胶电泳图可见胶板存在一条明亮条带,可认为是L. plantarum HNU082;另一份用于定量分析,提取粪便微生物总DNA,应用real-time PCR的方法对L. plantarum HNU082进行定量(图7)。

图6 L. plantarum HNU082定性分析结果Fig. 6 Qualitative analysis of L. plantarum HNU082
real-time PCR分析灌胃后不同时间点大鼠粪便中L. plantarum HNU082数量[32],前4 周持续灌胃的同时检测,如图7所示,该菌株在第4周数量达到最大值,为(7.51±0.32)(lg(CFU/g))。而后停止灌胃,可以看出L. plantarum HNU082出现了明显下降趋势,而后数量稳定在第8周,为(5.30±0.31)(lg(CFU/g))。由此可知real-time PCR用于L. plantarum HNU082的在肠道内定量的方法可行。
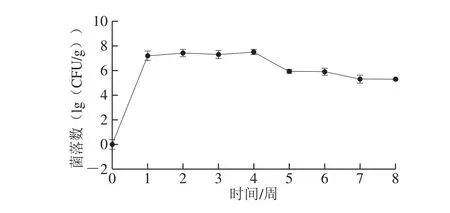
图7 灌胃后L. plantarumHNU082在肠道内real-time PCR结果Fig. 7 Real-time PCR results of L. plantarum HNU082 in intestine after intragastric administration
3 结 论
本研究通过基因组层面设计菌株的特异性引物,并利用抗生素进行第一步筛选,对分离出单菌落进行特异性扩增进行定性分析,通过real-time PCR定量分析,建立了一种基于菌株水平对肠道内L. plantarum定性定量的分析方法,并以L. plantarum HNU082为例进行了验证,效果良好。本方法的建立在菌株层面从肠道水平对体内的益生菌株含量进行定性定量工作,适用于所有益生菌的相关定性定量研究,该方法可以从定义出发,评价菌株是否能以一定剂量活着进入肠道,达到益生菌的标准,优化益生菌市场,并作为评价指标用于益生菌的益生功效评价以及多元化益生菌产品功能评价中,也将为益生乳杆菌的体内研究方法提供重要理论支持,为益生菌类保健食品的产业技术的发展以及相关产业法律法规的制定提供参考指标,促进我国益生菌产业健康发展。
