大豆亲脂蛋白组分分析及体外抗氧化特性
2020-07-23曾剑华刘琳琳朱秀清石彦国郑环宇王新越
曾剑华,刘琳琳,杨 杨,张 娜,朱秀清,*,石彦国,*,郑环宇,王新越
(1.哈尔滨商业大学食品工程学院,黑龙江省普通高校食品科学与工程重点实验室,黑龙江省谷物食品与综合加工重点实验室,黑龙江 哈尔滨 150076;2.黑龙江省绿色食品科学研究院,黑龙江 哈尔滨 150028)
大豆是世界上主要的油料作物之一,是优质植物蛋白重要来源,大豆干基中蛋白质量分数约为40%[1]。近年来一种新型大豆蛋白组分被分离鉴定。Samoto等[2]首次通过3 次酸沉分离出磷脂含量约为10%的高脂蛋白——大豆亲脂蛋白(soy lipophilic protein,SLP),并大致确定了11S球蛋白、SLP和7S球蛋白在大豆分离蛋白(soy protein isolate,SPI)中的占比为4∶3∶2。这一发现改变了之前认为SPI主要由11S球蛋白和7S球蛋白组成的认识[3-4]。
SLP因其磷脂含量高而备受关注[5-6],目前对SLP的功能特性己有研究报道,如Sirison等[6]研究发现大豆蛋白组分中,SLP的溶解性较差;Urade等[4]研究表明SLP具有降低血液胆固醇和三酰基甘油的作用;Gao Zhiming等[7]研究显示SLP可作为潜在的乳化剂;并发现SLP纳米颗粒能作为输送共轭亚油酸的良好载体,具有荷载量高、缓释和抗氧化的特性[5]。近年来,关于蛋白的抗氧化研究受到越来越多关注,如研究发现磷虾脂蛋白具有降低胆固醇、降血糖活性和抑制脂肪生成功能的同时[8-9],还具有良好的抗氧化等作用[10-11];Faraji等[12]研究显示清蛋白、酪蛋白、SPI具有清除氢过氧化物的效果,表明在食物基质中添加一定量的蛋白能够抑制氧化反应起到保护不饱和脂肪酸的作用。目前关于SLP的生物活性功能研究较少;且对SLP的具体成分分析尚停留在蛋白种类和氨基酸组成以及磷脂种类组成上[13-14],对其具体的脂肪酸组成和SLP的抗氧化活性研究更是鲜有报道;因此有必要对SLP的氨基酸、脂肪酸等组成成分进行分析,为进一步开展的抗氧化活性等功能研究提供理论参考。
本实验以冷榨豆粕为原料,经过3 步酸沉分离制备SLP;通过聚丙烯酰胺凝胶电泳、薄层色谱、氨基酸自动分析仪和气相色谱对SLP的组成成分进行分析;在此基础上以1,1-二苯-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulfonic acid),ABTS)阳离子自由基和铁还原力为评价指标,研究SLP的体外抗氧化能力;为专用型大豆蛋白组分——SLP的制备及其在食品工业开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
冷榨豆粕 黑龙江鹤旭食品有限公司;低分子质量标准蛋白、牛血清蛋白、磷脂酰胆碱(phosphatidyl choline,PC)、磷脂酰肌醇(phosphatidylinositol,PI)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)上海索莱宝生物科技有限公司;37 种脂肪酸甲酯混标上海安谱实验科技股份有限公司;正己烷、三羟甲基氨基甲烷(tris(hydroxymethyl)metyl aminomethane,Tris)、氯仿、甲醇、β-巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、甲叉丙烯酰胺、四甲基乙二胺、过硫酸铵、考马斯亮蓝R250、甲醇、冰醋酸、甘氨酸、尿素、5,5’-二硫代双(2-硝基苯甲酸)、三氯乙酸、磷酸盐缓冲溶液(phosphate buffer saline,PBS)、溴化钾、溴酚蓝均为国产分析纯。
1.2 仪器与设备
电泳仪 北京六一生物科技有限公司;HF254硅胶板上海康朗生物科技有限公司;S-433D全自动氨基酸分析仪 德国赛卡姆(北京)科学仪器有限公司;Nano-ZS-90马尔文激光粒度仪 英国马尔文仪器有限公司;DSC-4000差示量热扫描仪、Spectrum Two傅里叶变换近红外光谱仪、LAMBDA 365紫外光谱仪 美国珀金埃尔默股份有限公司;ALPHA1650型紫外-可见分光光度计 上海谱元仪器有限公司;F-7000荧光光谱仪日本日立仪器(上海)有限公司;GC 7900气相色谱仪上海天美科学仪器有限公司。
1.3 方法
1.3.1 SLP样品制备
通过3 步酸沉依次分离出11S球蛋白(pH 6.4)、SLP(pH 5.2)和7S球蛋白(pH 4.5),具体步骤如下:冷榨豆粕用0.5 mol/L pH 8.5的Tris-HCl缓冲液,55 ℃水浴提取60 min,经4 000 r/min离心20 min,取上清液,将上清液pH值调至6.4后静置30 min,4 000 r/min离心20 min分离出沉淀即为11S球蛋白;取上清液调pH值至5.2后静置30 min后,将pH值调回5.5,4 000 r/min离心20 min分离出沉淀即为SLP;取上清液调pH值至4.5后静置30 min,4 000 r/min离心20 min分离出沉淀即为7S球蛋白。各组分沉淀用适量去离子水溶解并将pH值调至7,透析48 h后,冷冻干燥备用。
1.3.2 SLP理化性质测定
蛋白质含量测定参照GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法;灰分的测定参照GB 5009.4—2016《食品中灰分的测定》;水分含量测定参照GB 5009.3—2016《食品中水分的测定》。
总脂含量测定参照GB 5009.6—2016《食品中脂肪的测定》并稍作修改。将2.000 g SLP样品用石油醚索氏抽提4 h,然后真空干燥并固化称质量计算总脂含量。将提取的油脂用于脂肪酸成分分析。
1.3.3 巯基二硫键测定
参考文献[13-14]方法测定。
1.3.4 表面疏水性测定
参考Kato等[15]的方法,采用1-苯胺基-8-萘磺酸荧光探针法测定疏水性。用pH 7 PBS配制2 mg/mL的蛋白样品溶液,并稀释成不同质量浓度梯度(0.02~1 g/mL)的蛋白样品溶液。测试前,取2 mL样品液加入20 μL 8 mmol/L 8-苯胺-1-萘磺酸,摇匀,静置3 min;在狭缝5 nm、激发波长365 nm、发射波长520 nm测定样品荧光强度;以20 μL 8-苯胺-1-萘磺酸+2 mL PBS作空白。
1.3.5 聚丙烯酰胺凝胶电泳
将样品配制成质量浓度为2 mg/mL的溶液,取0.5 mL样品溶液加入0.5 mL样品缓冲液(0.2 mL 10% SDS和50 μL 0.01 mol/L的β-巯基乙醇)混匀后,于100 ℃煮沸10 min后上样,上样量为20 μL。采用浓缩胶体积分数5%、分离胶体积分数12%,电压恒定为120 V。胶板用考马斯亮蓝R-250染色,用甲醇-冰醋酸溶液脱色后,扫描凝胶,用Imagequant TL8.0.1软件分析凝胶图谱[16]。
1.3.6 薄层色谱分析
参照Samoto等[4]方法测定。
1.3.7 氨基酸成分测定
采用S-433D全自动氨基酸分析仪参照Ursu等[17]方法进行,样品在6 mol/L HCl、110 ℃条件下酸解22 h后过滤上样,结果取2 次平均值。
蛋白质营养评价采用FAO/WHO氨基酸评分评价,以被评价蛋白质中某种必需氨基酸与FAO/WHO提供的参考蛋白质中该种氨基酸的含量比值计算必需氨基酸评分(amino acid score,AAS),最低分即为该蛋白质的AAS[18]。
1.3.8 脂肪酸成分分析
取1.3.2节中SLP脂质用1.0 mL正己烷溶解,加入2 mL 0.5 mol/L甲醇钠溶液(称1.999 8 g NaOH溶于100 mL甲醇,磁力搅拌助溶)静置30 min,12 000 r/min离心2 min后,取上层有机相进行气相色谱分析。
GC测试条件:色谱柱:Agilent DB-Fast FAME(30 m×0.25 mm,0.25 μm);手动不分流进样,进样量3 μL;进样口温度250 ℃;载气为氮气(54 mL/min)、氢气(40 mL/min)、空气(400 mL/min)。升温程序:80 ℃保持0.5 min;40 ℃/min升至165 ℃,保持1 min;4 ℃/min升至230 ℃,保持4 min。检测器:火焰离子检测器,温度为260 ℃。
1.3.9 抗氧化性研究
羟自由基清除能力测定:参考胡玲玲等[19]方法。取0.5 mL样品于比色管中,分别加入0.5 mL 9.1 mmol/L硫酸亚铁溶液、5 mL 8.8 mmol/L过氧化氢溶液和0.5 mL 9.1 mmol/L水杨酸-无水乙醇溶液,用去离子水定容至10 mL,于37 ℃水浴中静置30 min,在510 nm波长处测定吸光度。根据式(1)计算羟自由基清除率:

式中:A0为加蒸馏水溶液的吸光度;A1为加样品溶液的吸光度;A2为未加硫酸亚铁溶液的吸光度。
ABTS阳离子自由基清除活性测定:参考林春通等[20]方法。将0.007 4 mol/L ABTS溶液与0.002 mol/L过硫酸钾溶液以1∶0.5的体积比混合在室温下在避光放置12~16 h。测定前,用pH 7.4的PBS将ABTS溶液稀释至吸光度(0.700±0.020)。将100 μL样品溶液与3.9 mL稀释的ABTS溶液混合,37 ℃反应5 min后在734 nm波长处测定吸光度A4,以PBS作为空白。平行测定3 次,根据式(2)计算ABTS阳离子自由基的清除率:
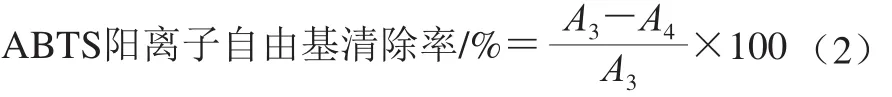
式中:A3为空白组溶液的吸光度;A4为加样品溶液的吸光度。
DPPH自由基测定:参照Nicklisch等[21]的方法稍作修改。取0.5 mL样品溶液加入3.3 mL含有1%吐温20的柠檬酸/PBS(0.1 mol/L,pH 7),最后加入0.2 mL 2 mmol/L的DPPH甲醇溶液(现配现用)使得DPPH最终浓度为0.1 mmol/L,在黑暗处反应2 h后于517 nm波长处测定吸光度,分别以0.1 mol/L pH 3的柠檬酸/PBS和去离子水作空白对照。DPPH自由基清除率计算如式(3)所示:
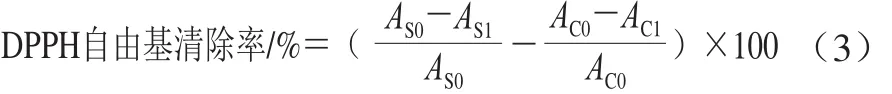
式中:AS0和AC0为样品和缓冲液初始吸光度(3~5 min);AS1和AC1为样品和缓冲液反应2 h后的吸光度。
还原能力测定:参照胡玲玲等[19]方法。将1 mL样品与9 mL去离子水混合,然后Whatman paper No. 1滤纸过滤后,加入3 mL FRAP试剂(0.3 mol/L 100 mL pH 3.6乙酸钠缓冲液、10 mmol/L溶于40 mmol/L HCl的TPTZ溶液和20 mmol/L FeCl3以10∶1∶1体积比混合),在37 ℃反应30 min。用紫外-可见分光光度计在593 nm波长处测量混合物的吸光度。还原能力计算如式(4)所示:
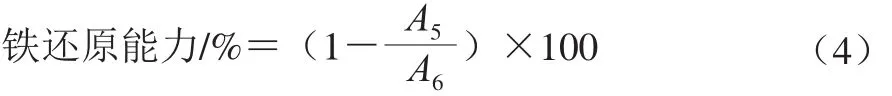
式中:A5为未加样品溶液的吸光度;A6为加样品溶液的吸光度。
1.4 数据处理
2 结果与分析
2.1 SLP特征
由表1可知,4 个蛋白组分中,SPI、11S和7S球蛋白蛋白纯度基本达到90%,而SLP蛋白含量为76.23%,且SLP总脂含量(以磷脂计)最大为12.14%。本实验测得SLP的总脂含量比Samoto等[2]测定的11.4%和Gao Zhiming等[5]测得的7.4%高,这可能是由于本研究中SLP的制备方法较前者有改进。尹利昂等[22]研究也表明,不同的磷虾脂蛋白制备方法得到的磷虾富脂蛋白中磷虾油和蛋白组成不同。

表1 理化指标分析(干基)Table 1 Physicochemical indexes of soy proteins (dry basis)%

图1 不同蛋白组分薄层色谱(a)和聚丙烯酰胺凝胶电泳谱(b)Fig. 1 TLC (a) and SDS-PAGE patterns (b) of soy proteins
如图1a所示,SLP中含有的主要脂质成分分别为PE、PC和PI,11S球蛋白含有少量的PC和PE,7S球蛋白基本不含有磷脂成分,这可能是因为SLP疏水性最大,易于和磷脂结合,而7S球蛋白表面疏水性低,因此7S球蛋白与磷脂结合能力低。这与Samoto[2]和Gao Zhiming[5]等的研究结果一致。
如图1b所示,SLP蛋白条带类型和SPI类似,这与Samoto[2]和Gao Zhiming[5]等的研究结果一致,均为11S和7S球蛋白构成,还含有分子质量为17、18、24、34 kDa的特征蛋白条带的膜蛋白分子。研究表明,蛋白-磷脂共存物对考马斯亮蓝敏感度低,导致SLP蛋白条带与SPI、11S和7S球蛋白相比灰度值偏低[6]。本实验增大蛋白上样浓度后,能清晰观察到SLP的典型特征蛋白条带,可以推断本实验制备的SLP具有现有文献记载的典型特征,是一种富含磷脂成分的SLP。
2.2 巯基、二硫键含量与表面疏水性分析

图2 不同蛋白组分巯基和二硫键含量对比分析Fig. 2 Comparative analysis of sulfhydryl and disulfide bonds contents in different soy proteins
由图2可知,游离巯基、总巯基和二硫键最高的为11S球蛋白,其次是SLP和SPI,7S球蛋白含量最少;这可能与11S球蛋白和7S球蛋白组分比例有关,研究表明11S球蛋白分子中含有2 个半胱氨酸和2 个胱氨酸残基,高于7S球蛋白中半胱氨酸含量(1 个)[23];这与Tang Chuanhe[24]和Ma Wenjun[25]等的研究结果一致,大豆蛋白组分中11S球蛋白中总巯基和二硫键含量较高。SLP中游离巯基、总巯基和二硫键含量分别为5.05、11.90、3.42 μmol/g,与SPI含量最接近,这可能是因为二者均为11S和7S主要球蛋白组成,含量不完全相近可能是11S和7S球蛋白构成比例不同造成的。游离巯基与总巯基的比值一定程度反映了蛋白质三级结构的折叠程度,比值越小,蛋白折叠程度越高,其中SLP比值最小,表明其具有紧凑的三级结构[26]。

图3 不同蛋白组分表面疏水性对比分析Fig. 3 Comparative analysis of hydrophobicity of different soy proteins

表2 SPI、SLP、11S和7S球蛋白氨基酸组成及氨基酸评分Table 2 Amino acid compositions and AAS of SPI, 11S, 7S and SLP
由图3可知,不同蛋白组分中表面疏水性最大的为SLP(305.19),其次为SPI(173.89),11S和7S球蛋白分别为166.72和147.64。Sirison等[6]研究表明7S和11S球蛋白的溶解度最大,其次是SPI,而SLP的溶解度最小,有研究显示蛋白表面疏水性和溶解度成负相关,与本实验结果一致[15]。2.1节研究结果表明,SLP含有大量磷脂,具有强烈的疏水相互作用,是其表面疏水性较大的原因;另外,由2.1节表2中SPI、SLP、11S和7S球蛋白氨基酸含量分析可知,SLP和SPI中疏水性氨基酸含量最高,7S和11S疏水性氨基酸含量最少,这与SPI、SLP、11S和7S球蛋白的表面疏水性结果一致。
2.3 氨基酸组成分析
如表2所示,与植物蛋白组成类似,SLP中酸性氨基酸(天冬氨酸+谷氨酸)含量最高;SLP具有豆科类蛋白典型特点,即含硫氨基酸含量偏低(甲硫氨酸、半胱氨酸)[5,27];SLP的氨基酸组成和SPI、11S和7S球蛋白总体分布相似,但SLP的丙氨酸、亮氨酸和甘氨酸含量较高,谷氨酸含量较低。由表2中FAO/WHO提供的必需氨基酸参数可知,除了甲硫氨酸,SLP能够满足学前儿童、儿童和成年人的日需求量。同时由氨基酸评分可知SLP的AAS最大,说明SLP比SPI、11S和7S球蛋白营养价值要高,且SLP的AAS分布在60~100之间,相比11S和7S球蛋白而言,氨基酸比例比较均衡。
根据Sharma等[28]提出的具有抗氧化性的芳香族氨基酸、含硫氨基酸、组氨酸和脯氨酸等归为功能性氨基酸,由表2可知,SLP的功能性氨基酸含量最大,为17.11 g/100 g,表明SLP具有一定的抗氧化能力。
研究表明,蛋白质中精氨酸和赖氨酸的比值越大,具有降低心血管疾病风险的作用可能性越强[29];由表2可知,11S和7S球蛋白的精氨酸和赖氨酸的比值均大于1,基本符合目前报道的Arg/Lys比值范围(1.4~5.5);SLP中比值最大为1.58,表明SLP在预防心血管疾病方面具有更好的效果[29-30]。人体骨骼肌中含有60%~75%的蛋白质,而这些蛋白中的必需氨基酸中有35%是支链氨基酸,因此补充支链氨基酸对健身爱好者至关重要。SLP的支链氨基酸含量最高为16.44 g/100 g,其异亮氨酸、亮氨酸和缬氨酸的比值(亮氨酸-异亮氨酸-缬氨酸=1∶0.56∶0.65)符合当前研究推荐的摄入比例(亮氨酸-异亮氨酸-缬氨酸=1∶0.56∶0.67)[31-33]。
综上所述,SLP组分可作为功能性蛋白在抗氧化、预防心血管疾病和增肌方面具有潜在的应用优势。
2.4 脂肪酸组成分析
37 种脂肪酸标准品和SLP总脂甲酯化后的气相色谱图见图4,对比脂肪酸甲酯混合标准品和样品的保留时间,共分离鉴定出27 种脂肪酸。由表3可知,SLP脂质成分中主要成分为不饱和脂肪酸,占总脂肪酸的66.55%,主要由油酸、亚油酸、亚麻酸和花生四烯酸等组成,其中单不饱和脂肪酸含量为24.82%,多不饱和脂肪酸含量为41.73%;饱和脂肪酸含量为33.45%,主要为己酸、棕榈酸、十七碳酸、硬脂酸以及少量的豆蔻酸等组成,与鲍风等[34]磷脂组分的研究结果相比,其不饱和脂肪酸含量略低(71.53%)。本实验结果主要脂肪酸为中长碳链脂肪酸,出现短链脂肪酸可能是脂肪酸甲酯化过程中水解过度所致。研究显示,大豆磷脂主要成分为PC、PE、PI、甘油磷脂以及少量的溶血磷脂,SLP脂质中的花生酸和二十二碳烯酸可能来源于溶血胆碱磷脂[33]。本实验中出现的反式脂肪酸主要为顺式脂肪酸的同分异构体,占SLP含量约为1.34%,出现的原因可能是冷榨过程中局部挤压高温造成。
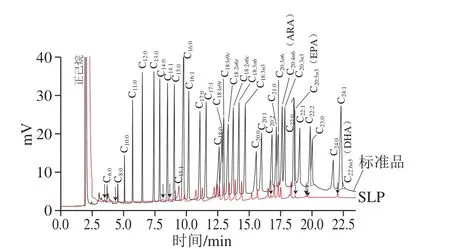
图4 脂肪酸标准品和SLP脂肪酸气相色谱图Fig. 4 Gas chromatogram profiles of fatty acid standards and SLP fatty acids

表3 SLP脂肪酸组成分析Table 3 Fatty acid composition of SLP
2.5 SLP体外抗氧化特性分析
本研究根据SLP组分具有较高的疏水特性和组成特性,以及根据生物体组织内存在的最活跃的活性氧(羟自由基),选取具有特异选择性的ABTS阳离子自由基、非特异性选择性的羟自由基、稳定性最好的DPPH自由基以及铁还原力考察SLP对特定自由基的清除能力、稳定性和与金属离子的螯合能力[35-37],从而评价SLP的抗氧化特性。
由图5可知,SPI、SLP、11S和7S球蛋白对ABTS阳离子自由基、DPPH自由基、羟自由基和铁离子都有一定的清除能力和还原力;自由基清除率和铁还原能力对蛋白质量浓度有依赖性,都随着蛋白质量浓度的增大而增大;在同一浓度条件下,SLP的自由基清除能力和铁还原力均优于SPI、11S和7S球蛋白的抗氧化效果,这与SLP的特殊氨基酸构成和富含磷脂有着密切关联。
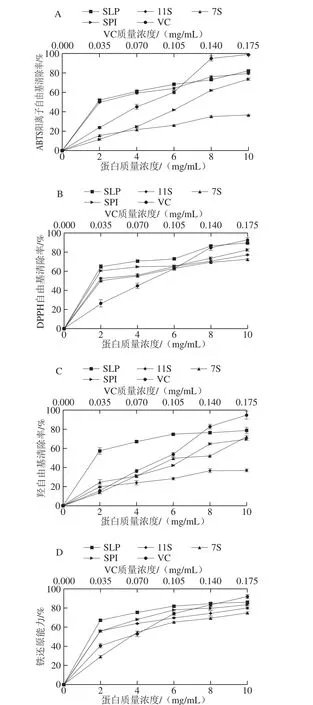
图5 大豆蛋白对ABTS阳离子自由基(A)、DPPH自由基(B)、羟自由基(C)的清除效果和铁还原能力(D)Fig. 5 Scavenging effects of soy proteins on ABTS cation radical(A), DPPH radical (B), hydroxyl radical (C) and their ferric reducing antioxidant power (D)
由图5A可知,在低蛋白质量浓度条件下(2 mg/mL),SLP和11S球蛋白的ABTS阳离子自由基清除率(51.90%和49.66%)显著高于SPI和7S自由基清除效果(11.55%和15.71%),且基本上SLP和11S球蛋白的ABTS阳离子自由基清除能力相当。研究表明功能性氨基酸中对ABTS阳离子自由基具有清除效果的半胱氨酸、酪氨酸和色氨酸,抗氧化能力分别为6 600.57、186.29、173.96 mmol/kg,因而其主要作用的是半胱氨酸[34],由2.3节研究结果可知,SLP和11S球蛋白中半胱氨酸和酪氨酸含量最大。且Žilić等[35]研究表明,ABTS阳离子自由基清除能力与二硫键含量成正比,本研究表明,SLP和11S球蛋白中二硫键含量最大,因而SLP和11S球蛋白具有较高的ABTS阳离子自由基清除能力;而7S球蛋白中半胱氨酸、酪氨酸和二硫键含量最小,这可能导致其ABTS阳离子自由基清除能力最小。本实验研究结果推断ABTS阳离子自由基清除率与二硫键含量呈显著正相关(R=0.905,P<0.05)。而研究发现ABTS阳离子自由基测试适用于疏水性抗氧化剂,也适用于亲水性抗氧化剂,因而样品表面疏水性对ABTS阳离子自由基清除率无线性关系。
DPPH自由基具有优异的稳定性,能接受质子和电子形成稳定的分子结构,因而DPPH自由基清除测试应用最高的体外抗氧化实验[36]。由图5B可知,在低质量浓度蛋白条件下(2 mg/mL),SLP和SPI的DPPH自由基清除能力(64.88%和60.52%)显著优于11S和7S球蛋白的自由基清除能力(52.58%和50.01%);随着蛋白质量浓度的增大DPPH自由基清除率逐渐趋于平稳。使用改良的DPPH自由基测试方法,既保证疏水性的DPPH能充分溶解,又避免了传统方法(只有甲醇或乙醇)造成蛋白变性或不溶。本实验中DPPH自由基清除率效果最佳的是SLP,可能是因为加入有机溶剂后促进了SLP中磷脂成分的溶解。由2.4节可知SLP种不饱和脂肪酸占总脂的66.55%,从而增加了DPPH自由基清除的能力;而SPI中也含有微量脂质成分,与11S和7S球蛋白相比,DPPH自由基清除能力有所增大。
相比ABTS阳离子自由基和DPPH自由基而言,羟自由基具有非特异选择性,也是生物系统中与细胞膜磷脂中的多不饱和脂肪酸分子发生反应并对细胞造成损伤的最活跃的一种活性氧[35]。由图5C可知,在低蛋白质量浓度条件下(2 mg/mL),SLP对羟自由基清除率(57.25%)极显著(P<0.01)高于SPI、11S和7S球蛋白对羟自由基的清除能力(分别为13.76%、19.6%和24.23%);随着质量浓度增加,7S球蛋白和SPI对羟自由基的清除能力要由于11S球蛋白对羟自由基清除效果。SLP因其富含磷脂成分,磷脂中不饱和脂肪酸约为66.55%,且功能性氨基酸含量最大,因此,非特异性的羟自由基测试中,SLP测试效果最佳。而7S球蛋白实质上是糖蛋白,有研究表明糖蛋白对羟自由基的清除效果要由于DPPH自由基清除效果[37],与本研究结果相符。
蛋白可以和金属离子发生螯合反应从而达到控制氧化反应的作用,铁还原能力是评价蛋白质与金属离子螯合能力强弱程度。如图5D所示,在低蛋白质量浓度条件下(2 mg/mL),SLP的铁还原能力最强(67.19%),随着蛋白质量浓度的增大,SLP、SPI、11S和7S球蛋白的铁还原能力逐渐增大后趋于不变。研究表明除如转铁蛋白等特异专一性蛋白外,一些富含组氨酸、天冬氨酸、丝氨酸、谷氨酸、苏氨酸以及磷酸化丝氨酸侧链的非特异性蛋白质也具有铁还原能力,如乳清蛋白、酪蛋白、SPI等[12],这些蛋白不具备储藏和转运铁离子的能力,但它们能通过蛋白表面的组氨酸、天冬氨酸、丝氨酸、谷氨酸、苏氨酸和及磷酸化丝氨酸以及疏水核心和铁离子螯合,将具有三价铁离子还原成二截铁离子并储存在蛋白的螺旋折叠结构中,从而达到抑制食物的氧化。在本实验中,SLP因其具有较高的螯合氨基酸含量和表面疏水性而对铁还原能力最强,其次是SPI,7S球蛋白因螯合氨基酸含量低,且表面疏水性低,而具有较弱的铁还原力。
3 结 论
本实验通过SDS-聚丙烯酰氨凝胶电泳、氨基酸自动分析仪和气相色谱分别研究SLP的蛋白组分、氨基酸和脂肪酸组成;在此基础上以DPPH自由基、羟自由基、ABTS阳离子自由基和铁还原抗氧化能力为评价SLP的抗氧化特性。结果表明,SLP中精氨酸和赖氨酸比值最大为1.58,富含支链氨基酸(16.44 g/100 g),且SLP氨基酸评分最大;脂肪酸成分分析表明,SLP脂质成分含有27 种脂肪酸,不饱和脂肪酸占总脂的66.55%,与SPI、11S和7S球蛋白相比,SLP具有更高的营养价值潜力。体外抗氧化实验结果表明,与SPI、11S和7S球蛋白相比,因SLP中的半胱氨酸、酪氨酸和二硫键含量较高,且富含磷脂成分以及含有较大的疏水核心,SLP表现出良好的DPPH自由基、羟自由基、ABTS阳离子自由基清除效果和铁还原能力。本研究为SLP在抗氧化等领域应用提供理论基础。
