Oleosin蛋白和磷脂酰胆碱相互作用对重组油体乳液稳定性的影响
2020-07-23孙禹凡谢凤英钟明明齐宝坤
孙禹凡,谢凤英,钟明明,齐宝坤,2,3,*,李 杨,2,3,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.哈尔滨市食品产业研究院,黑龙江 哈尔滨 150028;3.国家大豆工程技术研究中心,黑龙江 哈尔滨 150086)
油体是植物种子中用来贮存油脂的细胞器,是由磷脂及油体结合蛋白包裹液态甘油三酯形成的球体结构,直径通常为0.5~2.5 μm。其中,Oleosin蛋白(OL)是油体结合蛋白的主要成分且含量最为丰富(占油体结合蛋白的80%~90%),是一类疏水、碱性小分子蛋白,分子质量通常为16~24 kDa[1]。Tzen等[2]深入研究发现OL分子含有3 个区域,其中央疏水区由两列反向排列的β-折叠的氨基酸残基插入油相中,形成发卡状构型。对天然油体环境稳定性起着关键作用[3]。然而,正是由于这种稳定结构的存在,使得天然油体较难封装天然疏水性化合物,限制了其应用领域。因此,人们开始模拟天然油体结构,建造类似于天然油体稳定结构的重组油体乳液,用于装载营养素(如姜黄素类)和药物(用于持续释放喜树碱,一种疏水性抗癌药物)等[4]。
1992年Tzen[5]通过混合甘油三酯、三亚油酸甘油酯和磷脂酰胆碱(phosphatidyl choline,PC),以及分别从小麦、水稻、油菜籽和大豆分离的OL,首次成功地制备了物理稳定良好的重组油体乳液。此后科学家试图拓展其应用领域,装载不同的功能成分。目前,研究者利用重组油体乳液进行功能性物质的包封和运载。Chiang等[6-7]分别利用OL、油脂和磷脂自组装油体靶向递送疏水性药物,并利用石斑鱼吸收模型对重组油体的封装效果和缓释进行了研究,也证明了采用重组油体可将90%以上功能成分封装,并且延长了功能性成分的释放曲线。Vargo等[8]将重组油体与磁性氧化铁融合,成功构建出一种磁性纳米材料,并成功负载药物,精确地靶向配体达到靶向治疗的效果。此外,油体乳液稳定不易被氧化的特点也渐渐吸引人们的眼球,Wijesundera等[9]利用金枪鱼油、菜籽中提取的OL和磷脂模仿天然油体来制备重组油体,从而形成含有高度不饱和脂肪酸的物理和氧化稳定的食品乳液。目前,对于重组油体乳液的构建及应用研究相对较多,但OL与磷脂间的相互作用对重组油体乳液功能性质的研究较少,且OL与磷脂间的比例对构建重组油体稳定性的影响研究也鲜有报道。
本实验研究不同组分质量分数的OL与磷脂中主要成分PC相互作用对重组油体乳液稳定性的影响。以天然油体中主要成分甘油三酯、PC和OL为原料,利用超声处理构建重组油体,探究重组油体中关键组分互作模式,建立重组油体结构与界面模型,评价其稳定性与界面特性,为稳定乳液的构建及包埋功能性物质提供理论基础。
1 材料与方法
1.1 材料与试剂
大豆(东农36号)由东北农业大学大豆研究所提供;蔗糖 天津科密欧化学试剂有限公司;大豆油为市售一级大豆油;异辛烷 天津市富宇精细化工有限公司;异丙醇、丁醇、甲醇、氯仿、丙酮、氢氧化钠 天津市天力化学试剂有限公司;试剂均为分析纯。
1.2 仪器与设备
KC-701超微粉碎机 北京开创同和科技发展有限公司;UP-400S超声波细胞破碎仪 宁波新芝生物科技股份有限公司;UV-2600/2700紫外-可见分光光度计 岛津企业管理(中国)有限公司;F-4500型荧光分光光度计日立高新技术公司;Nano-ZS90粒度分析仪、Bohlin-CVO流变仪 英国马尔文公司;PHSJ-4A型实验室pH计中国上海雷磁公司;分析天平(0.000 1 g) 北京赛多利斯仪器系统有限公司;FD5-3型冷冻干燥机 美国SIM公司;IX71奥林巴斯倒置显微镜 上海豫光仪器有限公司;TNZ1-5700傅里叶红外光谱仪 英国Thermo Fisher公司;OCA20视频接触角测量仪 德国Data Physics仪器股份有限公司。
1.3 方法
1.3.1 OL的提取
参考Deleu等[10]的方法提取OL,并做适当修改。将大豆和水以料液比1∶5(g/mL)浸泡,在4~6 ℃条件下放置18~20 h。用组织捣碎机以18 000 r/min 磨浆90 s,用四层脱脂纱布过滤除去豆渣,并收集滤液。将滤液中加入质量分数4%氯化钠,冰水浴搅拌15 min,转移到离心管中,在4 ℃条件下,19 000 r/min 离心30 min,收集上层乳状物,并重复此步骤2 次,最后用去离子水清洗;将处理后的上层乳状液用0.22 µm的滤膜过滤,将过膜处理后的乳状液与3 倍体积的乙醚混合后,以5 000 r/min离心15 min除去中性脂质,该过程重复3 次。将获得的残渣再用氯仿-甲醇-去离子水(4∶2∶1,V/V)混合后,以5 000 r/min离心15 min,收集中间白色胶体;并与3 倍体积的冰丙酮混合,以5 000 r/min离心15 min,收集沉淀即为OL。最后将OL置于氮气下以除去剩余的有机溶剂,冷冻干燥后用于进一步分析。
1.3.2 OL十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
参考Surewicz等[11]的实验方法稍作修改。SDS-PAGE分离胶质量分数为15%,浓缩胶质量分数为5%。将OL溶于水配制成质量浓度为3 μg/mL的溶液,取样品加上样缓冲液煮沸5 min。上样量15 μL,在80 V条件下运行30 min,进入分离胶后增至120 V。采用考马斯亮蓝溶液进行凝胶染色后进行脱色。
1.3.3 重组油体乳液构建
在pH 7.4下构建重组油体乳液。使用OL、PC和大豆油构建重组油体,具体添加量如表1所示。为保障OL和PC混合均匀,在室温下不断搅拌2 h。然后将锥形瓶置于冰水浴中1 h,将超声波处理器的钛探头(直径0.636 cm)插入液面下,距离锥形瓶底部1 cm处,在20 kHz条件下,输出功率200 W处理6 min,超声时间4 s,间隔时间2 s,并每5 min向冰水浴中加入冰块保持低温。

表1 重组油体乳液中不同组分质量分数Table 1 Percentages of various components in reconstituted emulsions%
1.3.4 乳化活性及乳化稳定性测定
乳化性的测定参考Li Chen等[12]方法。将均质的乳状液用0.1% SDS溶液稀释100 倍,在500 nm波长处用紫外分光光度计测定吸光度,按式(1)计算乳化活性指数(emulsifying activity index,EAI)。静置30 min后测定吸光度,按式(2)计算乳化稳定性(emulsion stability index,ESI)。

式中:N为稀释倍数(100);C为乳化液形成前乳化剂质量浓度(g/mL);φ为乳化液中油相体积分数/%;A0为第0分钟时的吸光度;A10为第10分钟时的吸光度;T10-T0为时间差(10 min)。
1.3.5 接触角测定
使用接触角分析仪在25 ℃通过座滴的方法测定。乳液涂抹于载玻片制备成直径为13 mm且厚度为2 mm的薄膜。使用高精度注射器将一滴水(5 μL)沉积在薄膜的表面上。在通过摄像机从注射器下落之后立即记录液滴图像,并且液滴的轮廓被数值求解并且适合于Laplace-Young方程,可确定其界面张力。每个样品在3 个颗粒中的每个上测量接触角,并对每个颗粒进行3 次测量[13]。
1.3.6 贮藏稳定性测定
参考Saeidy等[14]方法稍作修改。取新鲜乳液至10 mL透明玻璃瓶中,封口密闭,置于室温,避光贮存每隔7 d观察,上层为乳析层,下层为清液层。乳析指数(creaming index,CI)计算如下:

式中:Hc为下层清液高度/cm;Ht为整个乳化液的高度/cm。
1.3.7 Zeta电位、粒径的测定
采用Malvern Zetasizer Nano ZS电位及粒度分布仪测定乳液的Zeta电位。利用Malvern Mastersizer 2000激光粒度仪测定乳液的液滴直径。稀释乳液的倍数约为1∶1 000。乳液液滴的平均粒径采用体积平均直径(D4,3)表示。所有的测试均在25 ℃条件下进行,平行测定3 次。
1.3.8 浊度测定
将不同组分质量分数的重组油体乳液分别用pH 7.4的磷酸盐缓冲液溶液稀释100 倍后,以pH 7.4的磷酸盐缓冲液为空白对照,用紫外分光光度计测定600 nm波长处的吸光度,浊度计算如下:

式中:A为稀释乳液在600 nm波长处的吸光度;V为稀释倍数;I为光程差0.01 m。
1.3.9 微观结构的测定
利用配有DP27型显微数码相机的奥林巴斯BX53型生物显微镜对重组油体乳液的显微结构进行观察。用0.01 mol/L pH 7.4的磷酸缓冲溶液将样品稀释10 倍,用吸管取2~3 滴稀释后的重组油体乳液于干净干燥的载玻片上,轻轻的加上盖玻片后,置于显微镜明场放大20 倍进行观察。
1.3.10 内源荧光光谱的测定
应用F-4500荧光分光光度计测定样品的荧光光谱[15]。将超声处理后的样品稀释,使其质量浓度达到0.15 mg/mL。光谱测定条件设置为激发波长287.5 nm,扫描波长300~500 nm,激发狭缝5 nm,发射狭缝宽5 nm。重复扫描3 次。
1.3.11 三维荧光光谱的测定
采用荧光光谱仪并参考Li Yang等[16]方法测定不同OL/PC比例下构建重组油体的三维荧光光谱,将制备好的重组油体乳液稀释50 倍后,取一定量置于比色皿中测定得到三维荧光结构图。初始激发波长为280 nm,扫描波长为200~500 nm,谱带宽度10 nm,扫描16 条曲线。
1.4 数据统计分析
2 结果与分析
2.1 OL的SDS-PAGE

图1OL的SDS-PAGE图谱Fig. 1 SDS-PAGE of oleosin
图1 表明,采用Nikiforidis等[17]方法所提取的OL除去了油体表面大部分的其他结合蛋白,其中24 kDa被认为是OL,通过凝胶成像仪表明OL质量分数高达95.6%,满足实验纯度要求。
2.2 乳化性分析

图2 不同OL/PC质量比对重组油体乳化特性的影响Fig. 2 Effects of OL/PC ratio on EAI and ESI
由图2可知,与单独添加磷脂或蛋白相比,OL-PC相互作用制备乳液可明显提高其乳化特性。并且,随着磷脂添加量的增加,重组油体乳液的乳化性呈先升高后降低的趋势。当OL/PC=1.5时,重组油体的EAI和ESI均最高,分别为33.11 m2/g、74.22 min,较单独添加磷脂形成的乳液分别提高2.87、7.65 倍。这可能是由于PC与OL发生疏水相互作用,从而改变OL表面活性,并对其结构和表面电荷进行修饰,随着PC添加量的增加甚至可能将OL完全包裹至PC形成的胶束和囊泡中。此外,二者相互作用可在乳液油-水界面均匀分散,降低重组油体乳液的界面张力,从而改变其乳化特性。然而,当蛋白比例持续增加(OL/PC>1.5)时,重组油体乳液的乳化性又有所下降,与Torrezan等[18]研究结果相似,这是因为当溶液中添加过量的OL时,OL与PC在油-水界面处发生竞争吸附的现象,乳液中的PC分子被替换下来,从而导致乳化能力降低。
2.3 接触角分析

图3 不同OL/PC质量下重组油体乳液的接触角Fig. 3 Effects of OL/PC ratio on contact angle

图4 不同OL/PC质量下重组油体乳液乳液界面张力Fig. 4 Effects of OL/PC ratio on dynamic interfacial tension
接触角是指在气、液、固三相交点处所作的气-液界面的切线,此切线在液体一方,与固-液交界线之间的夹角为θ,是润湿程度的量度[19]。从图3观察得知,与单独添加蛋白相比,向重组油体乳液中添加PC时,接触角均有所下降,结果表明接触角的改变主要受PC添加量的影响,可能是由于亲水性磷脂吸附在乳液的表面增加了乳液的亲水性。当OL/PC=1.5时,接触角降至最小值(25.7°),说明此时重组油体乳液亲水性最强,OL-PC结合效果最佳,而OL/PC>1.5时,接触角又所上升,当添加过量的OL时,OL与PC在油-水界面处发生竞争吸附的现象,在油-水界面处OL占据了主导地位。另一方面,Yu Long等[20]研究表明,乳液的稳定性与界面张力和界面压的大小有着密切相关,界面张力越小,界面压越大,乳液越稳定。
由图4得知,OL/PC=1.5时界面张力值也是最小的,说明OL/PC=1.5时所形成的重组油体乳液最稳定。猜测由于在此浓度下OL与PC结合度最高,OL-PC复合物吸附在重组油体乳液的油-水界面,在增加了乳液的亲水性的同时又起到良好的稳定剂的作用。
2.4 贮藏稳定性分析

图5 不同OL/PC质量比对重组油体贮藏稳定性的影响Fig. 5 Effects of OL/PC ratio on storage stability
不同OL/PC质量比例下形成的重组油体乳液贮藏稳定性如图5所示。乳层析指数表征的是乳液抵抗重力分层的能力,单独添加PC时,样品在室温条件下放置24 h内即出现相分离现象,这可能由于乳液表面的组成物质单核含量较低,乳液液滴之间未能提供足够的排斥力阻止乳层析现象的发生[21]。除此之外,Nur Hanani等[22]研究发现,乳化剂的组成成分也是影响乳层析指数的重要因素。重组油体乳液主要是由OL、PC和油脂组成,其中OL在油-水界面上作为主要成分阻止乳液重力分层,也可与PC发生疏水相互作用形成更为致密的乳化层,使乳液在几天之内保持相对稳定。因此,与单独添加PC时相比,OL-PC乳液显示连续稳定的状态,原因可能是乳化剂的组成成分中OL柔性结构舒张与PC对接后复合体系的构象发生改变而提高两者之间的相互作用。当蛋白质含量过少时,乳化效果较差;蛋白质含量过高时,则高浓度的OL与PC出现竞争吸附,乳液的稳定性由此受到影响。当OL/PC=1.5时,乳液显示出最低的乳层析指数21.5%,说明此时乳液的稳定性最好。
2.5 平均粒径、粒径分布、Zeta电位及浊度分析
超声处理后乳液液滴的破碎与重聚同时发生,但粒径D4,3的测量可迅速捕捉液滴平均粒径的变化,不同OL/PC质量比重组油体乳液的平均粒径和粒径分布变化如图6A、B所示。当单独添加OL时重组油体乳液的粒径最大为3 703 nm,相反单独添加磷脂时乳液得到最小粒径为490 nm,这是由于磷脂本身为小分子乳化剂,具有较小的分子质量[23]。随着PC含量的增加,重组油体乳液的平均粒径呈现先降低后增加的趋势,OL/PC=1.5时,粒径为810.4 nm,且粒径分布图从多峰变成单峰,说明乳液呈现均一稳定的状态。Magnusson等[24]研究发现磷脂的添加对乳状液的乳析动力学和粒子密度产生影响,粒径减小与界面层电荷增加有关,可阻止乳液发生絮凝和聚沉。然而,当OL/PC>1.5,乳液的平均粒径逐渐增加。当OL/PC=50时,D4,3达到2 114 nm,且粒径分布呈现多峰趋势,这可能是随着蛋白含量的增加,导致油-水界面上的磷脂分子被替换,OL与PC之间的相互作用减弱,不足以维持重组油体以小液滴的形式存在,所以粒径有所上升,这与Crespo-Villanueva等[25]研究结果一致。

图6 不同OL/PC质量比对重组油体乳液平均粒径(A)、粒径分布(B)、Zeta电位(C)和浊度(D)的影响Fig. 6 Effects of OL/PC ratio on mean particle size (A), droplet size distribution (B), zeta-potential (C) and turbidity (D) of reconstituted emulsion
由图6C可知,与未添加PC相比,单独添加OL时重组油体乳液呈现最低的静电荷11.4 mV,并随着PC含量的增加,Zeta电位绝对值均有不同程度的增加,说明添加PC后可以增加乳液的电负性,这可能是由于OL与PC发生疏水相互作用,使蛋白结构发生改变氨基酸结构暴露,使重组油体乳液带有更多的负电荷。当OL/PC=1.5时,重组油体乳液Zeta电位的绝对值最大为46.1 mV,说明此时乳液液滴表面的同种电荷含量较高,彼此间的静电斥力保证乳液在贮存期间发生液滴扰动效应,因此稳定性较强[26]。该结果与2.3节中样品乳化稳定性结论一致。
乳液的浊度也可以表现乳液的稳定性。有研究表明当油相体积分数固定,乳液粒径是影响浊度的主要因素,二者呈正相关,乳滴平均粒径越大,体系浊度越高[27],本实验浊度与粒径变化结果保持一致。由图6D可知,当OL/PC>1.5时,浊度随OL质量分数的增加而增加,这是可能是油水界面处蛋白含量达到饱和,连续相中未被吸附蛋白含量增加,最终导致重组油体乳液浊度的增加。
2.6 光学显微镜分析

图7 不同OL/PC质量比对重组油体微观结构的影响Fig. 7 Effect of OL/PC ratio on microstructure of recombinant oil body
由图7可知,PC=0和OL=0时乳化体系中乳滴分布较为不均,且乳滴大小不均一,有少量乳滴发生轻微聚集现象,这可能是由于乳液中乳滴较大促进了絮凝现象的产生。而当OL/PC=1.5时,相对于其他样品乳液液滴大小较为均一,且分布均匀,因此乳液乳化稳定性较强,这与之前乳化稳定性测定结果相似,其微观结构与粒径分布趋势一致。
2.7 内源荧光光谱分析
如图8所示,经超声处理后的OL最大发射波长为310 nm。由此可知本实验所测试OL残基分布趋向蛋白分子外部环境[28]。OL的内源荧光主要来源于Trp残基,PC与OL结合使Trp残基的微环境发生改变,从而OL的荧光强度发生改变。由图8可知,随着PC的不断加入,虽然OL的荧光光谱的峰形不变,但OL的内源荧光强度逐渐降低,λmax红移2.0 nm,表明PC对OL的内源荧光产生了强烈的猝灭作用,PC与OL发生相互作用可使OL的空间构象发生改变,进而使Trp残基微环境发生改变,由疏水环境转变为亲水环境。同时表明荧光猝灭是因小分子与荧光物质相互作用而使其荧光强度下降的现象。该结果与2.5节中粒径、Zeta电位中的推测结果一致。

图8 不同PC添加量对OL荧光光谱的影响Fig. 8 Effect of different amount of added PC on OL fluorescence spectrum
2.8 三维荧光光谱分析
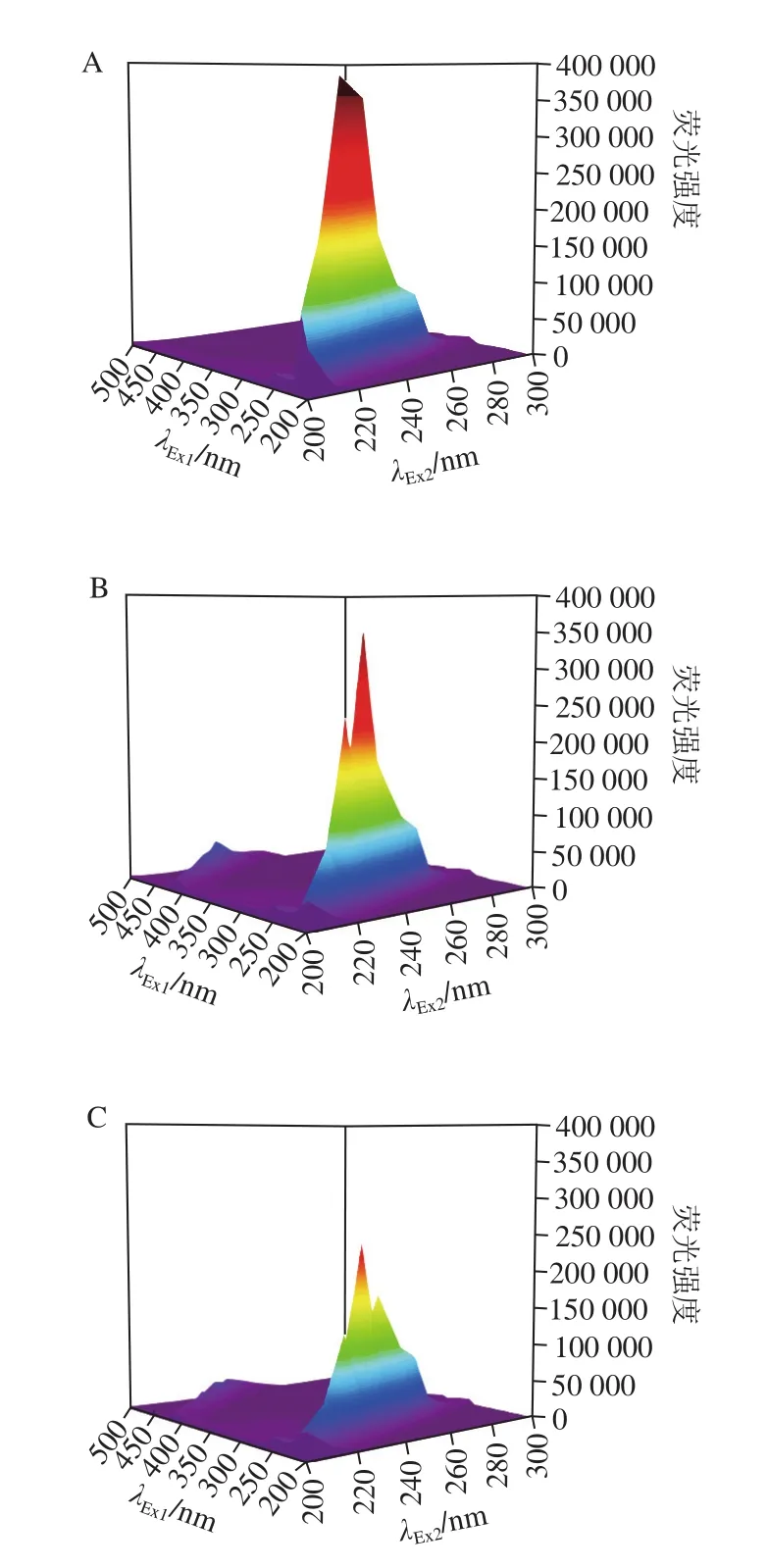

图9 不同PC添加量对OL三维荧光光谱的影响Fig. 9 Effect of different amounts of added PC on three-dimensional fluorescence spectrum of OL
三维荧光在二维的基础上增加了测量的维数,更加便于直观观测荧光强度状态的变化,增加了光谱的分辨率[29]。OL和PC之间的相互作用很大程度上影响OL的理化性质,从而对OL-PC所形成的重组油体乳液产生影响,因此使用三维荧光进行研究。图9显示,在添加不同PC时对OL三维荧光光谱的影响,实验组前期研究证明OL的激发波长和发射波长都在220 nm处,证明其发色基团主要出现在此波长下;当OL与PC相互结合时在激发波长200~500 nm范围内,出现第2个峰,证明二者发生相互作用[16]。实验数据显示,当OL/PC=1.5时,荧光强度较其他样品明显下降,这可能是由于在该条件下OL中多肽链发生解折叠,OL中的发色基团被埋在复合物的疏水区域中发生荧光猝灭效应,暂时无法被识别,导致荧光强度明显降低[30]。这也表明当OL/PC=1.5时,二者结合程度最大,更有利于重组油体乳液的形成,与上述其他研究结果一致。
3 结 论
OL-PC复合乳化体系的乳化活性、乳化稳定性等功能性质,因OL与PC比例的不同而具有差异性。当OL/PC=1.5时,重组油体乳液的乳化活性和乳化稳定性最高。乳液分散均匀、界面张力及接触角最小,并通过荧光光谱分析得出此时二者结合程度最大。
通过界面特性分析得出,当添加过量的OL时,OL与PC在油-水界面处发生竞争吸附的现象,在油-水界面处OL占据了主导地位导致乳化能力及稳定性的降低。而当OL/PC=1.5时,OL会促进与PC的相互作用,在油-水界面上形成较稳定的界面膜,利于重组油体的稳定。
OL-PC的添加比对重组油体乳液会产生一定的影响。适量添加OL会明显改善重组油体乳液的乳化及贮藏稳定性,这将为稳定乳液的构建提供理论基础。
