2-巯基苯并噻唑荧光增敏法检测过氧化氢含量及过氧化氢酶活力
2020-07-23吕雅娟袁瑞青李志英
吕雅娟,袁瑞青,李志英*
(1.山西医科大学 汾阳学院,山西 汾阳 032200;2.忻州师范学院 化学系,山西 忻州 034000)
过氧化氢是公认的低毒物质,可用作漂白剂、消毒剂、脱氧剂,也可作食品添加剂。植物在自身代谢中产生过氧化氢(H2O2)需及时清除,否则对植物细胞产生危害。而植物中也存在过氧化氢酶,它能催化过氧化氢分解[1],起清除过氧化氢的作用。过氧化氢酶(CAT)活性的测定在此之前已有不少报道,如:荧光分析法[2]、水杨酸法[3]、分光光度法[4]、Warburg法[5]、钼酸铵法[6]等。这些方法要推广应用存在一定的局限性,如操作繁琐、工作量大、仪器设备昂贵、测定体系复杂等问题,在实际应用中受到限制。而利用荧光分析法测定过氧化氢酶的活性报道较少,因此,研究一种测定蔬菜水果中过氧化氢酶活性的方法是非常必要的。
2-巯基苯并噻唑是是一种化学分析的试剂,分子式是C7H5NS2,可作为通用型硫化促进剂,广泛用于各种橡胶制品,也可与1-氨基-4-硝基蒽醌和碳酸钾可制得染料分散艳红S-GL,这种染料用于涤纶及其混纺织物的染色。2-巯基苯并噻唑用作电镀添加剂时又称酸性镀铜光亮剂M,在以硫酸铜为主盐的光亮镀铜时作为铺助光亮剂。此外,该品还用于制取农药杀真菌剂、氮肥增效剂、切消油和润滑添加剂、照相化学中的有机防灰化剂、金属腐蚀抑制剂等[7],是一种非常重要的化学物质。
研究发现,在碱性条件下,2-巯基苯并噻唑几乎不发荧光,但加入H2O2后发生氧化反应使其荧光增强,蔬菜中提取的过氧化氢酶催化H2O2分解为H2O和O2,短时间内使得荧光强度减弱。因此,用2-巯基苯并噻唑-NaOH荧光增敏法检测过氧化氢的含量,并用过氧化氢含量的减少检测过氧化氢酶活性,此方法环保,操作简单方便。
1 材料与方法
1.1 仪器与试剂
RF-5301PC荧光分光光度计,苏州岛津公司。
0.029 mol/L 过氧化氢溶液:取3 mL30%的过氧化氢(天津市福晨化学试剂厂,分析纯)于100 mL的容量瓶中定容配制成0.29 mol/L的贮备液,用高锰酸钾标准溶液标定,在2~8 ℃冰箱中避光保存,用时可稀释为0.029 mol/L 的工作液;氢氧化钠(天津市风船化学试剂科技有限公司,分析纯);0.01 mol/L 2-巯基苯并噻唑溶液:准确称取0.1673 g 2-巯基苯并噻唑(天津市光复精细化工研究所,分析纯)于100 mL干燥的烧杯中,移取10 mL1.00 mol/L的氢氧化钠溶液溶解,蒸馏水定容到100 mL的容量瓶中,得0.01 mol/L溶液;新鲜的土豆、黄瓜、生菜均购于忻州师范学院西巷平价超市。
1.2 实验方法
1.2.1 过氧化氢含量的检测方法
取两支25 mL 的比色管,各加入0.01 mol/L 2-巯基苯并噻唑溶液1 mL,其中一支再加入1 mL 的0.029 mol/L H2O2定容至25 mL,在已设定为55 ℃的水浴锅中加热30 min,流水冷却5 min,在激发波长342 nm、发射波长430 nm处,测定荧光强度。不加过氧化氢溶液的荧光强度记为F,加入过氧化氢的溶液荧光强度记为F0,并计算荧光强度变化ΔF(ΔF=F0-F)。
1.2.2 过氧化氢酶的提取[8]
将被测的新鲜蔬菜样品称量后置于研钵中,加入少量石英砂和适量蒸馏水,充分研磨成匀浆后,转入25 mL容量瓶内,并用蒸馏水将研钵冲洗3~4次,洗涤液转入容量瓶中,定容到刻度线,混匀后在5 ℃冰箱内静置10 min。将研磨液转入几个10 mL塑料离心管中,在4000 r/min下离心15 min,上清液即为过氧化氢酶粗提液,于5 ℃冰箱内保存备用。
1.2.3 过氧化氢酶活性测定
取两支25 mL 的比色管,各加入H2O2溶液1 mL,其中一支加入过氧化氢酶提取液1 mL,在25 ℃的水浴下反应不同时间,充分振荡后,各加入1 mL 2-巯基苯并噻唑,定容到25 mL,在55 ℃水浴锅中反应30 min后用流水冷却5 min,测定荧光强度,计算荧光强度变化△F 及过氧化氢酶活。酶活计算公式[9]:C=25[(ΔF-77.26)/6.69]/t。式中,C为CAT活性,mol/min;t为反应时间,min。
2 结果与讨论
2.1 测定体系的荧光图谱
取两支25 mL 的比色管,各加入0.01 mol/L 2-巯基苯并噻唑溶液1 mL,其中一支再加入0.029 mol/L H2O25 mL定容至25 mL,在已设定为55 ℃的水浴锅中加热30 min,流水冷却5 min,在激发波长342 nm,测定荧光强度F和F0,并计算△F(△F=F0-F),结果如图1。从图1可以看出,2-巯基苯并噻唑在430 nm处有弱荧光,加入H2O2荧光增强。
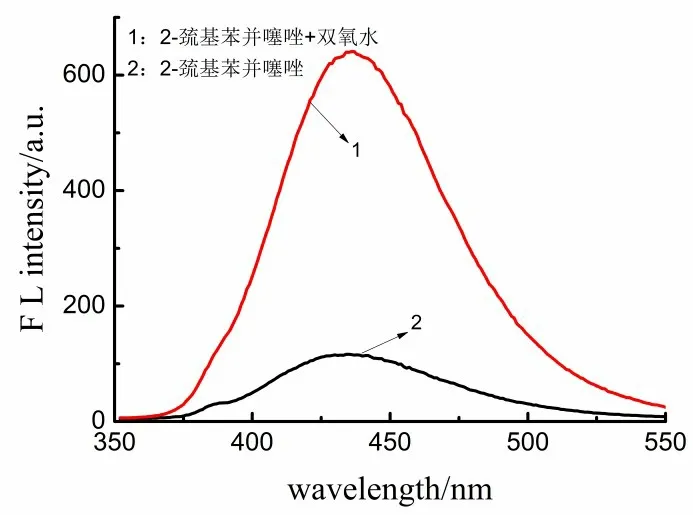
图1 2-巯基苯并噻唑与H2O2荧光光谱图Figure 1 Fluorescence spectra of 2-mercaptobenzothiazole and H2O2
2.2 pH、温度、加热时间对测定体系的影响
在其它实验条件不变的情况下,按实验方法1.2.1用NaOH 和HCl调节溶液的pH分别为4、5、6、7、8、9、10、11、12,测定其荧光强度,并计算ΔF(ΔF=F0-F),结果如图2(A)。由图2(A)可知,酸性条件下荧光较弱,原因是2-巯基苯并噻唑在碱性条件才能溶解,但碱性太强H2O2不稳定,所以,pH=7~8时效果最好,而用酸度计测定体系的pH=7.5,加入H2O2也不会小于7,所以选择不加缓冲溶液。
配制同浓度的2-巯基苯并噻唑、2-巯基苯并噻唑+H2O2,在其它实验条件不变的情况下,按照1.2.1分别考察了反应温度分别为35、45、55、65、75 ℃,反应时间分别为10、20、30、40、50、60 min 荧光强度的变化(ΔF=F0-F),结果如图2(B)、(C)。实验结果表明:温度对反应影响很大,ΔF值随加热温度的升高逐渐增加,但温度过高过氧化氢分解,温度为55 ℃最佳。加热时间30 min后基本稳定,因此选择加热时间30 min。
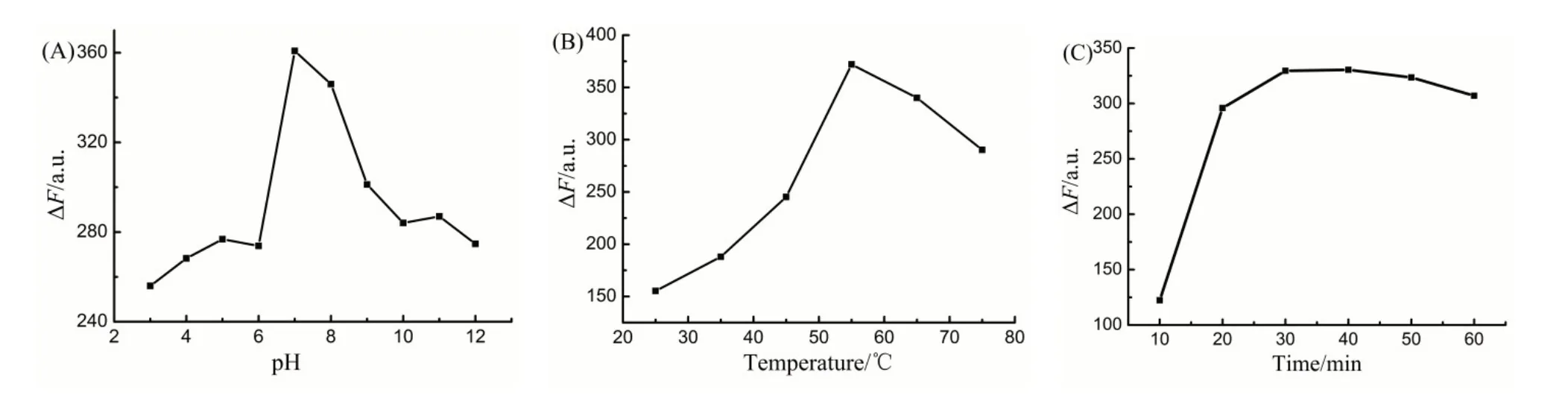
图2 pH(A)温度(B)和加热时间(C)对荧光强度ΔF的影响Figure 2 Effect of pH(A),temperature(B)and(C)time on fluorescence intensity △F
2.4 工作曲线与检出限
取25 mL 比色管,每支加入1 mL 2-巯基苯并噻唑溶液,再分别加入0.15、0.2、0.4、0.6、0.8、2、4、6、8、10 mL 的1 mol/L H2O2溶液,定容至25 mL,在55 ℃水浴锅中反应30 min,用流水冷却5 min,测定荧光强度,并作出工作曲线(图3)。求得回归方程和相关系数分别为:ΔF=6.69 c+67.26(mmol/L),r=0.9962,过氧化氢浓度在0.23~116 mmol/L范围内线性关系良好。平行测定11次不加过氧化氢的空白溶液,求得其相对标准偏差(Sr)为1.45%,检出限为6.73×10-5mol/L。
2.5 过氧化氢酶活性测定
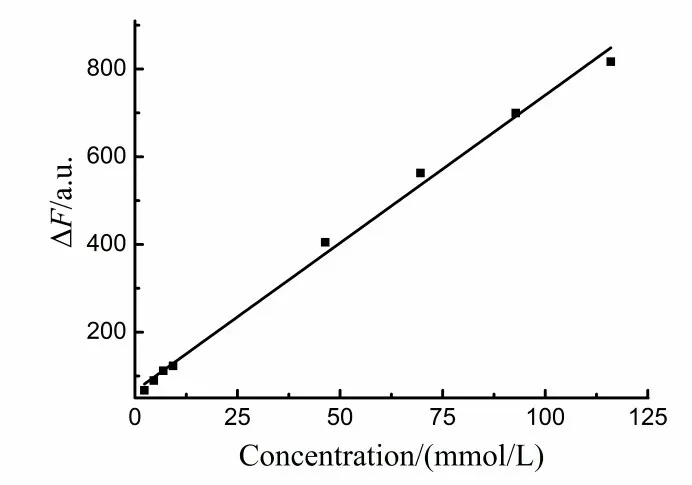
图3 过氧化氢的工作曲线Figure 3 Working curve of hydrogen peroxide
各取5 kg洁净的土豆、生菜、黄瓜,按照1.2.2的方法提取过氧化氢酶,采用1.2.3的方法测定酶活,结果如表1,土豆、生菜、黄瓜过氧化氢酶活力分别为0.018、0.012、0.010 mol/min,表明蔬菜中过氧化氢酶活强度大小顺序为土豆>生菜>黄瓜。
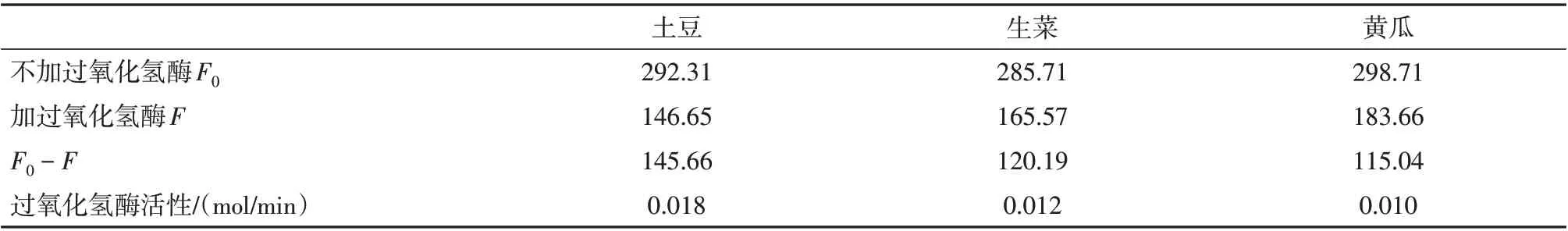
表1 过氧化氢酶活的测定Tab.1 Determination of catalase activity
3 结论
利用2-巯基苯并噻唑-NaOH荧光增敏法测定过氧化氢含量,反应最佳温度为55 ℃,加热时间为30 min。在此基础上对三种蔬菜(土豆、生菜、黄瓜)中提取的过氧化氢酶活性进行测定,结果显示蔬菜中过氧化氢酶活性强弱顺序为土豆>生菜>黄瓜。与其他参考文献结果相比[9],本方法简单、方便,不受环境影响。
