紫杉醇联合拉帕替尼治疗HER-2阳性晚期乳腺癌的疗效及对患者生活质量的影响
2020-07-23张发良王雪
张发良,王雪
上海孟超肿瘤医院肿瘤内科,上海 201800
据国际癌症研究机构调查的数据显示,乳腺癌在全球女性癌症中的发病率已达24.2%,位居女性恶性肿瘤的首位,而我国乳腺癌的发病率呈逐年上升趋势,尤其在经济发达地区。近年来,临床试验药物的研究和治疗策略使得乳腺癌在治疗方面取得了较好的成果[1]。目前,乳腺癌分为激素受体阳性、表皮生长因子受体(HER-2)阳性和三阴性乳腺癌,同时这也是诊断和治疗乳腺癌的基础。其中,HER-2在15%~20%的乳腺癌中高表达,具有侵袭性表型,与患者预后不良有显著关系[2]。目前,特异性单克隆抗体和酪氨酸激酶抑制剂(TKI)是两种HER-2 的靶向治疗策略,可较好改善HER-2阳性乳腺癌患者的预后[3]。拉帕替尼是首个被批准使用于HER-2 阳性乳腺癌晚期患者的一种口服TKI 药物,通过与受体胞内结构域的ATP 结合位点结合,阻断HER-1和HER-2酪氨酸激酶活性,从而抑制肿瘤细胞生长[4-5]。然而,在癌症得以控制的同时,患者的身心健康和生活质量却受到了很大的影响[6]。本研究旨在探讨拉帕替尼对HER-2阳性晚期乳腺癌的作用及其对患者生活质量的影响。
1 资料与方法
1.1 一般资料 选取2018 年12 月至2019 年12月上海孟超肿瘤医院肿瘤内科收治的60例HER-2阳性晚期乳腺癌患者为研究对象。入选标准:①符合HER-2阳性乳腺癌诊断标准者;②重要器官功能基本正常,且均无化疗禁忌者;③乳腺癌首发,预计生存期一年以上者。排除标准:①合并精神疾病、认知障碍者;②伴有重要脏器功能衰竭者。采用随机数表法将患者分为观察组和对照组,每组30例。两组患者在年龄、体质量指数(BMI)、TMN分期及病理分型方面比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究已通过本院伦理委员会批准,所有患者及其家属均知情并签署书面知情同意书。
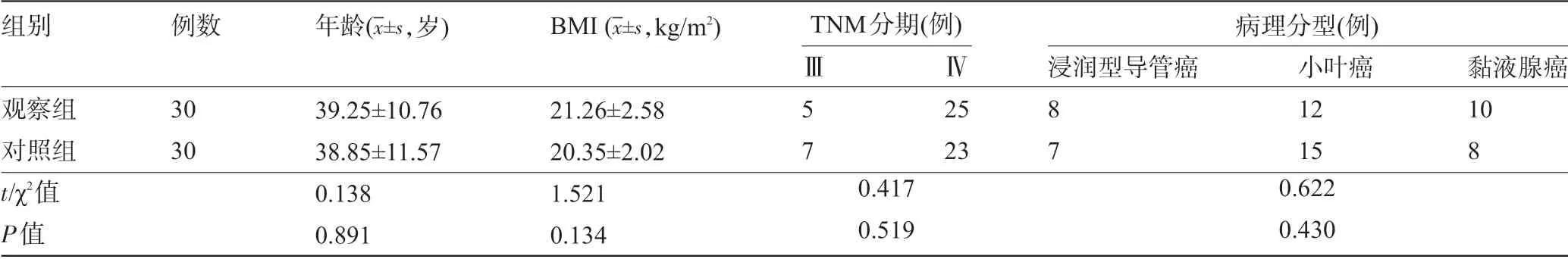
表1 两组患者的一般资料情况
1.2 治疗方法 对照组患者采用安慰剂和紫杉醇作为一线治疗,具体方法:饭后口服安慰剂(空心胶囊,生产厂家:上海红星胶丸有限公司;沪药准字F20110009),1 次/d;紫杉醇注射液(生产厂家:江苏红豆杉药业有限公司;规格:30 mg/支;国药准字H20067345) 75 mg/次,每间隔一周给予一次[7]。观察组患者采用拉帕替尼与紫杉醇联合用药,具体方法:饭后口服拉帕替尼(生产厂家:葛兰素史克公司;规格:250 mg/片) 1 250 mg/(次·d);紫杉醇服药方式同上。治疗期间观察疾病进展情况,口服药物均空腹服用,持续治疗直至疾病进展或不良反应不能耐受。
1.3 观察指标与评价方法
1.3.1 生活质量 对两组患者进行健康相关生存质量表(SF-36)评分[8],主要包括生理功能、生理职能、躯体疼痛、总体健康、活力、社会功能、情感职能和精神健康等8 个方面,通过测定患者身体素质的恢复情况和心理状态来评估患者的生活质量水平,以百分制计分,得分越高表示生活质量越高。
1.3.2 服药依从性和不良反应 记录两组患者治疗期间按时服药情况和不良反应,其中,患者的依从性标准为每周按时服药5~7 d。
1.4 近期疗效判定标准 治疗3 个月后对两组患者进行随访,由同一医师对所有患者进行相关评估。按照实体瘤治疗疗效评价标准(RECIST v1.0)对两组患者进行疗效情况统计,包括完全缓解、部分缓解、疾病稳定、病情进展。其中,完全缓解:病灶消失持续4 周以上;部分缓解:病灶最大直径缩小30% 4周以上;疾病稳定:指介于部分缓解和病情进展之间;病情进展:指病灶直径增加20%以上或发现新的病灶。总有效率为完全缓解率与部分缓解率之和,疾病控制率为完全缓解率、部分缓解率与疾病稳定率之和。
1.5 统计学方法 应用SPSS22.0 软件进行数据统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t 检验,计数资料组间比较采用χ2检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者的治疗效果比较 观察组的总有效率和疾病控制率均高于对照组,且差异均具有统计学意义(P<0.05),见表2。
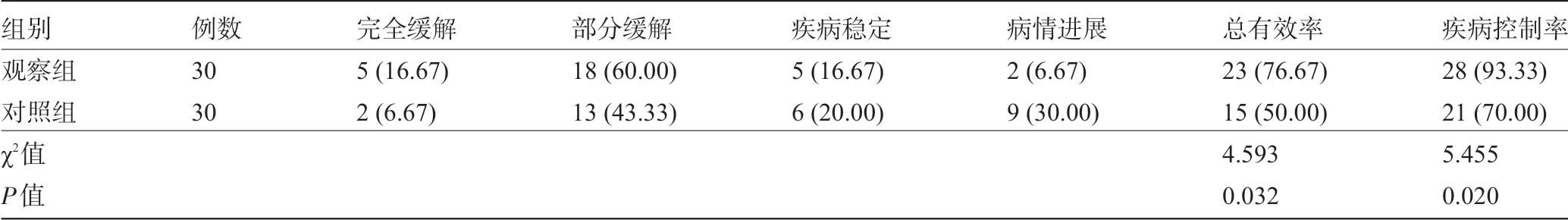
表2 两组患者的治疗效果比较[例(%)]
2.2 两组患者治疗前后的生活质量评分比较 治疗前,两组患者的生活质量评分比较差异均无统计学意义(P>0.05)。治疗后,两组患者的生活质量均较治疗前有明显改善,且治疗后观察组生活质量评分明显高于对照组,差异均有统计学意义(P<0.05),见表3。
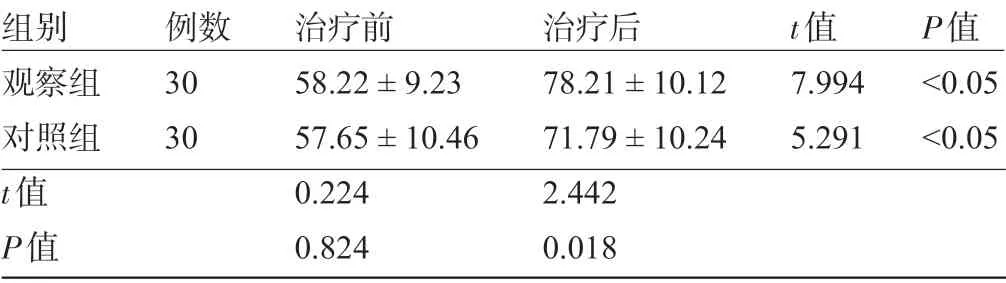
表3 两组患者治疗前后的生活质量评分比较(x-±s,分)
2.3 两组患者的服药依从性和不良反应比较 随访期间,两组均未发生死亡病例。观察组患者的服药依从性为63.33%,高于对照组的50.00%,但差异无统计学意义(χ2=1.086,P>0.05);观察组患者的不良反应发生率为40.00%,低于对照组的56.67%,但差异无统计学意义(χ2=1.669,P>0.05),见表4。

表4 两组患者的不良反应比较(例)
3 讨论
近年来,随着年龄的增长,我国乳腺癌的发病率已呈现出明显的上升趋势,是全球平均增速的两倍,尤其是30 岁以后的女性。我国经济发达城市已成为重灾区,以上海的形势最为严峻[9]。值得注意的是,绝大多数乳腺癌患者并未对此引起足够的重视而错过最佳治疗时间,发现疾病时已被诊断为中晚期,导致患者的治疗效果不尽人意、近期预后情况差,远期生存率及生活质量均下降[10]。HER-2 阳性乳腺癌,尽管已有一些既定的靶向治疗可以提高无进展患者的总生存率,如抑制HER-2活性,但HER-2阳性乳腺癌仍然是导致高死亡率的一个亚型[11]。同时,乳腺癌的靶向治疗也面临着临床效益递减、治疗费用增加和过度治疗风险的挑战。因此,针对乳腺癌的靶向治疗,特别是免疫治疗虽然没有很好的反应,但一直受到医学界的广泛关注。
在临床试验中,拉帕替尼通常耐受性良好,1~2级的腹泻是最常见的不良反应。虽然主要是轻中度的不良反应,但有相当比例的患者报告中断或中止治疗[12]。而在一线治疗中,曲妥珠单抗与紫杉醇联合应用耐受性良好,为HER-2阳性转移性乳腺癌患者提供了显著的临床效益。与紫杉醇单独治疗相比,作为一线治疗HER-2过度表达的转移性乳腺癌的Ⅲ期研究发现,曲妥珠单抗联合紫杉醇治疗疾病进展的时间更长,总有效率更高[13]。因此,自从首次应用以来,在过去的10年里,拉帕替尼在HER-2阳性乳腺癌患者中的重要性有所下降。拉帕替尼的单药治疗主要用在一些Ⅱ期研究中,虽然存在一些不良反应,但是在一些Ⅲ期试验中,与其他抗肿瘤药物的联合应用能显示出更强的疗效[14]。本研究通过拉帕替尼与紫杉醇联合应用于HER-2阳性乳腺癌患者,发现联合用药的总有效率和疾病控制率均比单用紫杉醇高(P<0.05)。进一步分析治疗期间两组患者的生活质量,两组患者治疗后的生活质量均较治疗前有明显改善(P<0.05),且观察组生活质量改善效果优于对照组(P<0.05)。
然而,随访期间两组虽均未发生死亡病例,但两组患者均发生了脱发、恶心/腹泻、周围神经病变、骨髓抑制等不良反应;且观察组的服药依从性和不良反应发生率均好于对照组,但差异均无统计学意义(P>0.05)。尽管如此,选定的患者均为乳腺癌首发,由于对疾病的认识不够,患者表现出不同的不良反应和依从性。其次,紫杉醇联合拉帕替尼作为一线治疗药物的有效性和安全性没有完全定义,考虑使用拉帕替尼治疗似乎是合理的,不仅在批准的应用中,而且在以后的应用中,还可能出现进一步的适应证[15]。再者,无论是在进展期胃癌的一线还是二线治疗中,拉帕替尼已被证明是优于曲妥珠单抗作为迄今为止阻断HER-2 治疗的标准。此外,拉帕替尼在靶向阻断HER-2 和跨越血脑屏障方面可能比曲妥珠单抗具有更明显的优势[16]。由于本研究中患者人数较少,因此评估接受拉帕替尼一线治疗的患者的疗效可能不够准确,还有待进一步的研究。
综上所述,拉帕替尼联合紫杉醇治疗HER-2阳性乳腺癌的临床疗效优于紫杉醇单药,并能一定程度的提高患者的生活质量,是一种可供参考的治疗方案。
