PML在慢性髓系白血病中的表达及临床意义
2020-07-23冯嘉昆综述李正发审校
冯嘉昆 综述 李正发 审校
1.昆明理工大学医学院,云南 昆明 650504;2.昆明理工大学附属医院/云南省第一人民医院,云南 昆明 650032
慢性髓系白血病(chronic myelogenous leukemia,CML)是骨髓造血干细胞恶性克隆性增生形成的血液系统肿瘤,90%以上CML 患者t(9;22)(q34;q11)易位形成BCR-ABL 融合基因为主要发病特征。其BCR-ABL 融合基因表达的致癌性蛋白(p210)具有酪氨酸激酶活性,该激酶活性改变了细胞内正常的信号通路传导,并抑制了细胞凋亡的发生。一代酪氨酸激酶抑制剂伊马替尼(imatinib,mesylate,IM)能靶向抑制p210酪氨酸激酶活性,是治疗CML的首选药物[1]。然而随着酪氨酸激酶抑制剂问世,其尽管疗效令人满意但仍有20%的患者用药后出现不敏感及耐药情况,分别称为原发性耐药或获得性耐药。此外,少数患者对IM不耐受,表现为呕吐、肌无力、血细胞减少[2]。近年来研究发现,在CML 患者BCR-ABL 融合基因阳性的骨髓样本中发现PML高表达,提示TKI耐药的白血病细胞是导致疾病耐药、复发的关键因素且PML可能与白血病耐药或急变有密切关系[3]。本文就PML 在CML细胞中的表达意义进行综述。
1 PML 基因
PML 基因最早在急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)中被发现,因染色体特征性的t(15,17)易位形成了PML-RARα融合基因,从而造成造血干/祖细胞在早幼粒细胞阶段分化受阻而获得自我更新的能力,成为APL发病主要机制[4]。该基因全长53 Kb,位于第15号染色体上,C末端外显子通过可变剪接后形成六种核型结构和一种胞质型结构[5]。其中,一种定位于核基质的多蛋白复合体称为PML 核体(PML-NBs)[6],具有促细胞凋亡、抑制肿瘤发生等生物学功能。N 末端418 个氨基酸是所有同种型共有序列,包含RING(R)、B-Boxl(B1)、B-Boxl(B2)和卷曲螺旋(CC)结构域,总称为RBCC 或三联基序(TRIM)结构域[7-8]。超过120 种蛋白质与PML 相互作用介导了PML 在细胞中的生命活动,如BCL-2、UBC、STAT3等[9]。由于PML核体具有多种生物学功能成为生命科学研究领域的热点,但目前国内外的研究主要集中于PML核体在实体瘤的发生及治疗中的新发现,而在非APL髓系白血病的研究相对较少。
2 PML在造血干细胞以及慢性髓系白血病的调节作用
2.1 PML 在造血干细胞中的调节作用 与磷酸酶和张力素同源酶(PTEN)类似,PML通过多种水平负调控PI3K/AKT/mTOR信号通路,其中PML-NBs 募集AKT 磷酸酶PP2a 和磷酸化AKT 后共定位于核内,使磷酸化AKT失活从而达到抑癌作用。ITO等[3]研究发现,PML 高表达于造血干细胞中,但其与造血干细胞分化程度呈负相关。敲除后的PML-/-小鼠骨髓中的造血干细胞数显著少于野生型小鼠,提示PML可能与造血干细胞增殖有着密切联系。
2.2 PML在慢性髓系白血病中的表达与作用 ITO等[3],基于PML 对造血干细胞维持具有关键作用的这一假设成立,深入研究发现在80 例CML 患者慢性期标本中PML 基因表达水平较高;且与低表达患者相比,低表达患者分子遗传学缓解率更优预示着临床疗效更佳;提示PML可能与CML发展、患者预后有着紧密联系。在对CML疾病模型分析时也支持这一观点,敲除PML 后的白血病干细胞(leukemia stem cells,LICs)克隆形成能力降低,最终消耗殆尽。CML 白血病细胞可能通过PML-PTEN 信号通路维持细胞存活。PTEN 是最常见的肿瘤抑制因子之一[10-11],PTEN通常定位于细胞核和胞浆中,在细胞核内定位的能力对于维持基因组的稳定性和抑制生长是必不可少的。相关研究指出,在许多癌症标本中PTEN 核定位是经常性丢失的[12]。肿瘤抑制因子PTEN受疱疹病毒相关泛素特异性蛋白酶(HAUSP 或称USP7)的负调控,而HAUSP具有调节p53的抑癌功能。SONG等[13]研究报道,PTEN核质穿梭受到HAUSP的去泛素化调控。HAUSP 使PTEN 去泛素化,HAUSP 则受到PML负调控[14]。MOROTTI等[15]在对BCR-ABL阳性的造血祖母细胞研究中发现,PML低水平表达时,HAUSP活性增高并使PTEN 去泛素化,PTEN 发生核排斥,使造血祖母细胞增殖。且指出BCR-ABL是直接通过酪氨酸激酶活性使HAUSP 磷酸化,导致PTEN 的核排斥,CML造血祖细胞获得异常增殖优势。在对CML干细胞的研究中发现高表达的PML 抵消了BCR-ABL 对PTEN 的核排斥作用,致使PTEN 在细胞核中积累,最终维持CML干细胞静止状态,这种状态维持白血病细胞产生耐药性是所必须的。应用AS2O3联合IM 处理CML 干细胞后PML 降解,促使CML 干细胞对IM 敏感。总之,PML 介导HAUSP 负调控,支持PTEN 核定位,BCR-ABL 则与PML 功能相反,以促进PTEN 核排斥(图1)。
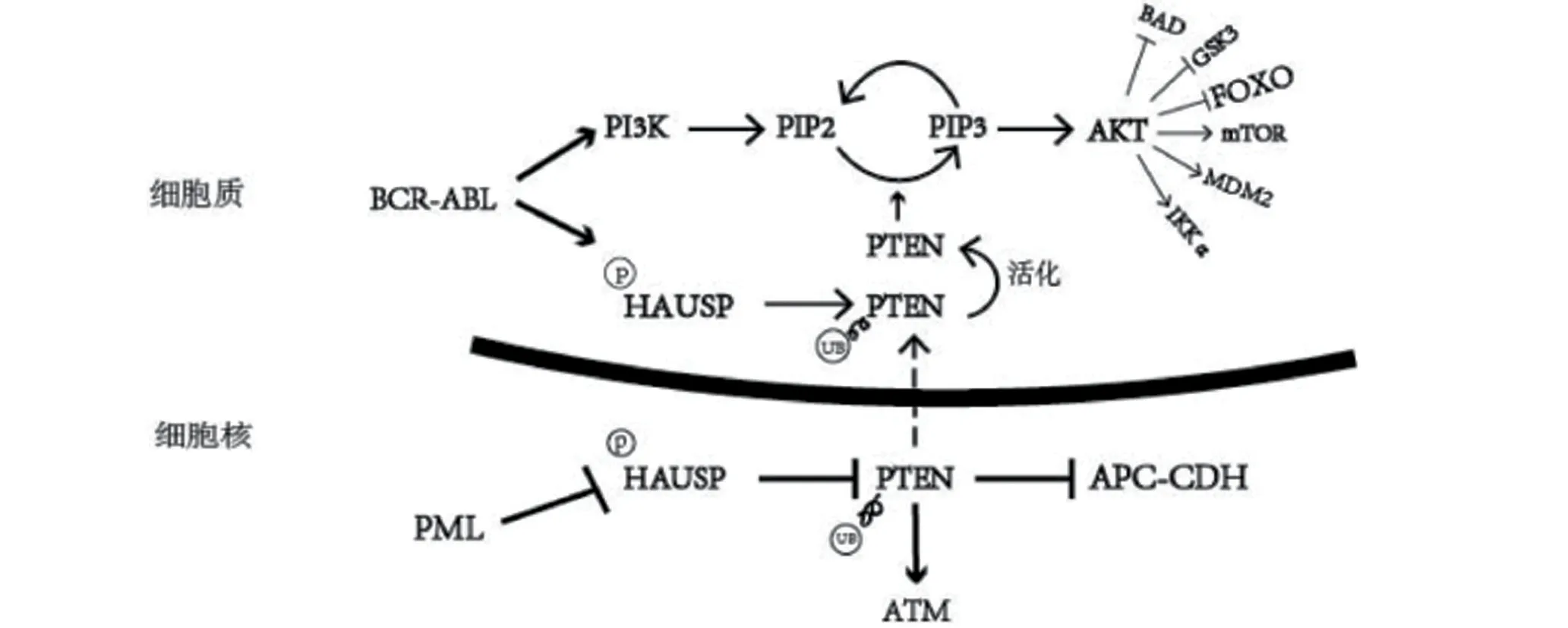
图1 PML-PTEN信号通路图
最新研究报道,骨髓间充质干细胞(mesenchymal stem cells,MSCs)的PML 调节其促炎因子对于维持CML细胞增殖具有一定作用[16-18]。GUARNERIO等[19]将BCR-ABL 阳 性 的CML 与MSCs (PML-/-)、MSCs(PML+/+)体外共培养时,发现当与MSCs(PML+/+)共培养时白血病细胞数量有明显增多。提示MSCs(PML+/+)可能具有维持白血病细胞作用。后经AS2O3处理的CML 细胞与MSCs(PML+/+)共培养,发现白血病细胞与未处理组比较数量明显减少。其次PML 调控趋化因子CXCL1和IL-6在白血病的发展过程中也起着重要的作用。在白血病患者血清样本中发现CXCL1和IL-6水平高于对照组,提示将这两种细胞因子作为其他细胞因子或其受体的靶点,可能与联合常规化疗治疗的白血病患者带来良好预后[20]。该研究提示,在CML 中,BCR/ABL 控制IL-6 的表达,并通过IL-6建立旁分泌环,进而维持白血病细胞。但PML的靶向降解或选择性抑制PML诱导的因子(如:IL-6),是否有助于根除CML的微小残留病灶,以及是否可能通过增高IL-6水平使细胞凋亡途径受限,使白血病细胞维持静止态,还需进一步研究验证。
临床研究中,发现一例78 岁男性患者初诊为CML 经服IM6 个月后因头昏及易疲劳遂改服达沙替尼(二代酪氨酸酶抑制剂)。由于患者无定期随访史,7年后复查报告显示原始细胞占2%、早幼粒细胞占18%,应用荧光原位杂交分析发现BCR-ABL融合蛋白(P210)与PML-RARα融合蛋白拷贝数相当,分别为48.25 和46.44,已达中度风险的APL 诊断标准。随后给予维甲酸和AS2O3治疗,复查融合蛋白转录水平,发现BCR-ABL 融合蛋白(p210)和PML-RARα表达水平明显减少[21]。该研究提示,PML 在IM 治疗的CML 患者中可能伴随疾病发展。虽然这类病例目前少有报道,但随着酪氨酸激酶抑制剂与化疗药物的使用,CML 患者继而发生耐药情况。耐药白血病细胞可能通过PML介导的信号通路维持生存,但调控分子机制尚未完全了解。
3 针对PML治疗对策探索
3.1 砷剂治疗PML-RARα(+)APL、CML 砷在传统中医用药已有两千多年的历史,我国研究人员最初使用AS2O3和氯化汞溶液治疗急性和慢性白血病患者,随后报道了APL患者成功治愈,并指出使用AS2O3对APL 细胞呈剂量依赖性。科学家们进一步深入研究证明[22],砷的治疗效果是由于其对融合蛋白PML-RARα中的PML 部分起作用,砷与PML 蛋白B2结构域中的两个半胱氨酸残基结合,诱导氧化导致二硫键形成,并使PML发生小泛素化相关修饰(SUMO),并引起环指蛋白4 (RNF4,是一种泛素连接酶)聚集,最后形成的泛素化PML-RARα复合物将通过泛素-蛋白酶体途径被降解[23-24]。针对CML确诊治疗后,建议定期监测PML-RARα融合。发生PML-RARα融合的患者,治疗上采取全反式维甲酸和AS2O3可达到形态学缓解[21]。随着药物靶向抑制癌基因的发展,AS2O3消除肿瘤细胞受到广泛青睐。但据报道,AS2O3的毒副作用较大可引起白血病患者骨髓抑制、肝功能障碍、胃肠紊乱以及对心脏等的毒副作用[25-28]。
3.2 药用植物活性成分诱导PML-RARα(+)APL细胞凋亡的研究进展 MALIHEH等[29]利用西红花素诱导急性APL 细胞凋亡,发现西红花素能使PML-RARα融合基因表达下调,并通过BAX/BCL2途径使白血病细胞发生凋亡。邓守恒等[30]研究提示,硒化壳聚糖处理NB4 细胞时降低PML-RARα融合蛋白含量并抑制细胞增殖。陈铭阳等[31]在对龟甲中潜在药理活性的miRNA 研究中通过靶基因预测结果显示一条取名为xtr-miR-22的miRNA可作用于PML基因的表达,预示着其潜在治疗早幼粒细胞白血病的药理活性。吴迪炯等[32]利用苦参碱联合全反式维甲酸处理耐药的NB4细胞时,发现细胞获得再分化的能力,同时降低PML-RARα融合蛋白的含量。朱红青等[33]研究发现利用葛根总黄酮体外能诱导早幼粒细胞白血病细胞株NB4 凋亡。杨雷等[34]利用丹参酮ⅡA 治疗耐AS2O3和全反式维甲酸治疗APL,白血病患者使用丹参酮ⅡA治疗后骨髓形态学达到完全缓解;此外,丹参酮ⅡA还能促进CML细胞凋亡[35]。综上,中药活性成分作为当前肿瘤治疗的重要途径之一。大量药理学研究证明,其具有多成分、多靶点干预、副作用低等优势,但中药针对PML靶基因抑制的开发具有潜在巨大价值。
4 结语
PML在DNA损伤反应、细胞凋亡、衰老和血管生成等执行着多种生物学功能。进一步研究表明,PML在CML 细胞维持中具有重要意义;PML 可能通过PML-PTEN 通路介导肿瘤细胞生存。尽管经IM 治疗的CML患者出现PML-RARα融合及早幼粒细胞爆发现象比较罕见,但这种现象是因IM治疗后获得还是伴随CML疾病发展出现,尚未见相关文献报道。新的治疗方法可能针对PML,用以靶向下调PML表达或使肿瘤干细胞消耗殆尽。无论是在正常还是病理条件下,进一步研究PML及其相关通路都可能提供更多的药物靶点,并将有助于治疗慢性髓系白血病开辟新道路。
早期药理研究中指出利用AS2O促成PML蛋白降解,但据相关报道分别指出AS2O3造成机体肝脏、心脏损害的毒性是不可忽略的,因此寻找新药代替AS2O3或联合化疗药物、酪氨酸抑制剂使用靶向下调PML 基因的表达是必要的。部分研究已证明中药活性有效成分可抑制PML-RARα融合基因/蛋白的表达[36-37],但是否通过靶向作用于PML 基因及其作用机制则需通过实验进一步证明。随着中医理论与血液肿瘤的关系不断的深入,通过中医药手段来降低患者的放化疗毒副作用及复发率,提高肿瘤患者的生存率,具有广阔的临床应用前景。
