结肠癌中miR-592、SOX9的表达与临床病理特征及预后的关系
2020-07-23陈玉昌吴秋菊
陈玉昌,吴秋菊
1.长武县人民医院内科,陕西 咸阳 713600;2.渭南市第二医院消化内科,陕西 渭南 714000
结肠癌是一种常见的消化道恶性肿瘤,在男性和中老年人群中发病率较高,病死率极高。近年来,由于人们饮食结构改变、吸烟酗酒等不良习惯增加,结肠癌发病处于上升趋势。若结肠癌不能得到有效诊断和治疗,将严重威胁人类生命健康[1]。研究发现,微小RNA(MicroRNA,miRNA)-592 在肝癌细胞中下调,与肝癌患者淋巴结转移、肿瘤侵袭及生存率降低等相关[2]。神经胶质瘤组织中miR-592也被证实低表达,上调其表达能显著抑制该肿瘤细胞生长,促进细胞凋亡[3]。Sry相关组蛋白9 (Sry related HMG box 9,SOX9)是一种与细胞增殖、分化密切相关的核转录因子。近年研究发现,SOX9 蛋白高表达与肝癌患者不良预后有关[4]。SOX9表达上调可通过调控表皮生长因子受体家族基因ERBB 表达促进胰腺癌进展[5]。然而miR-592 和SOX9 与结肠癌的关系未见研究。本研究通过检测miR-592、SOX9 在结肠癌组织中表达情况,分析其与患者临床病理特征及预后关系,探讨其在结肠癌进展中意义及对预后评估价值。
1 资料与方法
1.1 一般资料 选择2010 年2 月至2016 年2 月在长武县人民医院治疗的106例结肠癌患者为研究对象。纳入标准:①临床病理检查确诊为结肠癌;②术前未进行放、化疗者;③临床及随访资料完整。排除标准:①合并患有其他部位肿瘤者;②心、肾、肝脏等功能严重不足者;③患有严重精神疾病者。106 例患者中男性62例,女性44例;年龄31~73岁,平均(58.35±18.39)岁;根据美国癌症联合会TNM分期(第八版)[6]中的标准:Ⅰ期23例,Ⅱ期36例,Ⅲ期47例;按肿瘤部位分类:左半结肠52 例,右半结肠54 例;按分化程度分类:高分化32例、中分化44例、低分化30例;按浸润程度分类:T1~T250 例,T3~T456 例。本研究经本院伦理委员会批准。
1.2 主要仪器和试剂 荧光定量PCR 仪(型号:Mx3005P,美国Stratagene 公司),光学显微镜(型号:DM500,德国徕卡公司)。反转录试剂盒(货号:RR047a,日本TaKaRa公司),实时荧光定量(quantitative real-time PCR,qRT-PCR)试剂盒(货号:DRR041A,日本TaKaRa公司),免疫组织化学染色试剂盒(货号:8841-6599-45,美国Invitrogen 公司),兔抗人SOX9 多克隆抗体(货号:PA5-86301,美国Invitrogen公司)。
1.3 实验方法
1.3.1 样本采集 收集入组结肠癌患者经手术切除的癌组织及癌旁正常组织(距肿瘤部位>5 cm)。一部分放入液氮中迅速冷却之后,研磨并用Trizol 法提取RNA,经反转录后将所得cDNA 于-80℃冰箱保存,用于qRT-PCR实验。另一部分用10%福尔马林溶液中固定后,制成4 μm厚石蜡切片用于免疫组织化学染色实验。
1.3.2 qRT-PCR检测miR-592及SOX9 mRNA表达水平 使用qRT-PCR试剂盒配制实验所用反应体系,20 μL 反应体系如下:50×ROX Reference Dye 0.4 μL,2×SYBR®Premix Ex TaqTM10 μL,上游引物0.4 μL,下游引物0.4 μ L,cDNA 2 μ L,DEPC 处理水6.8 μ L。qRT-PCR 反应程序如下:第一步95℃,30 s。第二步95℃,10 s;61℃,33 s;40℃,1 min,第二步40 个循环。一个样品三个重复,使用2-△△CT法计算目的基因相对表达量。本次qRT-PCR所用引物如表1所示,miR-592以U6为内参基因,SOX9以GAPDH为内参基因。

表1 qRT-PCR引物序列
1.3.3 免疫组织化学染色 (1)染色方法:SOX9抗体稀释比为1:100,按照免疫组化染色试剂盒说明书进行实验。切片经二甲苯、酒精脱蜡、脱水后后用H2O2溶液浸泡15 min。在柠檬酸盐缓冲液中加热10 min。磷酸盐缓冲液(PBS)冲洗切片3次。甩干后滴加0.25%牛血清蛋白,室温孵育40 min。加SOX9 抗体,4℃孵育14 h。复温90 min、PBS 清洗后加生物素标记的二抗39℃下孵育25 min,取出后用PBS 清洗3 次,每次5 min。用DAB 显色剂显色,10 min 后苏木素复染1 min,冲洗、脱水后二甲苯固定,风干后封片。显微镜下观察,并采集图像资料,400倍镜下选择5个视野记录阳性细胞数。(2)染色结果判定:细胞核中出现棕黄色或棕褐色颗粒为阳性细胞。分别根据染色强度和阳性细胞比例记分。①染色强度:无色记0分,淡黄色记1分,棕黄色记2 分,棕褐色记3 分。②阳性细胞比例:<5%记0分,5%~25%记1 分,26%~50%记2 分,51%~75%记3分,>75%记4分。两种记分相乘,0 分为阴性(-),1~4分为弱阳性(+),5~8 分为阳性(++),9~12 分为强阳性(+++),其中阴性(-)、弱阳性(+)定义为高表达,阳性(++)、强阳性(+++)为低表达。
1.4 随访 入组患者经治疗出院后,以电话或复查方式对其进行3 年随访,每3 个月1 次,随访期间观察并记录患者生存情况。
1.5 统计学方法 应用SPSS22.0 软件对本研究中数据进行分析。计量资料以均数±标准差(±s)表示,组间两两比较采用t 检验;计数资料比较采用χ2检验;采用Pearson 法进行相关性分析;Kaplan-Meier 法绘制生存曲线,行log-rank检验;用Cox比例风险回归模型进行危险因素分析。以P<0.05 表示差异有统计学意义。
2 结果
2.1 结肠癌组织和癌旁组织的miR-592、SOX9 mRNA 表达水平比较 结肠癌组织中的miR-592 表达水平显著低于癌旁组织,SOX9 mRNA 水平显著高于癌旁组织,差异均有统计学意义(P<0.05),见表2。
2.2 结肠癌组织和癌旁组织的SOX9 蛋白表达水平比较 SOX9 蛋白主要在细胞核中表达,结肠癌组织中SOX9 蛋白阳性表达率明显高于癌旁组织,差异有统计学意义(χ2=51.080,P<0.05),见表3和图1。

images/BZ_20_1272_781_2269_814.png组别结肠癌组织癌旁组织例数106 106-38 89+30 12images/BZ_20_1875_845_1913_988.png+++12 0阳性率(%)64.15 16.03
表2 结肠癌组织和癌旁组织的miR-592、SOX9 mRNA 表达水平比较(±s)
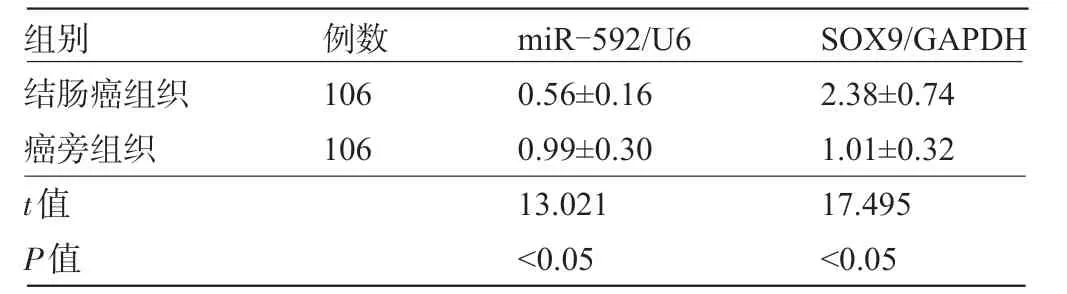
表2 结肠癌组织和癌旁组织的miR-592、SOX9 mRNA 表达水平比较(±s)
组别结肠癌组织癌旁组织t值P值例数106 106 miR-592/U6 0.56±0.16 0.99±0.30 13.021<0.05 SOX9/GAPDH 2.38±0.74 1.01±0.32 17.495<0.05
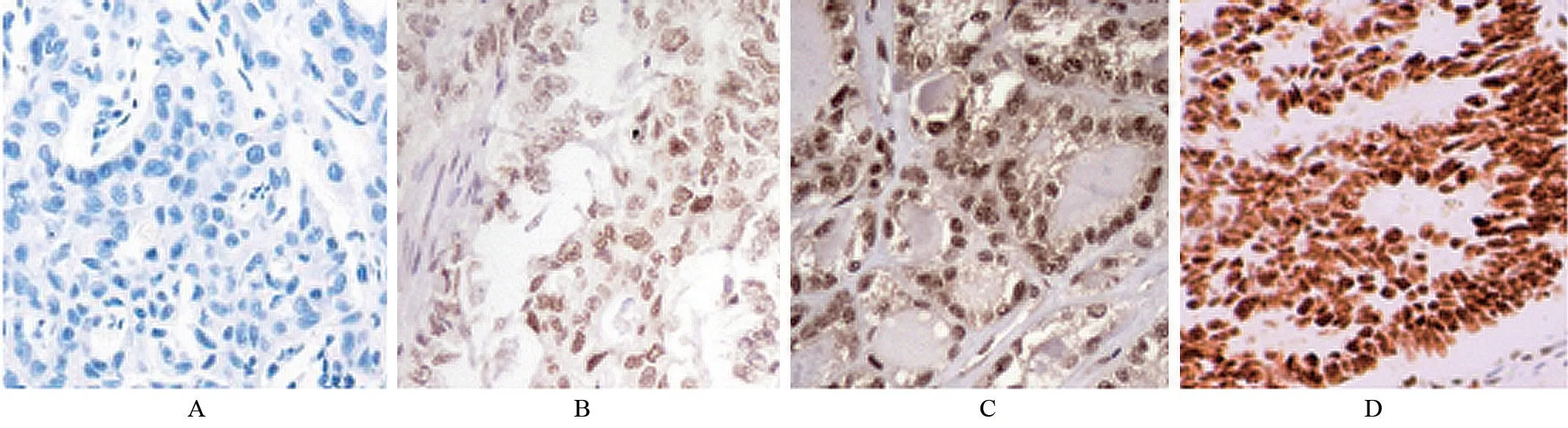
图1 结肠癌组织中SOX9蛋白表达(免疫组织化学染色,×400)
2.3 结肠癌组织中miR-592、SOX9 表达水平与临床病理特征的关系 将入组患者以结肠癌组织中miR-592 表达水平平均数(0.59)和SOX9 蛋白免疫组织化学染色结果,分为高表达组和低表达组。结肠癌组织中miR-592、SOX9 表达水平与性别、年龄、肿瘤直径、肿瘤部位无关(P>0.05),与分化程度、浸润程度、TNM 分期、淋巴结转移、远处转移有关(P<0.05),见表4。

表4 miR-592、SOX9表达与结肠癌患者临床病理特征的关系[例(%)]
2.4 结肠癌组织中miR-592、SOX9 mRNA表达相关性 如图2 所示,结肠癌组织中miR-592 与SOX9 mRNA表达水平呈负相关(r=-0.562,P<0.05)。
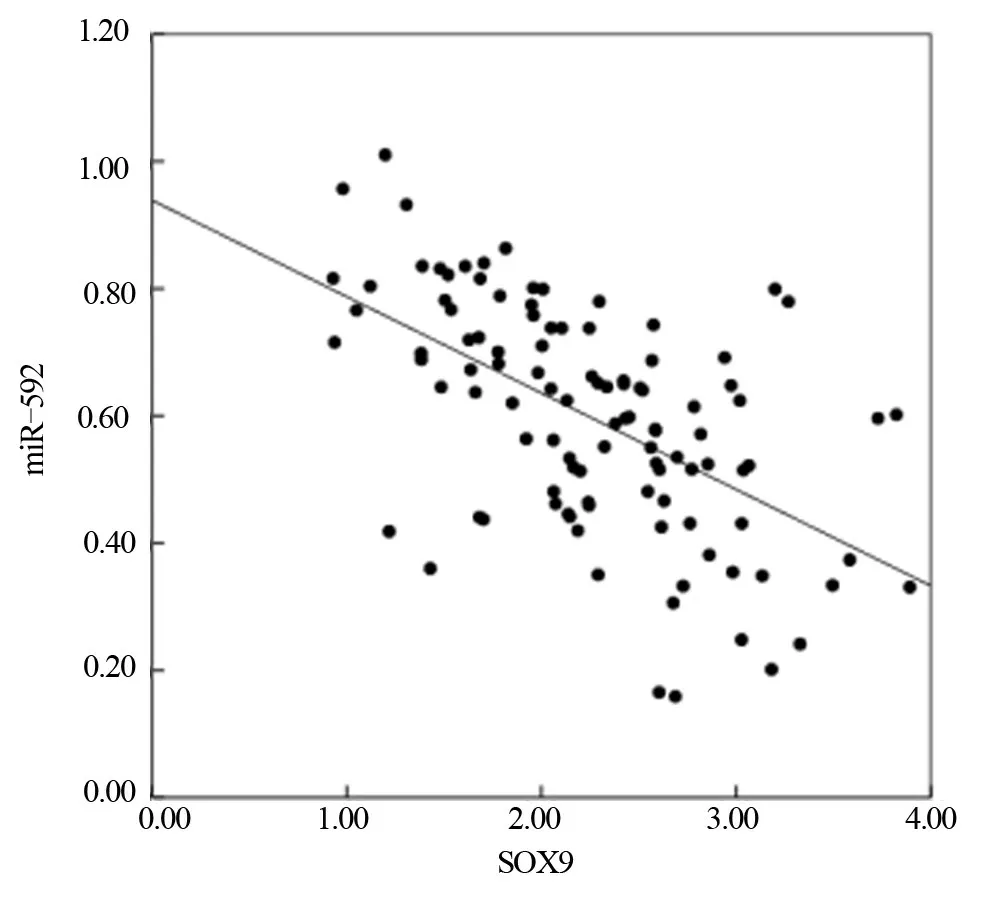
图2 结肠癌组织中miR-592与SOX9相关性分析
2.5 miR-592和SOX9表达与结肠癌患者预后相关性 通过Kaplan-Meier 生存分析可知,miR-592 低表达组患者3 年生存13 例,死亡46 例;miR-592 高表达组患者3年生存32例,死亡15例。miR-592低表达组患者3年总生存率为22.03%,明显低于高表达组患者的68.08%,差异有统计学意义(P<0.05)。
SOX9 高表达组患者3 年生存16 例,死亡52 例;SOX9 低表达组患者3 年生存29 例,死亡9 例。SOX9 高表达组患者3 年总生存率为42.11%,明显低于低表达组患者的76.32%,差异有统计学意义(P<0.05),见图3。
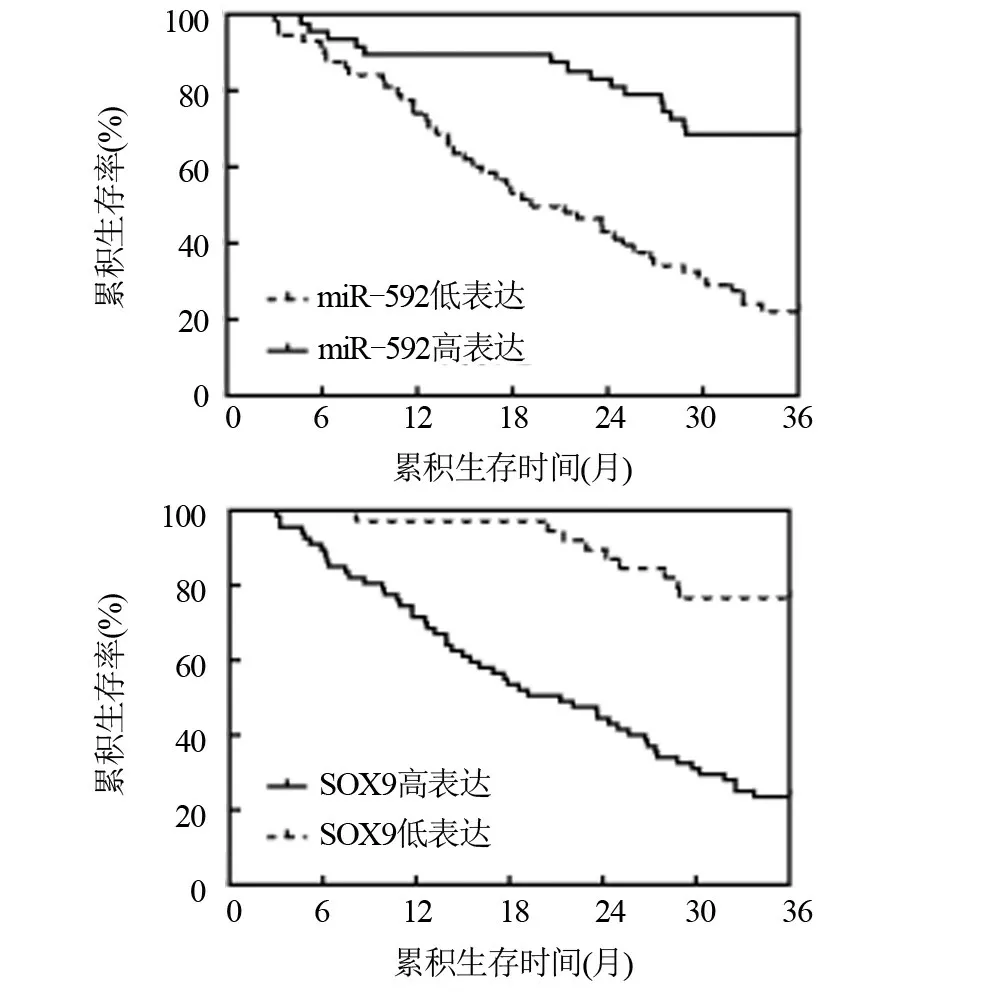
图3 Kaplan-Meier生存分析
2.6 结肠癌患者预后影响因素 Cox 回归模型单因素分析结果显示,性别、年龄、肿瘤直径、肿瘤部位与结肠癌患者预后无关(P>0.05);右半结肠、低分化、T3-T4浸润、TNM分期Ⅲ期、淋巴结转移、miR-592低表达、SOX9 高表达是影响结肠癌患者不良预后的危险因素(P<0.05)。多因素分析结果显示,TNM 分期Ⅲ期、淋巴结转移、miR-592 低表达、SOX9 高表达是影响结肠癌患者不良预后的独立危险因素(P<0.05),见表5。
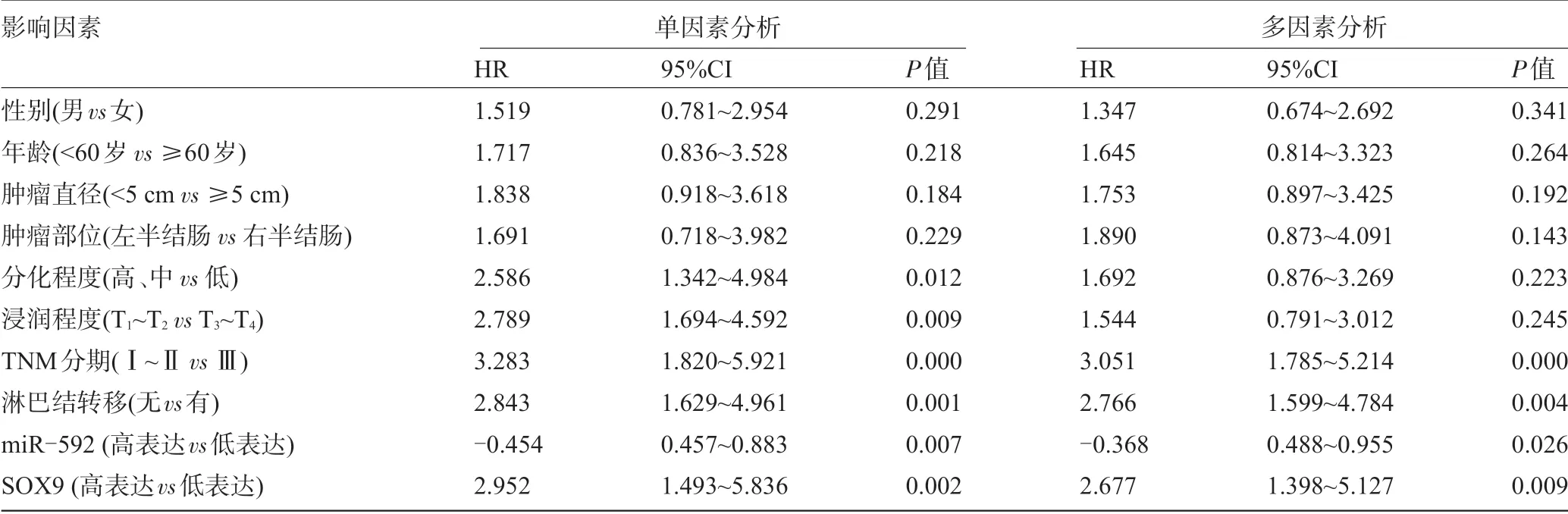
表5 结肠癌患者预后的影响因素
3 讨论
结肠癌患者在患病初期不易被确诊,多数患者入院治疗时肿瘤已进展至中晚期[7],临床探究与结肠癌相关的早期诊断标志物及结肠癌预后影响因子,对提高结肠癌诊断效果、改善患者预后有一定意义。miRNA是一类具有调控功能的短链RNA,在肿瘤进展中有调控作用。研究表明,miR-126在结肠癌组织中低表达,可作为结肠癌潜在诊断标志物和治疗靶点[8],miR-375在结肠癌中也被证实显著下调,可靶向抑制结肠癌细胞增殖、迁移,促进细胞凋亡[9],表明多种miRNA与结肠癌进展有关,可能影响结肠癌患者预后。
miR-592属于miRNA家族,据报道miR-592在乳腺癌组织中明显下调,体外过表达miR-592可显著抑制乳腺癌细胞增殖、迁移和侵袭[10]。LI等[11]发现,非小细胞肺癌组织中miR-592表达下调,可能作为生物标志物诊断预测非小细胞肺癌发生发展[11]。本研究结果表明,结肠癌组织中miR-592 表达水平显著降低,差异有统计学意义,与前人在乳腺癌[10]和非小细胞肺癌[11]中研究结果一致,提示miR-592 可能与结肠癌发生有关[10,12]。JIA 等[12]研究报道,miR-592 在肝癌细胞中低表达,与肿瘤分期和淋巴结转移等有关。本研究发现,miR-592表达水平变化与结肠癌分化程度、浸润程度、TNM 分期、淋巴结转移、远处转移有关,提示miR-592 低表达可能通过影响结肠癌细胞增殖、侵袭等促进肿瘤分化程度降低、TNM 分期升高、淋巴结转移及远处转移,参与结肠癌进展。
SOX9作为SOX家族转录因子一员,具有SOX家族共性,与人类生长发育多种生物过程有关。研究发现,敲除SOX9 可显著抑制甲状腺乳头状癌细胞增殖和侵袭[13]。SOX9 被发现在非小细胞肺癌组织中表达上调,与肿瘤转移有关[14]。另有研究报道,SOX9高表达与胃癌淋巴结转移和患者低生存率有关[15]。本研究中,SOX9 mRNA在结肠癌组织中表达水平显著上调,且SOX9蛋白在结肠癌组织中阳性表达率显著高于癌旁组织,差异均有统计学意义。进一步分析发现,SOX9 蛋白表达水平与分化程度、浸润程度、TNM 分期、淋巴结转移有关,与前人在甲状腺肿瘤[13]和胃癌[15]中研究结果一致,提示SOX9 表达上调可能通过调控癌细胞增殖和迁移,影响肿瘤低分化、TNM分期升高、淋巴结转移及远处转移,促进结肠癌发生发展。
另本研究结果显示,miR-592 低表达、SOX9 高表达组患者3 年总生存率分别显著低于miR-592 高表达、SOX9低表达组患者,提示miR-592低表达、SOX9高表达可能预示结肠癌患者生存率低等不良预后。且低分化、T3-T4浸润、TNM 分期Ⅲ期、淋巴结转移、miR-592 低表达、SOX9 高表达是影响结肠癌患者不良预后危险因素,进一步提示miR-592、SOX9 可作为评估结肠癌患者不良预后的生物标志物。LI 等[11]研究发现,miR-592 可能通过抑制SOX9 蛋白活性在非小细胞肺癌中作为抑癌因子发挥作用。本研究经Targetscan 网站预测发现,SOX9 是miR-592 的靶基因,且结肠癌组织中miR-592 与SOX9 mRNA 水平呈负相关,提示miR-592和SOX9可能相互作用,共同参与结肠癌发生发展,与LI等[11]在非小细胞肺癌研究中结果相似,但具体作用机制有待进一步研究。
综上所述,结肠癌组织中miR-592 表达下调、SOX9 表达上调,与肿瘤部位、分化程度、TNM 分期、淋巴结转移及患者生存率低等有关,两者之间可能存在作用机制共同参与结肠癌进展,对结肠癌预后评估有一定意义。但本研究未能深入研究miR-592 与SOX9 相互作用机制,将在下一步研究中进行验证和探究。
