色谱及色谱-质谱技术在复杂基质中赤霉素痕量分析中的应用
2020-07-23姜长岭代金霞鲁成银陈红平
姜长岭,代金霞,刘 新,鲁成银,陈红平,*
(1.中国农业科学院茶叶研究所,浙江 杭州 310008;2.中国农业科学院研究生院,北京 100081;3.农业农村部茶叶产品质量安全风险评估实验室,浙江 杭州 310008)
赤霉素(gibberellins,GAs)是一种植物生长激素,能够刺激细胞伸长并影响各种发育过程,如刺激茎伸长、种子萌发、休眠、开花、性别表达、酶诱导以及叶和果实衰老等。1926年,Kurosawa[1]研究一种导致水稻过度生长的常见疾病,发现患病水稻的过度生长是由感染植物的真菌分泌的化学物质所致。Yabuta[2]从培养真菌的滤液中分离出这种化学物质,称其为GAs。GAs是一类四环二萜酸,它的基本结构是二十碳赤霉烷,根据赤霉烷上双键和羟基的数目、位置不同,以及内酯环的有无,形成了不同的GAs。根据分子中碳原子数目的不同,GAs可分为两种类型:C-19 GA和C-20 GA,其对应结构如图1[3]所示。C-19 GA是由C-20 GA转变而来,但是包含的种类多于C-20 GA。虽然在植物中发现了许多种GAs,但只有很少一部分GAs具有激素的生理活性。通常,C-19 GA是具有生物活性的GAs,其中最常见的具有生理活性的GAs有GA1、GA3、GA4和GA7[4]。GAs按照其发现的顺序依次从GA1到GAn进行命名,GA3是第一个在结构上确认的GAs。截止到目前,在植物、真菌及细菌中已经确认有136 种GAs[5]。
图1 C-19 GA(A)和C-20 GA(B)的结构[3]Fig. 1 Structures of C-19 (A) and C-20 (B) gibberellins[3]
GAs是一种广谱性的植物生长调节剂,被广泛应用于植物生长和发育的各个阶段。同时,GAs也属于低毒农药,但若短期大量摄入或长期在体内蓄积,会对机体各系统产生严重的损伤,例如许春爽等[6]研究发现GAs会对精子造成损伤。Erin等[7]研究发现,GAs与肿瘤形成也有一定关系。因此,植物源性食品中GAs的有效检测、鉴定与监测对于食品安全以及风险评估具有重要的意义。
GAs痕量分析一直是GAs合成途径、生理活性和代谢调控研究的难点,随着分析仪器和分析手段的不断完善,分析方法灵敏度与精密度不断提升。GAs分析包括样品前处理与仪器分析两个重要环节。样品前处理是整个分析周期中的关键过程,可以分离甚至富集分析物,实现超痕量分析,消除基质干扰的影响。因此,选择一种快速、简单和自动化的样品前处理方法,可以帮助节省时间和精力,降低偶然误差和系统误差,减少溶剂用量。GAs检测的前处理技术经历了传统的液液萃取(liquid liquid extraction,LLE)向固相萃取(solid phase extraction,SPE)、液相微萃取(liquid phase microextraction,LPME)以及一些新兴的样品前处理技术的发展过程[8]。此外,在过去20 年中已经开发出固相微萃取(solid phase microextraction,SPME)和LPME样品制备的小型化装置,这种装置具有进一步减少溶剂消耗的优点,特别适用于痕量分析和原位分析。这些创新性的样品制备方法是GAs分析的有力工具,有希望用于植物内源性GAs追踪和调节机制的研究。
近年来,随着仪器分析技术的高速发展,尤其是串联质谱、高分辨质谱(high resolution mass spectrometry,HRMS)分析仪器在提高灵敏度、精密度以及分辨率方面取得突飞猛进的进步,使得GAs分析技术迈上一个新平台,实现了快速、高通量、高灵敏的精准定量分析,解决了植物激素含量低、结构相近以及复杂基质干扰等导致的传统色谱法无法精准定量的缺陷,同时实现了植物组织微量样品分析,以及微区域GAs分布特征分析等。
本文查阅了近10 年来关于GAs检测分析的报道,从样品前处理与仪器分析两个方面分别介绍各种技术方法以及应用的具体实例。此外,作为可行性更高且可以提高检测灵敏度的补充方法,还将突出总结富集效果更好的改良SPE技术与化学标记法这两类前处理方法,以及基于液相色谱-质谱法(liquid chromatographymass spectrometry,LC-MS)、新型纳升电喷雾离子源(nano-electron spray ionization,Nano-ESI)技术与HRMS的应用。
1 GAs前处理方法研究进展
在最近10 年里,GAs检测的样品前处理技术已经有了广泛且深入的研究。对Web of Science数据库中的文献进行检索,总结了2012—2018年以来关于GAs检测方法的文章,结果如图2所示。平均每年发表10 篇关于GAs检测方法的文章;前处理过程主要采用SPE与LLE,部分文献开发了新型的前处理技术,或是在SPE与LLE的基础上进一步优化,对于一些新型复杂的标记技术以及一些快速检测的传感器技术都归于其他方法中;在分析手段方面,LC法依旧是近年来针对GAs检测的主流方法,按照LC所连接检测器的不同,其分为LC-紫外光谱法、LC-荧光检测法等,其中LC-MS是目前最常用的GAs分析方法。

图2 基于Web of Science数据库检索的2012—2018年发表的关于GAs检测的论文Fig. 2 Summary of published papers on gibberellin determination from 2012 to 2018 retrieved from the Web of Science database
1.1 固相萃取法
SPE是运用最为广泛的样品纯化除杂方法,它主要通过在SPE柱中填充吸附剂从而达到对目标化合物的净化效果。根据弱酸类植物激素的极性进行纯化,常用的SPE柱按照其填充的吸附剂的不同有如下几类:十八烷基硅烷键合硅胶反相吸附剂(如C18柱)、亲水亲脂复合物两性吸附剂(如HLB柱)、混合模式阴离子交换吸附剂(如MAX柱)、混合模式阳离子交换吸附剂(如MCX柱)。SPE技术因萃取柱以及提取试剂的不同,其萃取效果有显著差异。如C18柱可以除去大量非极性的叶绿素基质,同时也可以通过调节淋洗液和洗脱液来除去一些极性很强的基质。但C18除杂能力有限,当植物中含有大量非极性基质时常常会产生很大的基质干扰峰。所以单纯采用C18柱仅适用于一些基质不太复杂的样品。
Cui Kuanyan等[9]利用LC-ESI-MS/MS检测油菜中GA1、GA3、GA43 种GAs的回收率,比较MCX、MAX、C18与HLB这4 种SPE柱的净化效果,结果显示单独使用情况下,MCX柱相对优于MAX柱、C18柱与HLB柱(GA3除外,在使用MCX柱时其对应回收率低至19.5%),而其他SPE柱对3 种GAs的回收率均小于50%。所以一般来讲,单纯采用SPE柱的净化方法难以处理复杂的植物组织提取液,因此串联SPE柱应用更为广泛。
Urbanová等[10]以拟南芥为材料,前处理过程以80%(体积分数,下同)乙腈+4%甲酸作为提取液,运用两次SPE步骤(MCX柱串联HLB柱和单一MAX柱)对GAs进行净化处理,随后进行超高效液相色谱(ultra performance liquid chromatography,UPLC)-ESI-MS/MS测定,得到一种可行性较高的对多种GAs进行同时定量的方法。最终得到20 种GAs的内标平均回收率为72%,检出限(limit of detection,LODs)小于0.1 pmol/mg。Liu Shichang等[11]也是采用类似的两次SPE步骤(MCX柱和MAX柱),结合HPLC-ESI-MSn检测,成功地对10 种GAs进行定量分析。最终得到10 种GAs的LODs都小于400 fmol/mL(其中8 种GAs小于100 fmol/mL)。
图3 串联SPE结合LLE的前处理流程[12]Fig. 3 Scheme of sample preparation by tandem solid phase extraction followed by liquid liquid extraction[12]
除了单独运用SPE技术,SPE结合其他技术原理(如LLE)也常用于GAs检测。Chen Mingluan等[12]利用SPE结合LLE对小麦叶中酸性植物激素进行富集,结合纳升LC-电喷雾离子源-飞行时间质谱(nano-LC-ESI-quadrupole-time of flight-MS,Nano-LC-ESI-Q-TOF-MS)检测,得到一种能够有效检测10 种GAs的前处理方法。其前处理过程如图3所示,小麦提取液经C18柱与SAX柱净化后,再经LLE萃取,最后通过衍生化试剂3-溴乙酰基三甲基溴化铵(3-bromoactonyltrimethylammonium bromide,BTA)进行柱前衍生化反应,最终得到10 种GAs的LODs均小于60 pg/mL,回收率在85%~105%之间。Cui Kuanyan等[9]用同样的前处理方式,以SPE与LLE相结合的前处理方式,LC-EI-MS检测,成功建立了一种同时测定GA1、GA3、GA43 种GAs的方法,方法回收率为80%~115%,LOD分别为0.012、0.004 2、0.016 ng/mL。
虽然单独使用SPE柱对GAs的净化效果并不理想,但是基于SPE的原理,进行不同SPE柱组合或者SPE结合LLE却能够起到很好的净化效果。这种改良SPE虽然增加了前处理过程复杂性,但却有很好富集效果,可行性高,结合LC-MS可以对多种GAs进行同时检测,得到极低的检出限。该方法是目前针对多种GAs痕量分析最稳定、最可靠的方法之一。
1.2 基质固相分散萃取法
近年来发展起来的MSPD是一种用于固体和黏稠液体样品的前处理技术,它实际上是使SPE过程和浸提过程同步进行,同时破碎样品和提取目标化合物,使得提取和净化步骤合二为一[13]。MSPD首先利用机械混合研磨使样品完全破裂,加快目标化合物溶出、提取,再利用样品基质与化学固定相选择性相互作用进行初步分离。其操作步骤简单来讲就是将样品基质与固定相材料混合研磨,并填装到SPE柱中,再用溶剂将分析物洗脱。
王璐[14]利用MSPD技术开发了一种同时检测3 种GAs(GA1、GA3、GA4)的方法,该方法以拟南芥为材料,将样品与C18填料混合研磨,80%冷甲醇-水溶液作为提取液,最终得到的3 种GAs回收率在69.2%~87.0%之间,GA1、GA3、GA4检出限分别为4.1、1.1、1.5 ng/g。Deng Ting等[15]利用微尺度基质固相分散萃取结合柱前衍生化技术建立了同时检测8 种GAs前处理方法,如图4所示,在极低取样量下通过在单一试管里进行提取以及净化过程,该方法成功地用于极低浓度下检测单个叶片中GAs的分布规律,凸显了高灵敏度(8 种GAs的LODs均小于1.4 pg/mL)与低样品消耗量的特点,而且该前处理方法始终在一个试管中进行,有效地避免了样品的损失,整体回收率在80%~105%。
由于MSPD操作简单、前处理时间短,尤其适用于稳定性较差的化合物,因此MSPD已经得到越来越多的关注。且MSPD与其他前处理技术具有很强的兼容性,MSPD与离心、超声波、微波和磁力等工艺结合,可以提高MSPD的提取效率。它还可以与其他提取技术相结合,特别是一些微萃取技术[16]。目前应用MSPD对GAs进行检测的研究还相对较少,但MSPD对于GAs的痕量检测却是具有很大的应用前景。
1.3 QuEChERS法
2003年Anastassiades等[17]提出了一种农产品农残检测中快速简便的QuEChERS前处理方法,该方法采用乙腈萃取/分配结合“分散SPE”。该方法巧妙地将提取与纯化的步骤结合在一起,溶剂、盐与吸附剂的独特组合使得提取效率得到很大提升。直到目前,QuEChERS法仍是水果蔬菜中农残检测最为常用的前处理方式。由于该方法具有“绿色化学”特征,因此被迅速应用到环境、农业和生物分析等领域[18]。该方法因其极大的灵活性可以形成很多不同版本的QuEChERS技术,这些改良QuEChERS技术,结合高灵敏、高选择性的色谱-质谱分析技术,使得农残检测前处理技术迈上一个新台阶。
Chen Yaling等[19]采用改良QuEChERS方法建立了5 种水果中GA3的检测方法,该技术采用含4%盐酸的乙腈为提取溶剂结合适量的N-丙基乙二胺(primary secondary amine,PSA)、石墨化炭黑(graphitized carbon black,GCB)吸附剂,最终得到GA3的LOD为5.68 μg/kg,回收率在78.5%~106%之间,相对标准偏差(relative standard deviation,RSD)小于15%。Liu Shaoying等[20]以含有1%醋酸的乙腈为提取溶剂结合C18吸附剂的QuEChERS技术,建立4 种水果中14 种植物生长调节剂或杀菌剂的检测方法,其中GA3的LOD为0.6 μg/kg,回收率在70%~85%之间,RSD小于12%。
QuEChERS是目前使用非常普遍的前处理方法,正如其名称所含的特点,相对于其他前处理方式,它的灵活性更好。不同的吸附剂组合配合不同的提取溶剂,可以开发出适合于不同样品材料的改良QuEChERS技术。尽管如此,QuEChERS技术存在一些缺陷,如净化效果不佳、方法灵敏度不足(通常是稀释样液)等导致QuEChERS技术难以适用于复杂基质中多种GAs的痕量分析,尤其是微量样品中GAs痕量分析。

图4 微尺度下样品制备方案[15]Fig. 4 Schematic illustration of the microscale sample preparation method[15]
1.4 液液萃取法
LLE的原理是基于目标分析物在两种液相之间的溶解度差异,该技术基于相似相溶解的原理,具有高极性的溶剂可以更好地溶解和提取植物基质中植物激素分子。最经典的LLE是在分液漏斗中将目标分析物从含水样品溶液中提取到非极性或极性较小的有机溶剂中。样品可单独进行LLE作为前处理过程,也可反复LLE后再进行检测,更多的是LLE与SPE联用来提高纯化效果。
Wang Qing等[21]通过一种反复LLE的方式,利用HPLC-MS/MS成功建立了蜂蜜中49 种植物激素的定量方法,其中包括利用乙腈和水相进行LLE建立起的对19 种GAs同时定量的方法。19 种GAs的检出限为2.1~628.2 pg/mL,回收率在84%~124%之间,日内及日间RSD都小于15%。该方法利用LLE的原理,成功对19 种GAs同时进行了检测。
传统的LLE显然不符合对GAs进行痕量分析的要求,除了可以反复利用LLE步骤之外,LLE与SPE结合或许更具优势,而且反复的LLE步骤是一个费时费力且容易产生误差的过程。所以LLE与其他净化方式结合起来或许更适合用于GAs的检测。
1.5 液液微萃取法
LLME是一项新型样品前处理技术,克服了传统LLE消耗大量溶剂以及SPME萃取头较昂贵、寿命短、多次使用存在交叉污染等缺点。该技术操作简单、无需特殊装置,具有成本低、富集倍数高、有机溶剂用量少等特点,是一种环境友好的样品前处理技术,因适应了当前绿色化学发展的需要而受到分析人员的广泛关注[22]。LLME主要有3 种操作模式:单液滴微萃取、中空纤维膜LPME和分散液液微萃取等形式。
近年来中空纤维膜的引入使得LLME稳定性得到很大提升,应用更为简便。Wu Qian等[23]引入中空纤维膜液-液-液微萃取(hollow fiber-based liquid-liquid-liquid micro-extraction,HF-LLLME)结合渗透法对水稻中的8 种GAs进行富集,再用HPLC-MS/MS检测,提高了萃取方法对GAs的选择性,成功建立了8 种GAs的定量方法,检出限(0.001 6~0.061 ng/mL)极低,回收率在62%~166%之间。
LLME技术由于其绿色化学的优点具有很大的发展前景。但是由于微萃取所用的材料量很少,所以造成的误差较大,稳定性较差,且其对前处理过程的精确度要求较高。LLME目前通常结合其他技术来提高准确度,对GAs检测更多的是采用LLME结合其他处理方式[23-24]。这种与其他技术结合的方式将来可能会成为GAs检测的主流前处理方法。
1.6 分子印迹技术
分子印迹技术(molecular imprinting technique,MIT)是源于20世纪中期的一种新方法。由于其具有结构可预测性、广泛适用性、特异识别性三大特点,发展极为迅速。近年来MIT由于其高选择性、简便快速性、高稳定性以及低成本和环保等显著优势,大量地应用到了食品中化学污染物的检测中。MIT是制备具有某种空间结构的分子印迹聚合物(molecularly imprinted ploymers,MIPs)的技术,该聚合物可特异性地结合模板分子。制备出的MIPs对模板分子的亲和性和选择性高,对恶劣环境具有较强的抵抗能力,稳定性强、使用寿命长,已被广泛的应用于生物、医药、材料、食品等多个领域[25]。而MIPs作为SPE吸附剂可以特异性的吸附目标产物,在食品分析中得到了较为广泛的应用。
Zhang Zhuomin等[26]采用快速简便的微波辐射方法,在最佳制备条件下合成了新型GA3磁性MIP,聚合过程见图5。该方法用含有丁基化羟基甲苯的80%(体积分数)甲醇溶液作为提取溶剂,以GA3磁性MIP对目标物进行富集,利用HPLC-MS分析,建立了4 种GAs的定量方法。最终得到4 种GAs的LODs均小于5 μg/L,对小麦和黄瓜检测回收率分别为76.0%~109.1%与79.9%~93.6%,RSD分别为2.8%~8.8%、3.1%~7.7%。该方法合成的新型GA3磁性MIP有效地对样品目标物进行了富集,得到了极低的检出限且有较好的回收率,可以作为MIT应用于多种GAs分析的可行性参考。
图5 GA3磁性MIP珠粒聚合过程的示意图[26]Fig. 5 Schematic representation of the polymerization process of GA3 mag-molecularly imprinted ploymer beads[26]
MIT是一种新兴的应用于样品前处理的技术,由于其广泛的应用前景得到越来越多的关注。虽然已有相关研究将该方法应用于对GAs的检测中,但吸附剂的制备过程太过复杂,且还没有制备出成功应用于多种GAs痕量分析的MIPs。但该方法高亲和性与选择性十分有利于目标物的富集,因此对于多种GAs的痕量分析还需进一步研制出更为有效的MIPs。
1.7 化学标记
化学标记(包括衍生化、荧光标记和同位素标记)以其高灵敏度成为目前研究前处理技术的热门方法。该方法通过一些特殊的试剂对目标物进行标记,这些标记可以显著降低实际样品中初级和次级代谢物的干扰,并提高检测选择性与灵敏度。目前化学标记的方法已经广泛应用于植物激素的痕量分析方面。
Zhu Guimei等[27]提出了一种基于叔胺标记的毛细管电泳结合电化学发光技术(capillary electrophoresis combined with electrochemical luminescence,CE-ECL)用于检测GAs的新方法,该方法以2-(2-氨乙基)-1-甲基吡咯烷作为衍生化试剂,样品经LLE与SPE处理后,采用CE-ECL检测。对黄豆中GA3的检出限为8×10-8mol/L,回收率在89.6%~99.3%之间。Li Guoliang等[24]提出了一种采用2-(11H-苯[a]咔唑)乙基对甲苯磺酸酯作为标记试剂的新型柱前荧光标记方法,利用高效液相色谱(high performance liquid chromatography,HPLC)结合荧光检测器对7 种植物生长调节剂进行定量分析。最终得到5 种水果GA3的回收率为90%~105%,检出限为2.1 nmol/L。
Cai Wenjing等[28]建立了一步式多功能衍生化的方法,对31 种植物激素进行同时检测,其中包括14 种GAs,该方法采用乙腈进行提取,以N,N-二乙基乙二胺(N,N-diethyl ethylenediamine,DEED)作为GAs的衍生化试剂,衍生化条件在40 ℃持续10 min,最后由UPLC-MS/MS检测。最终得到14 种GAs的检出限为1.8~20.0 fg/mL,回收率为80.7%~120.4%,日内以及日间RSD都小于11.8%。该方法充分利用衍生化过程来对多种GAs进行痕量分析,结果显示该方法可行、简便且具有高灵敏度。
Hao Yanhong等[29]提出了一种稳定同位素标记的方法,成功对水稻中的11 种GAs进行定量分析。该方法以N,N-二甲基乙二胺(N,N-dimethyl ethylenediamine,DMED)及其氘代对应物d4-DMED为衍生化试剂标记GAs,经SPE结合LLE的前处理富集、净化后,再由HPLC-ESI-MS/MS检测。其前处理过程及同位素标记衍生化过程如图6所示。该方法最终得到水稻中11 种GAs的LODs为0.02~0.74 pg/mL,回收率为72%~128%,RSD为1.0%~13.9%。

图6 样品前处理和稳定同位素标记衍生化的程序[29]Fig. 6 Procedure for sample pretreatment and stable isotope labeled derivatization[29]
Sun Xiaohong等[30]提出了一种稳定同位素标记的方法用于8 种酸性植物激素的定量分析。该方法以溴化溴代胆酰(bromocholine bromide,BETA)对经过SPE与LLE之后的样品提取液进行衍生化标记,以其氘代对应物d9-BETA对标样进行衍生化标记,然后将两组已经衍生化的提取液(一个轻标记、一个重标记)合并,进行UPLC-MS/MS分析。最终得到GA4的检出限为0.754 pg/mL,回收率为79%~92%。该方法实现了基于内标的多种植物激素的相对定量,与每种分析物的内标可用性无关,灵敏度提高了1~3 个数量级。
化学标记方法已经成功应用于GAs的痕量分析中,这些方法都具有很高的灵敏度和极低的检出限,是目前对于多种GAs痕量分析极为有效的方法。化学标记法关键在于衍生化试剂的选择,不同的试剂决定了其所能分析目标化合物种类和最终的检测灵敏度。化学标记法通常需要与其他前处理技术相结合,甚至可以将化学标记法看作是其他前处理技术的一个补充。化学标记法是目前对于植物痕量分析的主流趋势,更合适的衍生化试剂结合富集效果更好的提取和净化过程将会是决定多种GAs痕量分析的关键,也是目前研究的热点。
2 GAs分析方法研究进展
目前植物激素的检测方法较多,主要可分为生物鉴定法、免疫分析法和色谱分析法3 类[31]。生物鉴定法是一种非常经典的植物激素检测分析法。例如油菜素内酯的水稻叶弯曲测试法可达到0.05 ng/mL的检测限[32]。但它只是一种半定量方法,而且其耗时长、对检测条件要求严苛,一般的化学分析实验室难以实现。而免疫分析法近年来显示出较低的检测限,但是其仍需解决制备的抗体的交叉反应问题。目前,色谱法应用最广,可同时检测多种植物激素,且定量准确。近年来,色谱与质谱联用技术快速发展极大提高了对植物激素的选择性检测能力,能够实现准确的定性与定量分析[33]。
基于色谱法针对多种GAs痕量分析方法的研究,主要是对GAs定性问题以及检出限问题研究。由于样品基质种类繁多、基质复杂,在色谱图上往往会出现干扰峰,影响样品的定性定量分析。同时,由于GAs在植物体内含量极低,因此对GAs分析方法的精密度、准确度和灵敏度提出了非常高的要求。以下将从GC和GC-MS、LC和LC-MS两方面综述近年来GAs痕量分析手段的优缺点。
2.1 气相色谱和气相色谱-质谱法
GC是利用气体作流动相的色谱分离方法。汽化的样品被载气带入色谱柱中,柱中的固定相与试样中各组分分子作用力不同,各组分从色谱柱中流出时间不同,组分彼此分离。GC与火焰离子化检测仪(flame ionization detector,FID)或MS等检测器相结合已被广泛用于分析植物激素及其相关代谢物。其中,MS由于其较高的灵敏度和选择性已经成为最常用的一种检测工具。GAs是一类具有高沸点的极性化合物,难以被汽化,所以不能直接采用GC-MS分析。对于非挥发性化合物而言,在GC-MS之前通常需要衍生化步骤以产生挥发性产物并改善色谱信号[34]。因此,合适且稳定的衍生化过程对于GC-MS成功分析GAs至关重要。衍生化过程可以被认为是一种特殊类型的微尺度化学合成过程,其可能需要在极端温度和压力条件下持续长时间的反应[35]。现有的GAs衍生化反应原理通常是利用GAs都含有羧酸基团的化学特征,利用衍生化的过程对GAs的羧基进行反应[24,27-28,30],进而得到相应的衍生化产物。
Nehela等[36]利用GC-MS建立一种对甜橙(Citrus sinensis (L.) Osbeck)叶和根进行植物激素分析的方法,该方法采用混合溶剂(V(甲醇)∶V(水)∶V(盐酸)=80∶19.9∶0.1)作为提取液,以N-甲基-N-三甲硅基三氟乙酰胺(N-methyl-N-(trimethylsilyl) trifluoroacetamide,MSTFA)作为衍生化试剂对GAs进行衍生化反应,反应过程在加热至85 ℃的条件下持续45 min,再通过GC-MS以选择性离子检测模式分析。最终得到3 种GAs的LODs为0.02~0.07 ng/g,回收率也稳定在110%左右。该方法有效地利用GC-MS结合衍生化过程对3 种GAs进行分析,检出限极低,为GC-MS对多种GAs痕量分析提供了非常重要的参考。GC-MS是用于分析GAs的标准方法。到目前为止,有超过100 个GAs的标准MS谱图,它们构成了GAs鉴定的坚实基础。但是,GAs是具有高沸点的非挥发性化合物,因此通常需要耗时且复杂的衍生程序,以便GC-MS检测。利用GC-MS对多种GAs的痕量分析,关键在于衍生化过程,而目前用于GC-MS分析的GAs衍生化试剂研究太少,无法满足对多种GAs痕量分析的要求。但却存在许多用于提高LC-MS检测信号的GAs衍生化试剂,这些试剂增强了目标物的信号强度,提高了利用LC-MS检测的灵敏度。近年来,LC-MS已经成为了检查GAs的主要分析手段之一。
2.2 液相色谱和液相色谱-质谱法
LC由于其高分辨率己成为一个强大的分离工具,从1970年代初以来,已广泛用于痕量植物激素的分析。传统的检测器如紫外、荧光检测器通常不能提供目标化合物的结构信息,且很难实现多种分析物的同时检测[37],LC-MS由于其高灵敏度和选择性成为目前最常见与最实用的结合方式。LC-MS结合了LC有效分离热不稳性及高沸点化合物的分离能力与MS很强的组分鉴定能力,是一种分析复杂有机混合物的有效手段。LC-MS具有良好的重现性和广泛的覆盖率,LC-MS技术通常不需要衍生化步骤,相比于GC-MS节省了时间。LC-MS还具有可与不同质量分析器配合使用的优点,使大分子物质(如Nano-ESI源)、极性(ESI源)与非极性(大气压化学电离源)物质都能够有效离子化[38]。随着近年来对LC-MS的需求进一步提升,一些新技术的引入使得LC-MS得到进一步发展,如立体选择性LC-MS[39]对手性农残的分析,以及多维LC[40]对基质复杂的样品的有效分离。
GAs是一种二萜类酸,属于中等极性的分子,因而在LC中固定相宜选择极性较小的键合固定相,流动相宜选择极性较强的溶剂[41]。因此,目前较多采用反相色谱柱C18柱进行分离。流动相一般采用甲醇-水、乙腈-水两大体系。乙腈洗脱能力强,黏度比甲醇低,系统压力较低,但价格较高,毒性较强。甲醇的优势体现在经济、低毒等环保优势上,但系统压力高,洗脱能力较差。GAs在LC中的流动相通常都含有低浓度的甲酸,有助于酸性目标化合物的分离。
Cao Zhaoyun等[42]利用LC-MS结合SPE(PAX小柱)的前处理过程有效测定小麦中43 种植物激素(包括10 种GAs)。其中LC采C18色谱柱,流动相包含甲醇和5×10-3mol/L甲酸铵,以梯度洗脱的方式进行目标物分离。该方法检测10 种GAs的回收率稳定在70%~110%之间,LODs为0.19~7.57 fmol/mL,日内及日间的RSD都小于15%。
本文总结了近10 年国内部分应用LC-MS检测不同作物中GAs含量的文章(表1),发现其中前处理绝大部分都是应用SPE,色谱的色谱柱基本为C18柱,流动相大多用酸化的甲醇。
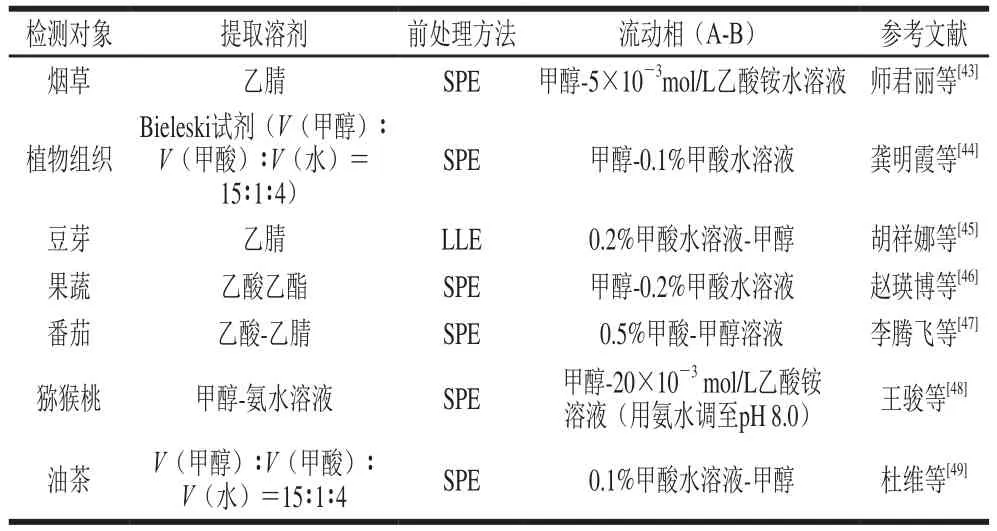
表1 LC-MS在检测GAs中的应用Table 1 Applications of liquid chromatography coupled with mass spectrometry in the detection of gibberellins
GAs检测方法的评价,不仅包括检出限以及回收率,能检测的GAs数量也是一个重要指标。近年来,植物激素检测方法研究中取得突破性进展,GAs不仅在检测限(即灵敏度)取得较大突破,同时实现了GAs高通量检测,表2总结了近10 年来利用LC检测多种GAs的部分文献。
表2所示利用LC检测GAs的研究中,均同时检测了3 种以上的GAs,且检测限都很低,稳定性较好。这些文献中LC的色谱柱大多使用C18柱,流动相以酸化的甲醇使用较多,也有采用乙腈与水作为流动相。上述文献所用材料以拟南芥与小麦为主,这类材料的基质效应相对与一些内含物质丰富的材料(如茶叶)要小很多,因而在针对不同材料的定量分析时,要调整相对应的样品前处理方式。
在LC-ESI-MS检测GAs的基础上,近些年来,一种新型的Nano-ESI结合MS被应用于GAs的痕量分析。Chen Mingluan等[12]采用一种甲基丙烯酸-乙二醇二甲基丙烯酸酯(methacrylic acid-co-ethylene glycol dimethacrylate,MAA-co-EDMA)整体柱代替常规的C18色谱柱,利用Nano-LC-ESI-Q-TOF-MS检测(图7)。该方法首先采用50 nL样品环(定量环),通过直接进样方式优化目标分析物在MAA-co-EDMA整体柱上的分离条件(流动相与洗脱梯度),然后用约85 μL MAA-co-EDMA(长7 cm、内径100 μm、外径360 μm)捕集柱代替50 nL样品环,20 μL样品液体以10 μL/min流速进样9 min后,15 种酸性植物激素衍生物通过MAA-co-EDMA整体柱被有效分离与富集(流速为0.6 μL/min),经TOF MS检测,从而提高目标化合物的进样量,克服样品液体中大量阳离子对免疫亲和色谱柱分离和TOF MS离子化效率的影响。该方法利用Nano-ESI-MS超高灵敏度的检测,成功对15 种植物激素(包括10 种GAs)进行定量分析。Zhang Zheng等[50]也采用相似的Nano-LC-MS系统,成功建立了对10 种GAs定量分析的方法,10 种GAs的检出限为0.004~0.032 ng/mL,回收率为80%~105%。该方法采用PT-SPE结合衍生化过程(衍生化试剂为DEED)的前处理,再结合基于阳离子交换/反相(cation exchange/reversed-phase,CX/RP)整体毛细管柱的Nano-LC-MS进行检测。该CX/RP整体柱的制备原理是基于“硫醇-烯”点击化学和微乳液体系中的溶胶-凝胶方法。但该CX/RP整体柱使用不同于Chen Mingluan等[12]以单一MAA-co-EDMA整体柱在线捕获后再以另一MAA-co-EDMA整体柱进行分离,而是C18色谱柱在线捕获目标物后,再采用CX/RP整体柱进行分离。这种基于Nano-ESI的新型分析技术由于其样品消耗少与超高灵敏度已经得到越来越多的关注,且已成功应用于植物激素的痕量分析。Nano-ESI发射器具有微尺度孔,可降低分析物消耗,具有很高的离子转移效率,十分有利于对有限可用性分析物的质谱分析[51]。针对多种GAs痕量分析,该技术具有十分广阔的应用前景。

表2 LC法在检测多种GAs中的应用Table 2 Applications of liquid chromatography in the detection of gibberellins
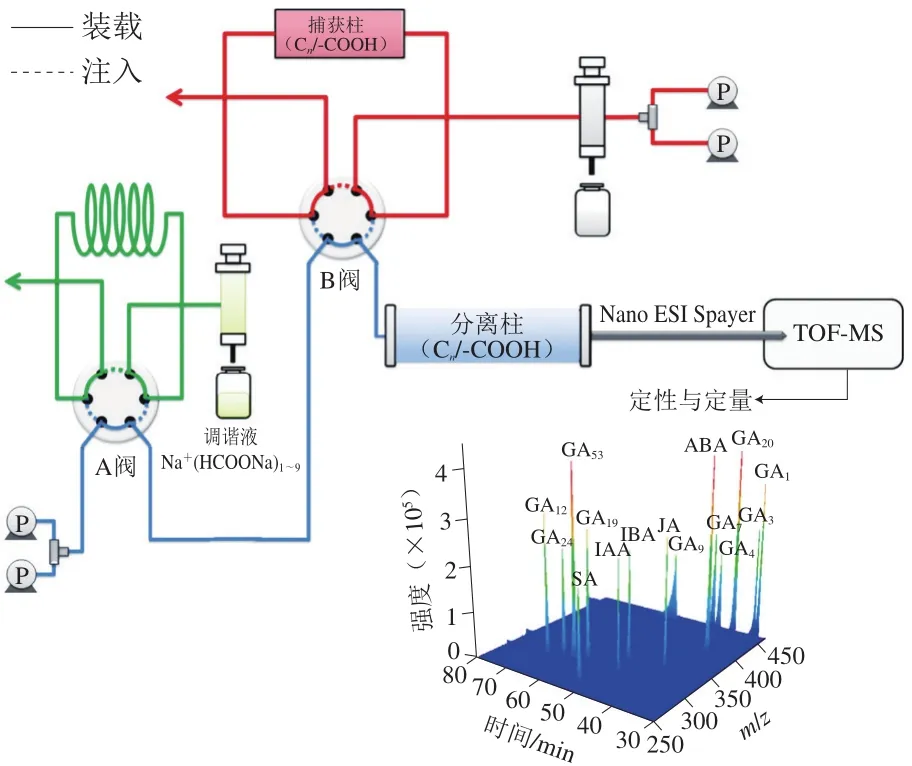
图7 Nano-LC-ESI-Q-TOF-MS系统原理图[12]Fig. 7 Schematic diagram of nano-liquid chromatography-electron spray ionization-Q-quadrupole-time of flight-mass spectrometry system[12]
除了Nano-ESI这种新型技术应用于MS的分析中,近年来,越来越多的HRMS代替了传统的MS。如磁偏转质谱、TOF-MS、静电场轨道阱质谱以及傅里叶变换离子回旋共振质谱等,这些高分辨质谱的分辨率都大于10 000,质量精度均小于5×10-6[52]。而在GAs检测中被常应用到的高分辨质谱为Q-TOF-MS[12],Q-TOF-MS是一种强大的工具,通过建立每种化合物的碎裂过程来表征痕量化合物。Zhao Hongzhi等[53]利用ESI-Q-TOF-MS首次建立了植物激素(包括GA3、GA4、GA9)的综合MS/MS谱库。谢寒冰等[54]利用HPLC-Q-TOF-MS测定了豆芽中的3 种外源植物激素残留,该方法采用QuEChERS的前处理技术,以酸化的乙醇-乙腈溶液提取目标物,经硅藻土分散固相净化。LC以甲醇-水作为流动相梯度洗脱,C18色谱柱分离。MS采用高分辨质谱、负离子模式,以精确质量数和二级特征离子定性,以准分子离子峰面积定量。最终检测大豆芽和绿豆芽两个品种,得到GA3的回收率为79%~87%,LOD为5.0 μg/kg,3 种加标水平(10、50、100 μg/kg)下RSD小于10%。这种高分辨质谱可通过多级扫描结合谱库检索使得目标物的分析更加准确,可以有效区分混合物,大幅降低了对前处理的要求,相较于传统的MS/MS,HRMS也降低了对色谱分离的要求,可同时对数百种化合物进行分析,是对多种GAs痕量分析极为有效的手段。
3 结 语
GAs检测技术的发展经历了从最开始的传统生物测定法[55]到免疫测定法,又随着20世纪60年代GC-MS的兴起以及GC-MS被普遍应用于GAs检测[56-57],到现在以LC-MS为主的过程。在LC-MS的基础上,近年来发展起来的一种新型Nano-ESI因其低消耗和超高灵敏度在植物激素痕量分析方面得到越来越多的关注,并且已成功应用于多种GAs的痕量分析[12,50]。同时,随着HRMS的发展及其对传统MS/MS的影响,近年来也逐渐被应用于GAs的痕量分析[12]。在利用色谱法分析GAs的前提下,GAs检测的前处理技术也得到了极大的发展。创新性的SPE技术(如高效、高选择性的新型吸附剂或SPME技术)以及化学标记法的应用,使得目标物的净化与富集效果得到很大的提升,提高了分析方法的灵敏度。
虽然目前已经存在许多检测GAs的优秀方法,尤其是随着Nano-ESI与HRMS的引入之后,GAs分析方法的灵敏度得到很大提升。但对基质复杂的植物成分进行GAs的痕量、精准及高通量分析仍有缺陷,表现在灵敏度还需要进一步提高,从而实现超低的痕量分析,解决极低样品取样量下GAs的痕量分析。同时,由于GAs同系物存在同分异构体,因此对GAs光学异构体鉴别与定量分析技术有待于进一步开发。另外,GAs代谢产物研究极少,主要是由于分析手段不足,代谢产物结构解析是今后GAs分析技术需要克服的难点。
针对上述存在的问题,可以从不同的方向进行解决。在前处理上,高通量、选择性的材料在GAs分析的应用能够提高GAs的富集能力,从而提高GAs分析的灵敏度。如功能性石墨烯材料在GAs分析的应用,一方面提高了SPE与QuEChERS的净化能力;另一方面也增加了前处理方法的富集系数,提高了方法灵敏度。在同系物、同分异构体分析上,新型色谱柱在GAs的应用提高了色谱分离度,高分辨MS或MS/MS的高选择性有望解决GAs同分异构体或光学异构体的分析。利用HRMS结合体外模拟实验,可以初步推断GAs降解产物和代谢产物,再将核磁共振以及红外光谱等技术结合应用,是今后研究GAs代谢行为的方向。
