姜黄素类化合物的体外抗氧化活性及其对鸡红细胞氧化损伤的保护作用
2020-07-23张婧菲韩红丽沈明明张莉莉
张婧菲,韩红丽,沈明明,张莉莉,王 恬*
(南京农业大学动物科技学院,江苏 南京 210095)
抗氧化物是指有能力还原、降低或者阻止氧化反应过程的一类化合物。在体外,测定抗氧化物的抗氧化能力有多种不同方法,包括活性自由基法和细胞实验。活性自由基法是指利用化学反应生成活性自由基,然后测定抗氧化物清除该自由基的能力。它的优点是操作简单、反应环境单一、实验结果的重现性高;缺点是采用不同反应原理的化学体系评价样品的抗氧化能力,有时会得到相互矛盾的结果[1-2]。有研究者指出,制备样品的方法不同、清除自由基原理的不同等因素都会在很大程度上影响实验结果。根据淬灭自由基的反应原理不同,检测方法可以分为氢过氧自由基清除能力、金属还原能力、羟自由基(·OH)清除能力、有机自由基清除能力和抑制脂质过氧化产物的能力等[3]。其中,铁离子还原/抗氧化能力(ferric-reducing antioxidant power,FRAP)、清除2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力是目前使用最多的评价样品体外抗氧化能力的指标。鉴于每个指标检测方法的优缺点及其适用范围,近年来许多研究者推荐采用两种及以上指标相结合的方法,更客观、全面地评价抗氧化物的体外抗氧化能力[4]。
红细胞的生命周期短,与其他细胞相比是一类特异性较低的体细胞。在氧化反应过程中,红细胞是自由基攻击的主要目标[5]。一方面,红细胞在体内负责氧气运输,因此与氧原子频繁接触;另一方面,红细胞的细胞膜富含多不饱和脂肪酸,且存在于红细胞结构中的血红蛋白极易发生自氧化反应[6]。因此,红细胞膜是体外评价抗氧化物活性的合适介质。在常见的红细胞氧化损伤模型中,2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-amidinopropane) dihydrochloride,AAPH)作为一种亲脂性氧化反应诱导剂被广泛使用。在水溶液中,AAPH水解生成烷基,并进一步在氧原子的作用下转变生成氢过氧自由基[7]。此外,AAPH也可生成·OH。这些游离的自由基可以攻击红细胞膜,诱导脂质过氧化反应,最终导致红细胞溶血作用和细胞凋亡。
姜黄是姜科属的一种地下茎多年生植物草本植物,主要种植于热带和亚热带地区。姜黄含有69.4%(质量分数,下同)碳水化合物、6.3%蛋白质、5.1%脂肪、5.8%精油和3%~6%姜黄素(curcumin,CUR)类化合物[8]。在印度和中国等国家,姜黄被用作着色剂和香料剂,广泛见于咖喱、芥末、奶酪等中[9]。此外,姜黄还是一种药用历史悠久的多酚类物质,可用于治疗各种呼吸道疾病(如哮喘、支气管炎和过敏)、肝功能紊乱、厌食症、风湿病、糖尿病、腹痛和扭伤等[10-11]。大量研究证实,姜黄提取物是一类重要的抗氧化物。从姜黄根茎中提取的活性物质,主要为CUR(约77%)、去甲氧基姜黄素(demethoxycurcumin,DUR)(约17%)和双去甲氧基姜黄素(bisdemethoxycurcumin,BUR)(约3%)[12-13]。研究表明,CUR、DUR和BUR的化学结构十分相近,是姜黄属药用植物的最主要活性成分。它们的药理作用广泛,耐受性好、毒性低,因此在医药、食品、农业等领域具有良好的应用前景。许多学者将这3 种化合物统称为总CUR。
CUR是近几年食品科学和医学领域的研究热点。相对而言,关于DUR和BUR的研究相对滞后。与CUR一样,DUR、BUR可保护DNA免受氧化损伤[14]。近来研究表明,虽然3 种CUR的药理学活性相似,但其抗氧化活性仍存在较大差异。在脂质过氧化反应体系中,DUR、BUR的抗氧化活性较CUR相比更强;但在自由基体系中,CUR的抗氧化活性最强,其次才是DUR和BUR[15-16]。在体外细胞模型中,Zhang Lijia等利用脂多糖(lipopolysaccharide,LPS)建立体外细胞损伤模型,研究发现CUR与BUR发挥了相似的细胞保护作用;但较CUR相比,BUR对LPS诱导的细胞损伤更加敏感[17]。上述结果提示,3 种CUR在动物体内的抗氧化活性很可能存在差异。
本团队前期通过体外化学法和红细胞氧化损伤模型,测定了CUR的体外抗氧化能力,并且比较了CUR和其他几种天然色素的抗氧化活性差异。但目前关于3 种CUR在体外的抗氧化能力差异,尚缺乏系统的研究。基于此,本实验以CUR、DUR和BUR为对象,同时选取二丁基羟基甲苯(butylated hydroxytoluene,BHT)和丁羟茴醚(butylated hydroxyanisole,BHA)为对照物,测定自由基清除率和金属离子还原力,研究其对AAPH处理的鸡红细胞溶血率、丙二醛(malondialdehyde,MDA)含量和超氧化物歧化酶(superoxide dismutase,SOD)活性的影响。以期为进一步研究CUR及其类似物的抗氧化活性差异提供理论依据。
1 材料与方法
1.1 材料与试剂
ABTS、DPPH、AAPH 西格玛奥德里奇(上海)贸易有限公司;CUR、DUR、BUR(纯度大于98%[11])广州科虎生物技术研发中心;BHT、BHA等其他试剂均为国产分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
BSA224S-CW电子分析天平 德国赛多利斯公司;Multiskan GO多功能酶标仪 美国Thermo Fisher Scientific公司;5804/5804R台式高速冷冻离心机德国Eppendorf公司;DK-S24电热恒温水浴锅 上海精宏实验设备有限公司;Vortex-Genie 2漩涡混合器美国Scientific Industries公司;S-250D超声波破碎仪美国Branson公司。
1.3 方法
1.3.1 ABTS阳离子自由基清除能力的测定
参考do Carmo Brito等[14]的方法,以ABTS水溶液(7 mmol/L)为溶剂,配制过硫酸钾溶液(2.45 mmol/L),于室温下避光稳定12~16 h。以乙醇作为稀释介质,选取合适的稀释比例,调整过硫酸钾溶液于734 nm波长处的吸光度为0.700±0.025。取0.195 mL上述溶液与0.65 mL样品溶液(浓度分别为0、2、4、,6、8、10、20 μmol/L)充分混合,于30 ℃条件下反应30 min。用蒸馏水调零,于734 nm波长处测定吸光度,结果记为A样品。用0.65 mL的乙醇溶液代替样品溶液作为对照管,进行相同的处理后,于734 nm波长处其吸光度,结果记为A对照。每个样品平行测定3 次,取平均值。按式(1)计算样品的ABTS阳离子自由基清除率。选取Trolox为参照物,配制不同浓度的Trolox溶液,代替样品溶液进行上述反应,利用相对应的吸光度绘制Trolox清除率的标准曲线。通过标准曲线,计算样品相对应于Trolox的清除率。样品的ABTS阳离子自由基清除能力以Trolox计,单位为μmol/L。

1.3.2 DPPH自由基清除能力的测定
参考Oliveira等[18]的方法,配制DPPH自由基乙醇溶液(0.1 mmol/L),而后装入棕色瓶子中置于阴凉处,现配现用。取0.65 mL样品溶液与0.195 mL DPPH自由基乙醇溶液(0.1 mmol/L)充分混合,于室温下避光反应30 min。用乙醇溶液调零,于517 nm波长处测定吸光度,结果记为A样品。用0.65 mL的乙醇溶液代替样品溶液作为对照管,进行相同的处理后,于517 nm波长处其吸光度,结果记为A对照。每个样品平行测定3 次,取平均值。按式(1)计算样品的DPPH自由基清除率。后续操作同1.3.1节,样品的DPPH自由基清除能力以Trolox计,单位为μmol/L。
1.3.3 ·OH清除率的测定
参考Ohata等[19]的方法,取0.1 mL样品溶液与0.15 mL 2-脱氧核糖(5 mmol/L)、0.4 mL磷酸钠缓冲液(0.75 mol/L,pH 7.4)、0.25 mL双蒸水和0.1 mL硫酸亚铁溶液(7.5 mmol/L)混合。向上述混合液中加入0.1 mL过氧化氢溶液(体积分数1%),并充分混匀。37 ℃水浴条件下反应1 h后,于536 nm波长处测定吸光度,结果记为A样品。用相同体积的双蒸水代替样品溶液作为对照管,进行相同的处理后,于536 nm波长处测定其吸光度,结果记为A对照。每个样品平行测定3 次,取平均值。按式(1)计算样品的·OH清除率。后续操作同1.3.1节,样品的·OH清除能力以Trolox计,单位为μmol/L。
1.3.4 O2-·清除能力的测定
参考Lim等[20]的方法,以磷酸钠缓冲液(0.1 mol/L,pH 7.4)为溶剂,分别配制氯化硝基四氮唑蓝溶液(150 μmol/L)、烟酰胺腺嘌呤二核苷酸溶液(468 μmol/L)和吩嗪硫酸甲酯溶液(60 μmol/L)。取1 mL样品溶液与1 mL氯化硝基四氮唑蓝溶液、1 mL烟酰胺腺嘌呤二核苷酸溶液混合,加入1 mL吩嗪硫酸甲酯溶液后立即充分混匀。室温条件下反应5 min后,于560 nm波长处测定吸光度,结果记为A样品。用1 mL的磷酸钠缓冲液代替样品作为对照管,进行相同的处理后,于560 nm波长处测定吸光度,结果记为A对照。每个样品平行测定3 次,取平均值。按式(1)计算样品超氧阴离子自由基(O2-·)清除率。后续操作同1.3.1节,样品的O2-·清除能力以Trolox计,单位为μmol/L。
1.3.5 FRAP的测定
FRAP的测定参考Tang Yao等[21]的方法。具体步骤如下:以盐酸溶液(40 mmol/L)为溶剂,配制2,4,6-三吡啶基三嗪溶液(10 mmol/L)。醋酸盐缓冲液(0.3 mol/L、pH 3.6)、2,4,6-三吡啶基三嗪溶液溶液(10 mmol/L)和氯化铁溶液(20 mmol/L)按体积比10∶1∶1充分混合,于37 ℃条件下进行预热。取300 μL预热的FRAP试剂,加入30 μL的超纯水和10 μL的样品溶液,充分混合后于37 ℃水浴条件下避光反应30 min。于593 nm波长处测定吸光度。以七水硫酸亚铁代替样品溶液进行上述反应,利用相对应的吸光度绘制七水硫酸亚铁还原力的标准曲线。通过标准曲线,计算样品相对应于七水硫酸亚铁的FRAP。每个样品平行测定3 次,取平均值。
1.3.6 抑制脂质过氧化能力的测定
抑制脂质过氧化能力的测定参考Awah等[22]的硫代巴比妥酸法。具体步骤如下:以磷酸盐缓冲液(pH 7.4)为匀浆介质,配制新鲜的蛋黄匀浆液500 μL(体积分数10%)。以3 g硫代巴比妥酸、120 g三氯乙酸、10.4 mL高氯酸(体积分数70%)和800 mL蒸馏水配制硫代巴比妥酸反应液。取100 μL样品溶液以蒸馏水稀释至1.0 mL,然后加入50 μL硫酸亚铁溶液(0.075 mol/L)、20 μL VC(0.1 mol/L)。充分混合后,在37 ℃下反应1 h。冷却后加入200 μL的乙二胺四乙酸溶液(0.1 mol/L)和1.5 mL上述的硫代巴比妥酸反应液,在100 ℃沸水浴下反应15 min。冷却后3 000 r/min离心10 min。上清液于532 nm波长处测定吸光度。按式(2)计算样品的脂质过氧化抑制率。
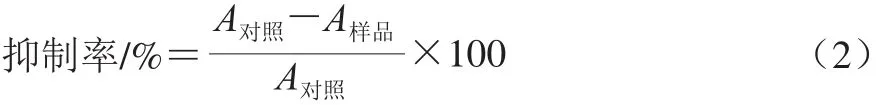
1.3.7 AAPH诱导鸡红细胞的氧化应激反应
采取新鲜鸡血,用肝素抗凝,1 500×g离心10 min,弃上清液,所得沉淀为鸡红细胞。加入合适体积的缓冲液(4 ℃预冷,pH 7.4,含150 mmol/L氯化钠、1.9 mmol/L磷酸二氢钠、8.1 mmol/L磷酸氢二钠),轻柔吹散鸡红细胞,形成均匀的鸡红细胞悬浮液,然后于1 500×g离心10 min,弃上清液。如此反复,用缓冲液清洗鸡红细胞3 次。最后,加入适量的缓冲液,制备成质量分数2%的鸡红细胞悬浮液备用。
AAPH通过生成水溶性的脂质过氧化自由基,可诱导鸡红细胞的氧化应激损伤[23]。将分离得到的新鲜红细胞悬浮液分为不同的处理组,即未处理的红细胞悬浮液(对照,CON)、AAPH处理过的红细胞悬浮液、AAPH处理过的红细胞悬浮液+不同浓度的3 种不同浓度CUR:取质量分数2%鸡红细胞悬浮液,分别加入不同浓度的CUR溶液(终浓度为0.5、1、5、10、20 μmol/L),于37 ℃条件下孵育30 min。然后加入AAPH溶液(75 mmol/L),充分混匀后恒温孵育5 h。
1.3.7.1 红细胞溶血率的测定
红细胞溶血率的测定参考Magalhaes等[24]的方法。具体步骤如下:每隔1 h取出等体积的鸡红细胞悬浮液,1 500×g离心10 min,弃上清液。按体积比1∶7向红细胞沉淀中加入150 mmol/L的生理盐水,充分混匀后1 500×g离心10 min。取上清液于540 nm波长处测定吸光度,所得结果记为A。以双蒸水代替生理盐水,诱导鸡红细胞完全溶血,离心后取上清液于540 nm波长处测定吸光度,所得结果记为A’。每个浓度样品溶液平行测定3 次,计算平均值。鸡红细胞溶血率按式(3)计算。

1.3.7.2 红细胞SOD活力和MDA含量的测定
超声波破碎法破碎鸡红细胞样品,采用试剂盒测定SOD活力和MDA含量。
1.4 数据统计与分析
所有数据经Excel 2013软件初步整理后,先用SPSS 17.0软件进行方差齐性检验。然后,采用SPSS 17.0软件的单因素方差分析,利用Tukey法进行组间显著性比较。所有结果均表示为平均值±标准误。P<0.05表示差异显著。
2 结果与分析
2.1 3 种CUR对ABTS阳离子自由基、DPPH自由基、·OH和O2-·清除率的影响

图1 3 种CUR对ABTS阳离子自由基(A)、DPPH自由基(B)、·OH(C)和O-2·(D)清除率Fig. 1 Scavenging effects of curcuminoids on ABTS radical cation (A),DPPH radical (B), ·OH (C) and O2-· (D)
由图1A可知,3 种CUR对ABTS阳离子自由基的清除率呈现浓度依赖性。在1~20 μmol/L浓度范围内,随着样品浓度的升高,其对ABTS阳离子自由基的清除率也逐渐升高。在浓度为20 μmol/L时,不同样品对ABTS阳离子自由基清除率由高到低为BHA>BUR>CUR>BHT>DUR。与BHT相比,CUR和BUR对ABTS阳离子自由基的清除率均有显著提高(P<0.05)。与DUR相比,CUR和BUR对ABTS阳离子自由基的清除率分别显著提高了49.62%和77.36%(P<0.05)。
由图1B可知,DUR和BUR对DPPH自由基的清除率呈现浓度依赖性,在1~20 μmol/L浓度范围内,随着样品浓度的升高,其对ABTS阳离子自由基的清除率逐渐升高。CUR对DPPH自由基的清除率在1~10 μmol/L范围内随浓度升高而升高,且在10 μmol/L时达到最大值。在浓度为20 μmol/L时,不同样品对DPPH自由基清除率由高到低为DUR>BHT>BUR>CUR>BHA。与BHT相比,DUR对DPPH自由基的清除率显著提高(P<0.05),BUR差异不显著(P>0.05),CUR则显著降低(P<0.05)。BUR和CUR两者对DPPH自由基的清除率无显著差异(P>0.05)。
由图1C可知,3 种CUR对·OH的清除率呈现浓度依赖性。在10~400 μmol/L范围内,随着浓度的升高,其对·OH的清除率也逐渐升高。在浓度为400 μmol/L时,不同样品对·OH清除率由高到低为BHT>BHA>BUR>DUR>CUR。与BHA和BHT相比,3 种CUR对·OH的清除率均有显著降低(P<0.05)。与CUR相比,DUR和BUR对·OH的清除率分别显著提高了20.00%和28.78%(P<0.05)。DUR和BUR两者对·OH的清除率无显著差异(P>0.05)。
由图1D可知,3 种CUR对O2-·的清除率呈现浓度依赖性。在10~400 μmol/L范围内,随着浓度的升高,其对O2-·的清除率也逐渐升高。在浓度为400 μmol/L时,不同样品对·OH清除率由高到低为BUR>CUR>BHA>BHT>DUR。与DUR相比,BUR和CUR对O2-·的清除率分别显著提高了59.76%和36.41%(P<0.05)。
2.2 3 种CUR对ABTS阳离子自由基、DPPH自由基、·OH、O2-·的半抑制浓度
表1 3 种CUR对ABTS阳离子自由基、DPPH自由基、·OH、·的IC50(n=8)Table 1 IC50 for scavenging effects of curcuminoids on ABTS radical cation, DPPH radical, ·OH and O-2· (n= 8)

表1 3 种CUR对ABTS阳离子自由基、DPPH自由基、·OH、·的IC50(n=8)Table 1 IC50 for scavenging effects of curcuminoids on ABTS radical cation, DPPH radical, ·OH and O-2· (n= 8)
组别 IC50/(μmol/L)ABTS阳离子自由基 DPPH自由基 ·OH O2-·CUR 16.28 4.89 81.01 135.40 DUR 27.66 5.18 77.41 209.03 BUR 14.91 18.49 77.95 124.67 BHT 26.03 35.05 38.87 182.19 BHA 14.09 59.55 47.26 182.72
表1为3 种CUR对ABTS阳离子自由基、DPPH自由基、·OH、O2-·的半抑制浓度(half maximal inhibitory concentration,IC50)。就ABTS阳离子自由基和O2-·而言,3 种CUR中,BUR的IC50最低,然后依次是CUR和DUR。就DPPH自由基而言,CUR的IC50值最低,BUR的IC50最高。就·OH而言,3 种CUR中,DUR和BUR的IC50相近,CUR的IC50最高。
2.3 3 种CUR对FRAP的影响

图2 3 种CUR对FRAP的影响Fig. 2 Ferric reducing antioxidant power of curcuminoids
由图2可知,3 种CUR的FRAP结果呈现明显的浓度依赖性。在1~400 μmol/L浓度范围内,随着样品浓度的升高,其FRAP也逐渐升高。在浓度为400 μmol/L时,BHA的FRAP最大,CUR次之;其中,3 种CUR处理组间的FRAP均差异显著(P<0.05)。400 μmol/L时不同样品的FRAP由高到低为:BHA>CUR>DUR>BUR>BHT。
2.4 3 种CUR对脂质过氧化反应抑制率的影响

图3 3 种CUR对脂质过氧化反应抑制率的影响Fig. 3 Inhibitory activity of curcuminoids on lipid peroxidation
由图3可知,3 种CUR均可有效抑制蛋黄卵磷脂的脂质过氧化反应,且这种抑制作用呈现浓度依赖性。在1~400 μmol/L浓度范围内,随着样品浓度的升高,它们对脂质过氧化反应的抑制率也逐渐升高。在浓度为400 μmol/L时,BUR的抑制率最高。不同样品对脂质过氧化反应的抑制率由高到低为BUR>DUR>CUR>BHT>BHA。与CUR相比,BUR和DUR对脂质过氧化反应的抑制率分别显著提高了34.15%和54.16%(P<0.05)。
2.5 3 种CUR对AAPH诱导的红细胞溶血率的影响


图4 3 种CUR对AAPH诱导的红细胞溶血率的影响Fig. 4 Effects of curcuminoids on AAPH-induced erythrocyte hemolysis
由图4可知,经AAPH处理后,红细胞的溶血率较对照组相比显著提高(P<0.05)。在0.5~20 μmol/L时,孵育1 h后,与AAPH组相比,3 种CUR均显著降低了红细胞的溶血率(P<0.05);并且这种抑制作用呈现浓度依赖性和时间依赖性。但3 种CUR处理组间的溶血率差异不显著(P>0.05)。孵育3 h后,在0.5 μmol/L时,与AAPH组相比,DUR和BUR显著降低了红细胞的溶血率(P<0.05)。在1~20 μmol/L时,红细胞分别经3 种CUR处理后溶血率较AAPH组相比显著降低(P<0.05)。在20 μmol/L时,与CUR组相比,DUR和BUR组的红细胞溶血率显著降低(P<0.05)。在0.5~20 μmol/L时,孵育5 h后,与AAPH组相比,3 种CUR均显著降低了红细胞的溶血率(P<0.05)。在20 μmol/L时,与CUR组相比,DUR和BUR组的红细胞溶血率更低(P<0.05)。
2.6 3 种CUR对AAPH诱导的红细胞MDA含量的影响
由图5可知,在0.5~20 μmol/L时,孵育1 h后,3 种CUR处理可明显抑制AAPH诱导的红细胞脂质过氧化反应,降低MDA含量(P<0.05)。在0.5~20 μmol/L时,孵育3 h后,与AAPH组相比,3 种CUR均显著降低了红细胞的MDA含量(P<0.05);并且这种抑制作用呈现浓度依赖性。在10 μmol/L时,3 种CUR处理组间的红细胞MDA含量差异显著(P<0.05)。孵育5 h后, 3 种CUR在不同浓度时均可有效抑制AAPH诱导的红细胞MDA含量升高(P<0.05)。其中,在1~10 μmol/L时,与CUR组相比,DUR和BUR显著降低了红细胞的MDA含量(P<0.05)。在20 μmol/L时,经BUR处理后的红细胞MDA含量更低;且与CUR和DUR处理组相比差异显著(P<0.05)。

图5 3 种CUR对AAPH诱导的红细胞MDA含量的影响Fig. 5 Effects of curcuminoids on MDA content in erythrocytes induced by AAPH
2.7 3 种CUR对AAPH诱导的红细胞SOD活力的影响
由图6可知,在37 ℃条件下孵育5 h后,CON组的红细胞SOD活力没有随着时间的变化产生显著差异(P>0.05)。经AAPH处理后,红细胞的SOD活性较对照组相比显著降低(P<0.05)。在0.5~20 μmol/L时,孵育1 h后,与AAPH组相比,3 种CUR均显著提高了红细胞的SOD活力(P<0.05)。在0.5 μmol/L时,孵育3 h后,与AAPH组相比,CUR和DUR显著提高了红细胞的SOD活力(P<0.05)。在1~20 μmol/L时,经3 种CUR处理后的红细胞SOD活性较AAPH组相比显著提高(P<0.05)。在20 μmol/L时,与CUR组相比,DUR和BUR组的红细胞SOD活力更高(P<0.05)。孵育5 h后,3 种CUR在不同浓度下均可有效抑制AAPH诱导的红细胞SOD活力降低(P<0.05)。其中,在1 μmol/L时,与DUR组相比,CUR和BUR显著提高了红细胞的SOD活力(P<0.05)。在5~10 μmol/L时,经DUR和BUR处理后的红细胞SOD活力较CUR处理组相比显著提高(P<0.05)。在20 μmol/L时,CUR和DUR组的红细胞SOD活力更高,且较BUR组差异显著(P<0.05)。

图6 3 种CUR对AAPH诱导的红细胞SOD活力的影响Fig. 6 Effects of curcuminoids on SOD activity in erythrocytes induced by AAPH
3 讨 论
ABTS阳离子自由基和DPPH自由基清除率是两种广泛使用的体外抗氧化力检测指标。它们的反应原理相同,都是基于样品提供H原子或质子来淬灭自由基,并通过反应液的颜色变化来评估自由基清除率的高低[25]。Zhang Jingfei等[26]测定了CUR对DPPH自由基的清除率,提示CUR对DPPH自由基有良好的清除率,且在一定浓度范围内,CUR对DPPH自由基的清除率存在明显的浓度依赖性。本实验在前期研究基础上,进一步比较了3 种CUR对ABTS阳离子自由基和DPPH自由基清除率。结果显示,DUR和BUR与CUR类似,可以有效地中和DPPH自由基,并且在1~20 μmol/L浓度范围内呈现一定的浓度依赖性。这与Kim等[27]的研究结果一致。就ABTS阳离子自由基清除率而言,BUR的清除率与人工合成抗氧化剂BHA相近,并在20 μmol/L浓度时显著高于CUR和BUR。
·OH能与绝大部分生物大分子物质发生反应,包括细胞中的碳水化合物、蛋白质、脂质和DNA。·OH散逸可导致细胞损伤和大面积的细胞凋亡[28]。因此,及时清除多余的·OH对保护机体的正常生命活动和生理代谢反应具有重要作用。O2-·是线粒体呼吸链反应的一种自由基副产物。生成的O2-·可以进一步反应产生另一种活性氧自由基H2O2。H2O2在过氧化氢或谷胱甘肽过氧化物酶的催化下最终将自由基转化为水[29]。因此,有效清除O2-·是发挥线粒体抗氧化防御功能的重要环节之一。本实验结果显示,3 种CUR都能有效地清除·OH和O2-·。3 种CUR相互比较而言,BUR的清除活性最高。目前关于这3 种CUR对不同自由基清除率的比较研究很少,尤其对造成它们抗氧化活性差异的原因仍无法给出统一的解释。推测这种差异一方面是因为不同的自由基反应基于不同的中和原理;另一方面可能与3 种CUR的功能基团不同有关[30]。
生物脂质对氧化反应非常敏感,不仅因为它富含不饱和脂肪酸,而且它与机体内的酶促和非酶系统之间存在密切联系。脂质过氧化是一个典型的自由基链式反应,通过从不饱和脂肪酸侧链上吸收一个H原子继而引发一系列的自由基聚合反应,这也是导致细胞膜破损和细胞坏死的一个重要机制之一[28]。因此,不同样品对脂质过氧化反应的抑制率是体外检测样品抗氧化活性的一个重要指标。本实验选取蛋黄卵磷脂作为脂质底物,比较研究3 种CUR对蛋黄脂质过氧化反应抑制率的影响。结果显示,3 种CUR都能有效地抑制脂质过氧化反应。其中,BUR和DUR的抑制率显著高于CUR。这一结果与Jayaprakasha等[31]的研究结果一致。
红细胞膜富含不饱和脂肪酸,在氧化反应过程中是自由基攻击的主要目标。游离的自由基会诱导磷脂重排反应,并将磷脂酰丝氨酸暴露在细胞膜外侧的小叶上,最终导致过氧化链式反应的发生[32]。与成熟的哺乳动物红细胞不同,家禽的红细胞有完整的细胞核、线粒体、溶酶体和高尔基体等细胞器。一旦发生氧化应激反应,可激活若干生物机制参与对细胞的保护作用,缓解自由基诱导的红细胞溶血作用和血红蛋白的氧化。因此,家禽红细胞的结构和功能上的特异性使其成为一种易于操作的细胞模型,尤其适合用于与氧化应激相关的研究。本实验利用水溶性自由基AAPH诱导鸡红细胞发生氧化应激反应,然后通过测定红细胞的溶血率、MDA含量和SOD活力,比较3 种CUR的抗氧化潜力。结果显示,3 种CUR均能发挥良好的抗氧化活性,并在一定程度上缓解红细胞的氧化损伤。多酚类物质的抗氧化机制之一是通过降低脂质过氧化反应和自由基活性来稳定细胞膜[33]。有研究指出,酚类化合物的疏水性使其主要富集在细胞膜和脂蛋白等脂质含量丰富的区域[34]。3 种CUR属于天然提取的一类多酚化合物,可以通过整合到细胞双层膜的疏水核心区,降低细胞膜的流动性和稳定性,限制自由基的扩散,提高抗氧化效率。本实验中MDA的研究结果也在一定程度上证实了上述CUR类化合物的可能抗氧化作用机制。
值得注意的是,综合本实验中红细胞的3 个测定指标结果,认为DUR和BUR对红细胞的保护作用优于CUR。Toda等[35]也以红细胞为实验模型,研究了3 种CUR对·OH诱导的大鼠红细胞溶血率和脂质过氧化反应的影响,但其研究发现,与DUR和BUR相比,CUR对红细胞的保护作用更显著。这一发现与本实验的结果不一致。而Sheejayan等[36]以大鼠脑和肝组织匀浆液为介质,研究3 种CUR对铁离子催化下脂质过氧化反应的影响,也得到了与上述研究不同的结果,其认为3 种CUR的抗氧化活性基本一致。由于目前关于CUR、DUR和BUR的抗氧化活性差异的报道比较少,可供参考和比较的实验结果不多。因此,推测反应体系、诱导脂质过氧化反应的自由基种类和发生过氧化反应的脂质种类都可能会影响CUR类化合物的抗氧化活性发挥,并导致实验结果的参差不齐。
抗氧化剂的抗氧化能力与其化学结构密切相关,尤其是它的功能基团。根据功能基团不同,常见的抗氧化化合物可以分为两类:酚醛类和β-二酮基类。自然界中绝大部分的天然抗氧化剂含有酚基或β-二酮基。CUR的化学结构很特别,是一个高度对称的分子,既有β-二酮基又有酚羟基。它的主要功能基团包括:β-二酮基、两个酚羟基、甲氧基、羰基[37-38]。羰基是CUR的主要显色基团,目前鲜有研究发现羰基与CUR抗氧化活性的相关。近年来的主流研究认为,β-二酮基和酚羟基是影响CUR抗氧化活性的主要功能基团。目前关于甲氧基在抗氧化活性中发挥的作用研究很少[39-40]。但有研究显示,若酚羟基的邻位存在甲氧基,可以提高酚羟基的抗氧化活性[30]。从化学结构上看,3 种CUR的唯一不同是甲氧基数量。CUR在动物体内不稳定,大部分会被迅速降解为阿魏酸和阿魏酰甲烷。阿魏酸也是一种潜在的生物活性物质,具有多种药理学功能,例如抗氧化活性。有研究报道,阿魏酸的抗氧化活性甚至优于CUR[41-42]。冯生光[43]研究了CUR和DUR的降解途径,推测它们在丙酮溶液和小鼠体内的可能降解产物存在明显不同,其中就包括阿魏酸和反式阿魏酸。然而,目前尚缺乏去DUR和BUR在机体内的分解代谢途径的相关研究。因此推测,CUR及其代谢产物的存在可部分解释其与DUR、BUR在某些自由基体系中的抗氧化活性差异。
综上所述,本实验结果表明,与CUR类似,DUR和BUR均表现出良好的抗氧化活性。3 种CUR能有效地中和ABTS阳离子自由基、DPPH自由基、·OH和O2-·,具有较高的FRAP和脂质过氧化抑制率。在红细胞模型中,3 种CUR显著降低了AAPH诱导的红细胞溶血率和抑制了MDA含量升高,并提高了SOD活力。同时,3 种CUR的抗氧化活性还存在差异。就ABTS阳离子自由基、·OH和O2-·清除率和脂质过氧化抑制率而言,BUR的活性最佳。在缓解红细胞氧化损伤方面,DUR和BUR的抗氧化力较CUR相比更显著。
