极旱荒漠灌丛AM真菌与土壤因子相关性
2020-07-23李烨东左易灵张开逊赵丽莉贺学礼王亮
李烨东,左易灵,张开逊,赵丽莉,贺学礼,王亮
(1.河北大学 生命科学学院, 河北 保定 071002;2.甘肃安西极旱荒漠国家级自然保护区管理局,甘肃 瓜州 736100)
安西极旱荒漠自然保护区,地处温带和暖温带过渡区域,荒漠生态类型众多,极旱荒漠、典型荒漠和草原化荒漠植被均有分布. 合头草Sympegmaregelii、红砂Reaumuriasongarica、泡泡刺Nitrariasphaerocarpa、膜果麻黄Ephedraprzewalskii和珍珠猪毛菜Salsolapasserina作为亚洲中部特有种,属于不同科属,在安西荒漠区域最具代表性. 这些特有的灌丛植被具有不同的根系特征,在荒漠生态系统中集群生长,对资源利用、改善荒漠生态环境和调节荒漠生态系统具有重要意义. 在一定景观内,土壤性质存在明显空间异质性,在灌丛周围形成“肥岛”效应[1]. 灌丛地上部分截获土壤风蚀物、凋落物,富集养分[2],地下部分主根粗壮且广泛分布毛细根,发达的根系对土壤养分迁移产生影响,两者相互作用下灌丛不同范围内土壤性状呈梯度分布[3].
丛枝菌根(arbuscular mycorrhiza, AM)真菌作为专性活体营养共生真菌,是地球上分布最广泛的菌根类型,可降低恶劣环境对植物的养分胁迫[4-5],还可形成土壤团聚体[6]、保水持水、抵御风蚀、加速凋落物分解及实现有机物沉淀[7]. AM真菌群落组成受众多因素影响,王姣姣[8]、Bever[9]等研究认为,同一生境条件下,不同植物种类AM真菌群落组成受根系特征和根系分泌物影响差异显著. 不同生境下,随水热条件变化,植物AM真菌群落组成不同[10-11]. 土壤氮、磷元素的有效性影响植物和AM真菌群落[12]. 不同剂量的磷肥管理会改变牧草系统AM真菌群落组成[13]. AM真菌接种也会促进植物根系发展,减轻干旱胁迫[14]. 而在极旱荒漠环境下,植物种类和土壤因子对AM真菌群落相对作用研究较少.
本研究以安西极旱荒漠保护区作为研究样地,采集5种极旱荒漠植物根围0~10 cm和20~30 cm土壤样品,研究不同荒漠植物AM真菌物种组成、土壤因子变化特征及其生态效应,旨在探明植物种类、土壤酶活和土壤理化性质对AM真菌群落的影响,为促进荒漠植物生长和植被恢复提供依据.
1 材料与方法
1.1 样地概况
样地位于甘肃安西极旱荒漠国家级自然保护区(94°45′~97°00′E,39°52′~41°5′N),地处甘肃省瓜州县境内. 该地区属典型大陆性气候,年均气温7.8 ℃,年均降雨量小于52.0 mm且季节分配不均,夏季降雨量占全年降雨量的70%左右,年蒸发量2 754.9~3 420.0 mm. 土壤类型多为灰棕漠土,植被覆盖度低,主要有红砂、合头草、珍珠猪毛菜、泡泡刺和膜果麻黄等极旱荒漠植物.
1.2 样品采集
2018年7月分别在安西极旱荒漠保护区碱泉子、四道沟、长山子和瞭望台以合头草Sympegmaregelii、红砂Reaumuriasongarica、泡泡刺Nitrariasphaerocarpa、膜果麻黄Ephedraprzewalskii和珍珠猪毛菜Salsolapasserina为目标植物设置3个小样地,每个小样地选取5株生长良好的植株,去除表面枯枝落叶层,以植物主干向外辐射,距离主干0~10 cm、20~30 cm分别采集深度0~30 cm土层土壤样品. 土壤样品带回实验室,过2 mm筛,阴干后4 ℃冷藏,用于AM真菌分离鉴定和土壤因子测定(表1).

表1 5种荒漠植物和样地概况
1.3 AM真菌孢子分离与物种多样性测定
称取风干土样20 g,用湿筛倾析-蔗糖离心法筛取AM真菌孢子,体视显微镜下观察记录孢子数量即孢子密度(spore density, SD),挑取孢子于水中压片处理,光学显微镜下观察孢子大小、形态、颜色、表面纹饰、孢壁结构、连孢菌丝和内含物等孢子形态特征并拍照. 根据Schenck(1990)《VA菌根鉴定手册》和国际AM真菌保藏中心(INVAM,http://invam.caf.wvu.edu)中更新的孢子图片及分类描述并结合近年来发表的新种文献进行AM真菌属种鉴定. 参照Xue等[15]的方法计算AM真菌物种多样性指数.
Shannon-Wiener指数:H′ = -∑PilnPi,
Simpson指数:DS= 1 -∑Pi2,
物种均匀度:J=H′/lnS,
其中,Pi为每种AM真菌孢子总数占样地所有AM真菌孢子总数比例.S为AM真菌种类数.
1.4 土壤样品测定
土壤温度和湿度采用温湿度仪实地测定;土壤有机碳(soil organic carbon, SOC)用马弗炉烘干法[16]测定;土壤有效磷(available phosphorus, VP)用钼锑抗比色法[16]测定;土壤总磷(total phosphorus, TP)、总氮(total nitrogen, TN)、铵态氮(ammonium nitrogen, AN)和硝态氮(nitrate nitrogen, NN)用Smartchem 200全自动连续分析仪(Alliance, Frépillon, France)测定;土壤脲酶(urease, U)用苯酚钠-次氯酸钠比色法[17]测定;土壤酸性磷酸酶(acid phosphatase, ACP)和碱性磷酸酶(alkaline phosphatase, ALP)根据Tarafdar和Marschner[18]的方法测定;总提取球囊霉素(total extractable glomalin, TEG)和易提取球囊霉素(easily extractable glomalin, EEG)通过Wright等[19]的方法测定;pH值用雷磁PHS-3C pH计测定.
1.5 数据分析
所有实验数据取3个重复的平均值,用EXCEL2003软件整理,利用SPSS19.0统计软件进行单因素方差分析(one-way ANOVA)、独立样本T检验(independent samples T test),不同植物土壤因子采用单因素方差分析方法,0~10 cm、20~30 cm土壤因子采用独立样本T检验方法. 采用CANOCO4.5软件对土壤因子进行主成分分析(principal component analysis,PCA). 采用R语言进行曼特尔检验和方差分解,曼特尔检验用于AM真菌群落、物种多样性指数与土壤因子之间相关性检测;方差分解用于量化各因素对AM真菌群落影响大小.
2 结果与分析
2.1 土壤因子分布特征
5种荒漠植物,除红砂根围0~10 cm土壤酸性磷酸酶和猪毛菜根围0~10 cm土壤有机碳、有效磷、总磷、酸性磷酸酶和总提取球囊霉素含量低于根围20~30 cm土壤,其余土壤理化性质均为0~10 cm高于20~30 cm. 其中,泡泡刺0~10 cm总提取球囊霉素显著高于20~30 cm,膜果麻黄0~10 cm酸性磷酸酶和总氮含量极显著高于20~30 cm.
不同植物根围0~10 cm,有机碳、有效磷、酸性磷酸酶、碱性磷酸酶和总提取球囊霉素最大值分别为18.30 mg/g(红砂)、7.89 μg/g(膜果麻黄)、35.68 μg/g/h(泡泡刺)、49.18 μg/g/h(合头草)和8.54 mg/g(泡泡刺);不同植物根围20~30 cm,有机碳、铵态氮、有效磷、总氮、总磷、酸性磷酸酶和易提取球囊霉素最大值为16.71 mg/g(红砂)、0.30 mg/g(珍珠猪毛菜)、5.52 μg/g(膜果麻黄)、0.81 mg/g(泡泡刺)、0.55mg/g(含头草)、33.00 μg/g/h(泡泡刺)和5.01 mg/g(泡泡刺),不同植物间差异显著(图1).
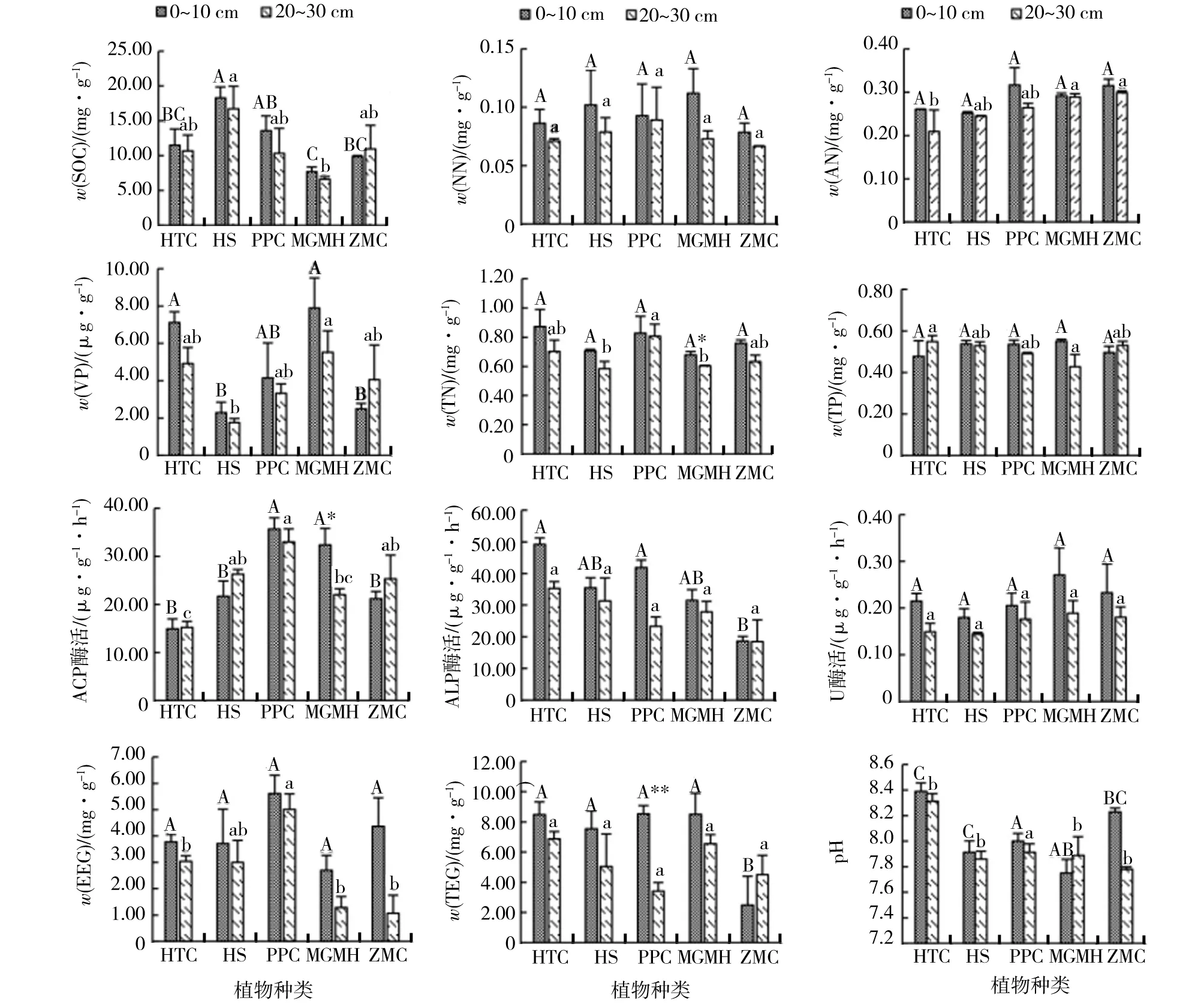
HTC. 合头草;HS. 红砂;PPC. 泡泡刺;MGMH. 膜果麻黄;ZMC. 珍珠猪毛菜; 下同. 不同大写字母表示不同植物根围0~10 cm土壤因子差异显著,不同小写字母表示不同植物根围20~30 cm土壤因子差异显著. * P<0.05和** P<0.01表示同一植物根围0~10 cm和20~30 cm差异显著.图1 不同植物根围0~10 cm和20~30 cm土壤因子Fig.1 Soil factors in the rhizosphere of 0~10 cm and 20~30 cm within different plants
2.2 AM真菌物种多样性
本实验共分离鉴定AM真菌10属45种,其中球囊霉属Glomus19种,无梗囊霉属Acaulospora11种,盾巨孢囊霉属Scutellospora5种,管柄囊霉属Funneliformis、近明囊霉属Claroideoglomus和根孢囊霉属Rhizophagus各2种,巨孢囊霉属Gigaspora、类囊霉属Paraglomus、内养囊霉属Entrophospora和多样孢囊霉属Diversispora各1种.
合头草根围29种,膜果麻黄根围28种,猪毛菜根围27种,红砂根围22种,泡泡刺根围20种. 其中球囊霉属、无梗囊霉属、盾巨孢囊霉属和管柄囊霉属在所有植物根区均有分布,近明囊霉属在合头草、红砂和泡泡刺根区分布,根孢囊霉属和巨孢囊霉属在红砂和膜果麻黄根区分布,类囊霉属在合头草、红砂、泡泡刺和猪毛菜根区分布,内养囊霉属在红砂、膜果麻黄和猪毛菜根区分布,多样孢囊霉属只在合头草根区分布(图2).
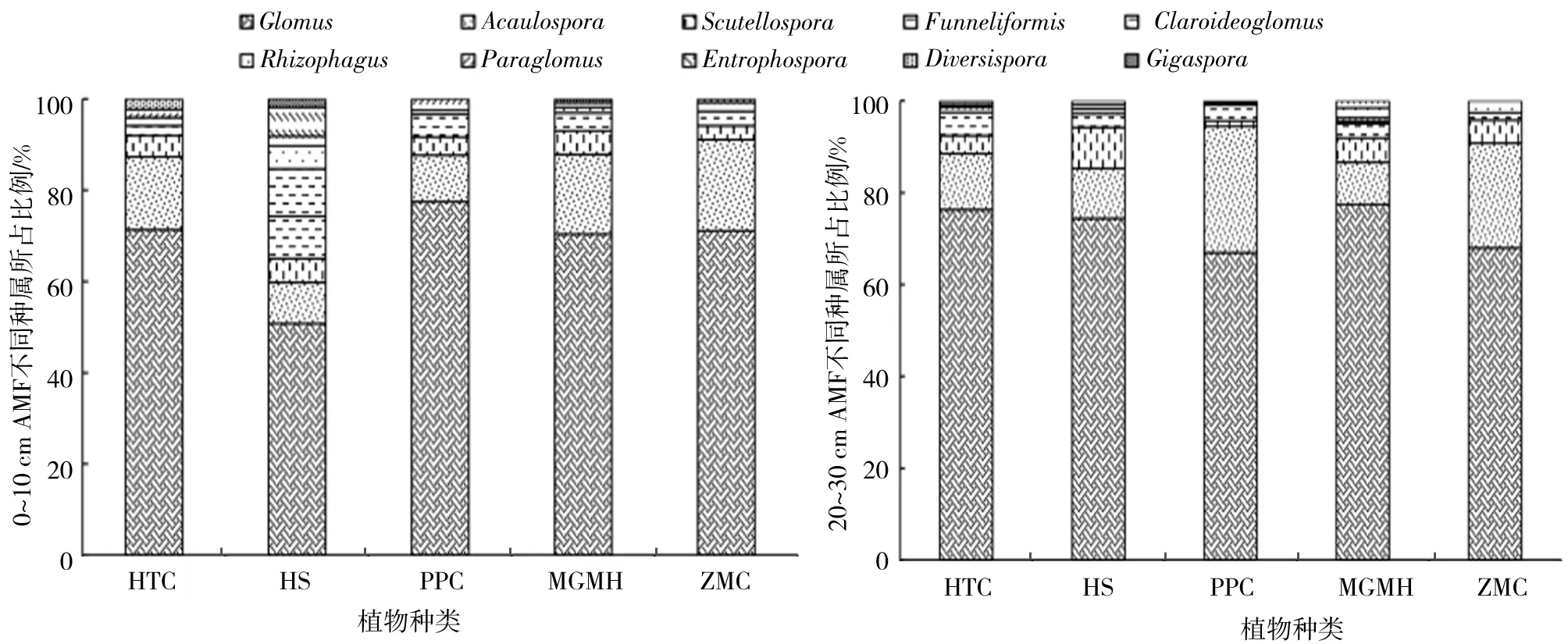
图2 不同植物根围0~10 cm和20~30 cm AM真菌群落组成比例Fig.2 Composition proportion of AM fungal communities in the rhizosphere of 0~10 cm and 20~30 cm within different plants
类囊霉属仅在合头草根围0~10 cm分布,根孢囊霉属仅在合头草根围20~30 cm分布,根孢囊霉属和巨孢囊霉属仅在红砂根围0~10 cm分布,近明囊霉属仅在膜果麻黄根围分布. 基于物种水平的非度量多维标度分析(NMDS)结果显示,不同植物AM真菌群落组成差异显著(图3).

图3 不同植物AM真菌群落NMDS Fig.3 NMDS of AM fungal species in the different plants
2.3 AM真菌孢子密度和多样性指数
5种荒漠植物,除合头草外,其他4种植物孢子密度0~10 cm均大于20~30 cm. 除猪毛菜外,其他4种植物0~10 cm AM真菌Shannon-Wiener指数和Simpson指数均大于20~30 cm,其中膜果麻黄0~10 cm AM真菌Shannon-Wiener指数和Simpson指数显著高于20~30 cm. 泡泡刺和猪毛菜0~10 cm AM真菌物种均匀度小于20~30 cm,其他3种植物0~10 cm AM真菌物种均匀度大于20~30 cm,无显著差异.
5种荒漠植物,合头草根围AM真菌孢子密度最多,其后依次为膜果麻黄、猪毛草、泡泡刺和红砂,合头草20~30 cm孢子密度显著高于其他植物. 0~10 cm AM真菌Shannon-Wiener指数和Simpson指数表现为膜果麻黄最高,其次为合头草,泡泡刺最低,泡泡刺显著低于膜果麻黄;根围0~10 cm AM真菌均匀度为红砂 > 膜果麻黄 > 猪毛菜 > 合头草 > 泡泡刺. 20~30 cm AM真菌Shannon-Wiener指数和Simpson指数表现为猪毛菜 > 合头草 > 膜果麻黄 > 红砂 > 泡泡刺,猪毛菜显著高于泡泡刺,泡泡刺根围AM真菌Shannon-Wiener指数和Simpson指数最低,根围20~30 cm AM真菌均匀度为猪毛菜 > 泡泡刺 > 红砂 > 膜果麻黄 > 合头草,猪毛菜显著高于膜果麻黄和合头草(表2).

表2 不同植物根围AM真菌孢子密度和多样性指数
不同大写字母表示根围0~10 cm植物间差异显著,不同小写字母表示根围20~30 cm植物间差异显著; *表示在0.05水平上同一植物根围0~10 cm和20~30 cm差异显著.
2.4 土壤因子主成分分析
根围0~10 cm土壤因子选取2个主成分,方差累计贡献率82.26%,第1主成分(PC1)可解释变量方差的55.54%,其中湿度、温度和有机碳对第1主成分贡献率较高,第2主成分(PC2)可解释变量方差的26.72%,碱性磷酸酶和有效磷对PC2起主要作用. 20~30 cm土壤因子选取2个主成分,方差累计贡献率87.36%,第1主成分(PC1)可解释变量方差的66.05%,其中湿度、温度和有机碳对第1主成分贡献率较高,第2主成分(PC2)中可解释变量方差的21.31%,碱性磷酸酶和总提取球囊霉素对PC2起主要作用. 因此,湿度、温度、有机碳、碱性磷酸酶、有效磷和总提取球囊霉素反映5种植物根围土壤状况(表3).
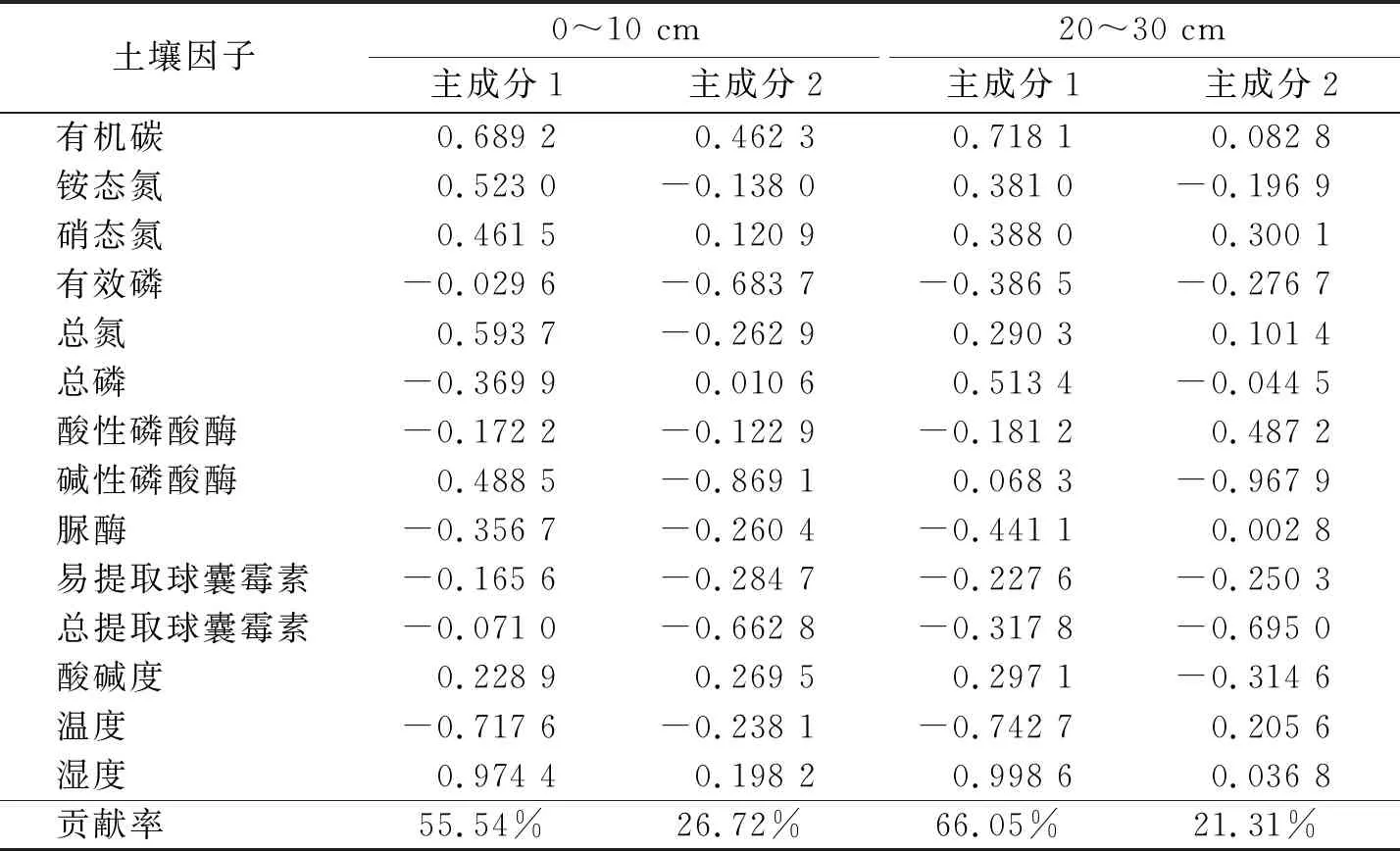
表3 土壤因子主成分分析
2.5 AM真菌群落、孢子密度和多样性指数与土壤因子曼特尔分析
AM真菌群落组成、孢子密度和多样性指数与0~10 cm土壤因子曼特尔分析表明,AM真菌群落组成与有机碳、硝态氮和湿度极显著正相关,孢子密度与有机碳、硝态氮、湿度和温度显著正相关;Simpson指数与易提取球囊霉素显著正相关;物种均匀度与硝态氮和总磷显著正相关,与湿度极显著正相关. AM真菌群落组成、孢子密度和物种多样性与20~30 cm土壤因子曼特尔分析表明,AM真菌群落组成与有机碳、硝态氮和总提取球囊霉素显著正相关;孢子密度与有机碳、硝态氮和总提取球囊霉素显著正相关,Shannon-Wiener指数和Simpson指数与硝态氮显著正相关,Shannon-Wiener指数与有机碳显著正相关(表4、5). AM真菌群落组成、孢子密度和多样性指数与0~10 cm和20~30 cm土壤因子曼特尔分析表明:AM真菌群落组成、孢子密度和多样性指数与土壤因子有显著相关性.
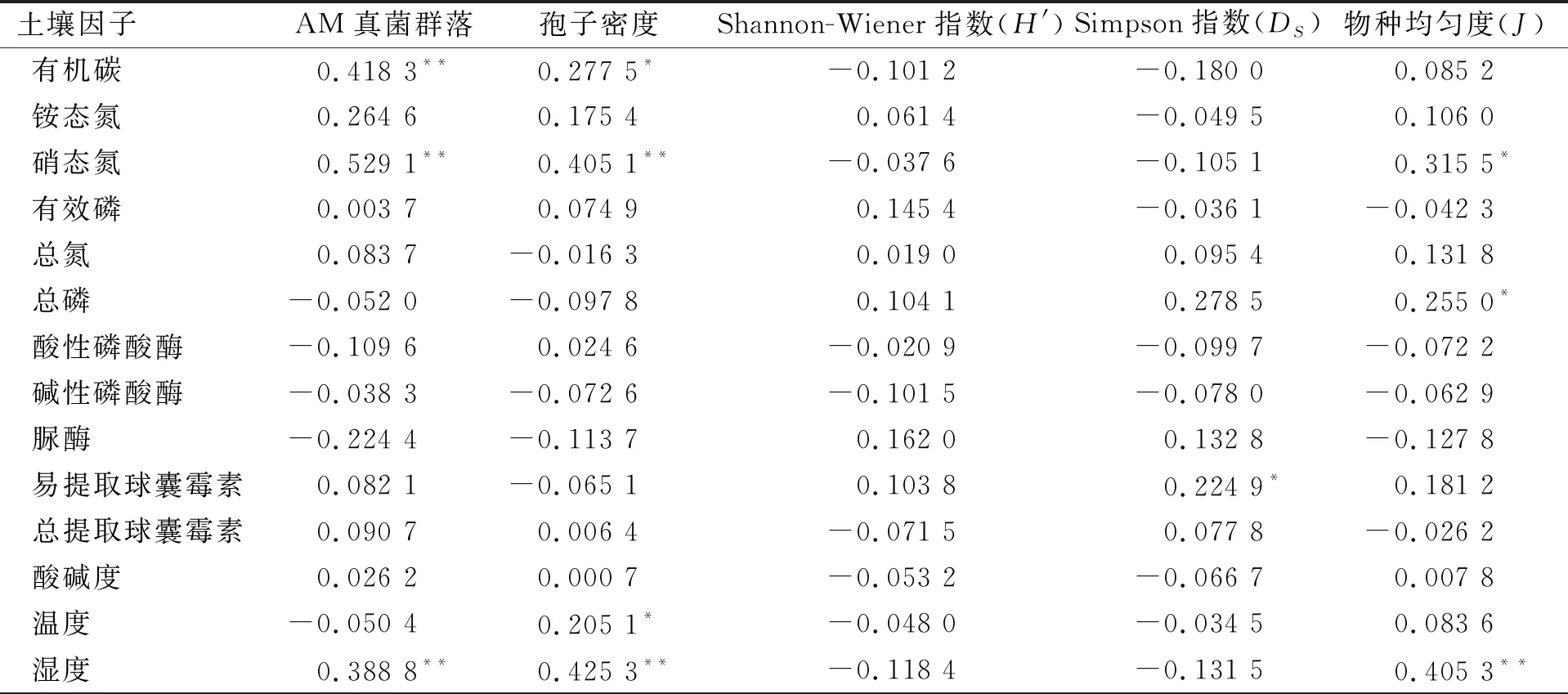
表4 AM真菌群落及物种多样性指数与根围0~10 cm土壤因子曼特尔分析
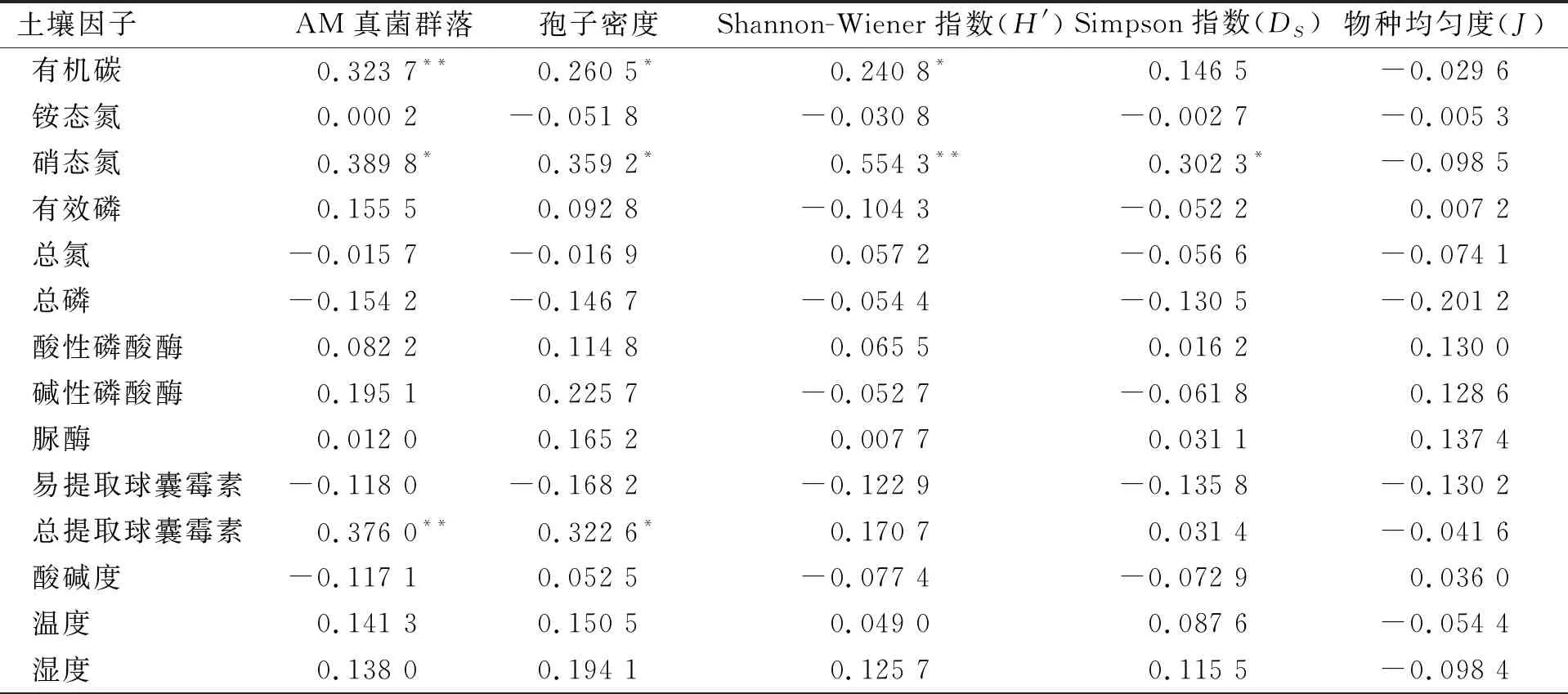
表5 AM真菌群落及多样性指数与根围20~30 cm土壤因子曼特尔分析
2.6 变差分解分析
变差分解量化3组解释变量植物种类、土壤矿质营养(有机碳、铵态氮、硝态氮、有效磷、总氮和总磷)和酶活(酸性磷酸酶、碱性磷酸酶和脲酶)对AM真菌群落总变差的贡献率. 植物种类、土壤矿质营养和酶活交互影响,根围0~10 cm和20~30 cm植物种类、土壤矿质营养和酶活共同解释AM真菌群落总变差的35.4%和60.7%. 根围0~10 cm AM真菌群落与植物种类、土壤矿质营养和酶活的变差分解分析表明,植物种类、土壤矿质营养和酶活可以解释AM真菌群落总变差的54.7%,植物种类、土壤酶活和矿质营养分别单独解释AM真菌群落总变差的45%、43.9%和36.3%;根围20~30 cm AM真菌群落与植物种类、土壤矿质营养和酶活的变差分解分析表明,植物种类、土壤矿质营养和酶活可解释AM真菌群落总变差的67.1%,植物种类、土壤酶活和矿质营养分别单独解释AM真菌群落总变差的44.9%、25.6%和53.2%(图4). 基于根围0~10 cm和20~30 cm AM真菌群落的变差分解表明,植物种类、土壤矿质营养和酶活共同影响AM真菌的群落组成.
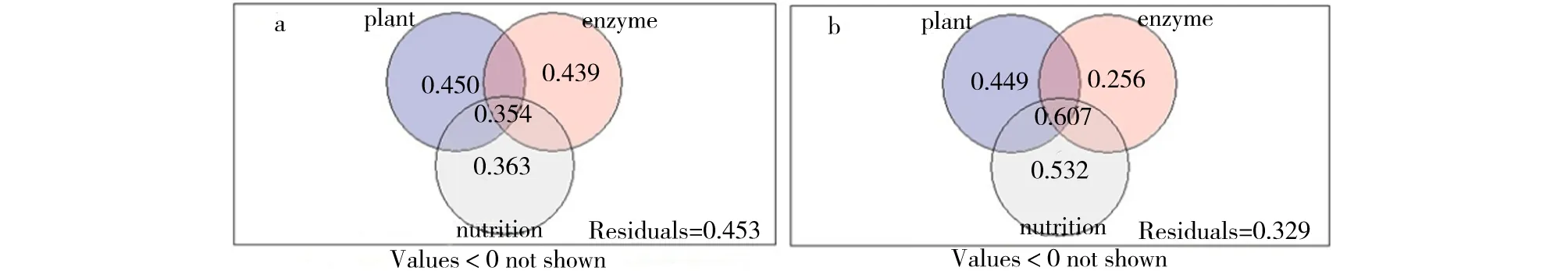
图4 根围0~10 cm(a)和20~30 cm(b) AM真菌群落与植物种类、土壤矿质营养和酶活的变差分解 Fig.4 Variation partitioning of AM fungal community by plant species, soil mineral nutrition and enzyme activities in the rhizosphere of 0~10 cm(a) and 20~30 cm(b)
3 讨论
球囊霉属、无梗囊霉属、盾巨孢囊霉属和管柄囊霉属在5种植物根围均有分布,其中球囊霉属在5种植物根围含量最高,其次是无梗囊霉属. 球囊霉属在各种类型环境中均有分布,在偏碱环境下,球囊霉属相对多度升高,表明球囊霉属较其他属更适合偏碱环境,对环境适应性更强[20];与王姣姣等[8]5种植物优势属研究结果不一致,这可能与年际和植物生长变化有关. 年际和空间变化会引起AM真菌群落组成变化,与土壤养分和酶活有关[21]. 5种植物根围AM真菌群落组成差异明显,且AM真菌优势种不同. 不同植物根系对矿质元素吸收不同,次级代谢产物不同,形成不同植物根区土壤营养成分占比,影响AM真菌群落组成变化[22-23].
AM真菌群落组成和孢子密度与土壤碳含量显著正相关,与前人研究一致. AM真菌增强营养缺乏环境下植物的抗逆性,提高宿主植物的光合作用[24],同样植物生长对土壤养分的需求和光合产物的供应影响AM真菌群落组成,同时增加土壤碳积累[25]. AM真菌群落组成和孢子密度与有机碳、硝态氮显著正相关,0~10 cm根围AM真菌物种均匀度、20~30 cm AM真菌Shannon-Wiener指数和Simpson指数与硝态氮显著正相关,与田学谦等[26]、刘春卯等[27]研究一致. 在营养缺乏的环境中,氮磷元素是最主要的养分限制因子,一定条件下,随氮和磷含量增加AM真菌孢子密度和多样性指数增大[28-29]. 植物根围0~10 cm和20~30 cm AM真菌群落组成没有差异,但植物根围0~10 cm土壤因子、AM真菌孢子密度和物种多样性指数高于根围20~30 cm,可能是0~10 cm根围微环境更有利于AM真菌完成生命活动,构建土壤微生态. 本文结果表明,AM真菌群落组成与有机碳、总提取球囊霉素等主要土壤因子显著相关,与贺学礼等[30]和刘海跃等[11]研究一致. 变差分解也表明,在根围0~10 cm和20~30 cm土壤酶活单独解释AM真菌群落总变差的43.9%和25.6%;矿质营养单独解释AM真菌群落变化总变差的36.3%和53.2%,荒漠环境中土壤因子显著影响AM真菌群落和物种多样性.
不同宿主和环境显著影响AM真菌群落组成和物种多样性[31-32]. 变差分解图表明,根围0~10 cm和20~30 cm植物种类、土壤矿质营养和酶活对AM真菌群落组成影响虽有差异,但共同解释AM真菌群落总变差的35.4%和60.7%,形成这种现象的可能原因是“肥岛”效应改变灌丛根系不同范围内土壤资源配置,形成土壤异质性和微环境异质性. 植物根围0~10 cm AM真菌与植物共生效应显著,随植物根系和AM真菌菌丝延伸,植物、土壤酶活和矿质营养互作对AM真菌群落的影响增大,与张新璐[33]和Kennedy等[34]研究一致,AM真菌群落组成受宿主植物和土壤理化性质综合影响,随年际变化和宿主生长也会发生变化. 同时,土壤0~10 cm和20~30 cm AM真菌群落与植物种类、土壤矿质营养和酶活的变差分解分别有45.3%和32.9%总方差未被解释,说明还存在其他因子从不同途径影响着AM真菌群落.
