表观遗传调控基因CLF在植物器官形态建成的研究进展
2020-07-23姜晓旭李晓屿RalfllerXing
姜晓旭 ,李晓屿 ,马 瑶 ,Ralf Müller-Xing *,邢 倩 *
(1.东北林业大学/东北林业大学盐碱地生物资源环境研究中心,哈尔滨 150040; 2.东北林业大学生命科学学院,哈尔滨150040; 3.辽宁石油化工大学化学化工与环境学部,辽宁 抚顺 113001)
拟南芥蛋白CLF是果蝇PRC2组分Zeste[E(z)]的直系同源物,这是一种对H3K27具有特异性的甲基转移酶。最初在黑腹果蝇中被发现,不久后在拟南芥中发现E(z)的同源蛋白,其组分之一为CLF[1]。通过对拟南芥clf突变体展开研究,发现CLF在植物生长发育过程中起着重要作用。它的缺失能够改变植物的花期,花朵形态,造成叶子多效性等[2]。近年来随着对PRC2的深入研究,CLF的面貌也逐渐清晰完整起来。本文主要介绍了CLF的表达模式,通过调控其下游基因的表达来参与植物各个器官,如花,果实,叶片等的形态建成,以期为研究CLF及CLF同源物在植物形态建成和生长发育过程中的功能提供参考。
1 CLF影响植物花发育及花期
1.1 CLF影响植物花发育
短日照下clf突变体与野生型植物的花形态差别明显[1,3]。clf-2(CLF缺失型突变体)开花后伸长的茎间和节间较野生型植株短,花序高度较野生型花序高度低。野生型花朵的萼片在花发育后期能够包裹住花苞,但clf-2突变体的萼片却少有弯曲,不能完全包裹花苞,所以导致花苞提前开放[1]。同野生型相比,clf突变体的花瓣总是更小更窄。突变体的花表现出萼片和花瓣分别向心皮和雄蕊的部分同源转变。雄蕊样花瓣形状介于花瓣与雄蕊之间,白色花瓣表面有黄色花药样组织斑块。在受影响最严重的花中,第二轮花器官有缺失。心皮样萼片具有心皮特有的几个特征,例如萼片常沿边缘融合,顶端有类似乳头状突起,边缘产生胚珠[1]。同时也发现一些花朵其雄蕊数量减少,心皮也未完全融合。而在长日照的条件下,clf与野生型花朵的形态差别不明显。所以CLF缺失后,对短日照条件下的花朵发育有较大的影响。
1.2 CLF调控开花基因
clf-50是一种缺失型突变体,其开花时间较野生型早。以莲座叶和茎生叶的叶片总数作为衡量植物开花时间长短的标准。在长日照中,clf-50突变体的叶片总数比野生型少10片左右,在短日照中,clf-50突变体的叶片总数比野生型少20片左右[4]。
在clf突变体植物中,不只发现AG(AGAMOUS)异位表达。与开花相关的基因FT(FLOWERING LOCUS T),FLC(FLOWERING LOCUS C)也同样异位表达[5]。AP3(APETALA3),SEP3(SEPALLATA3)在clf突变体中亦大量表达[6,7]。同时,还有研究发现拟南芥在开花过渡期间,组蛋白甲基转移酶CLF可以与NF-YC(Nuclear Factor-Y subunit C)同源物质短暂互作[8]。在植物中,NF-YC亚基由一个多基因家族编码,在控制开花时间上起重要作用[9,10]。拟南芥NF-YC同源基因在光周期依赖性开花途径中与FT基因具有功能上的冗余性,它们通过形成典型的NF-YC-YB-YA和特定的NF-YC-YB-CO复合物,分别在FT启动子区域识别远端CCAAT盒增强子和近端共反应元件[11,12]。NF-Y因子通过招募不同的组蛋白修饰因子来调控不同阶段的植物发育[13]。NF-YC同源物通过与CLF的短暂相互作用来抵消H3K27三甲基化在FT染色质中的沉积,从而减弱CLF与FT位点的关联,在长日照条件下解除对FT转录的抑制[8]。FT基因的表达能够促进植物开花,当FT位点上三甲基化标记减少后,植物就会提前开花。
在二穗短柄草中,EZL1(ENHANCER OF ZESTE-LIKE 1)是拟南芥CLF的同源基因[14]。ezl1功能缺失突变体在长日照下表现出不经过春化就能提前开花的表型,与拟南芥clf突变体表现相同。并且与开花相关的基因VRN1和AG的表达量都有升高,植物整体H3K27的二甲基化水平和三甲基化水平明显降低。在ezl1突变体的基础上突变VRN1或AG,早花的表型会得到部分恢复[15]。所以CLF和CLF同源基因在调控植物开花时间上起到了十分重要的作用。
2 CLF影响植物种子及果实发育
2.1 CLF影响种子发育
通过对转录组的分析发现拟南芥基因组中约11.6%的基因在各个器官中被CLF抑制。令人意外的是,其中大约54%的基因在荚果中最先被抑制。对118个转录组数据集的进一步分析揭示了一组CLF在成熟-青绿期胚胎中优先表达和抑制的基因,这一观察结果表明,CLF在胚胎发育期间介导了大规模的H3K27三甲基化标记或者重新标记事件[16]。有研究表明,在荚果中被CLF抑制的基因除能够响应激素外,还能够编码与脂质颗粒,脂质储存和种子成熟相关的蛋白。同野生型相比,clf突变体中调控种子发育的ABI3(ABA INSENSITIVE3)和FUS3(FUSCA3)基因的表达量升高,所以clf-28(CLF缺失突变体植株)的种子形状更大,质量更重,含油量也更高[16,17]。这也证明在荚果中CLF参与调控与种子合成相关的基因。
2.2 CLF影响果实发育
CLF同源基因能够调控番茄的果实发育。拟南芥一个小基因家族编码的Zeste Polycomb group蛋白在番茄中由三个基因SlEZ1、SlEZ2和SlEZ3编码[18]。番茄基因组只含有一个ESC和一个Su(z)12,但是含有三个E(z)基因,其中的两个基因,SlEZ1和SlEZ2,分别与拟南芥SWINGER和CURLY LEAF基因同源,编码针对细胞核的蛋白质,而第三个基因,SlEZ3,被认为是编码一个缺乏定义域的截断蛋白[18]。对SlEZ1基因的功能分析表明,该蛋白与番茄花心皮数和雄蕊发育有关[19]。与拟南芥中CLF同源性最高的SlEZ2缺失后,番茄中H3K27三甲基化水平明显降低,这点与拟南芥缺失CLF后表现相同。SlEZ2在大多数植物器官中均有表达,但在叶片、花瓣和花柱中的细胞中有特异性表达。在slez2转基因突变体中,花败育的几率增加,番茄成熟的果实也要比野生型的球形果实更加扁平且柔软[18]。在相同年龄下,slez2转基因的果实颜色不表现出健康的绿色,而呈淡绿色至惨白色,果实上有一些不规则的绿点。而野生植物的果实大部分呈现出健康的绿色,一些果实上还有若干条规则的淡黄色条纹[18]。果实成熟后,野生型和转基因植物的成熟果实大多为红色,但转基因植物的果实红色强度往往低于野生型,与转基因果实中番茄红素含量降低相一致。所以CLF同源基因在调控植物果实发育及成熟上起着十分重要的作用。
3 CLF影响植物叶片发育
细胞在每一阶段的分裂和伸长速率影响植物叶片最终形状的形成[20-22]。CLF突变后,拟南芥表现出既窄又小向上卷曲的叶片[1]。并且叶片的伸长程度明显下降[23]。CLF能对开花同源基因AG进行调控,clf突变体呈现出窄,小,并叶卷的表型与AG基因过表达的表型十分相似[24,25],而造成叶片这种表型正是因为开花同源基因AG的异位表达[1,4],在clf-50的背景下再次突变AG基因后会发现,clf-50 ag双突变体叶片平展,叶片表型恢复[4],和野生型叶片表型相似。
clf突变体植物的叶片细胞不论是从数量还是大小上都有着明显的下调[23]。在横切面上clf-25(CLF功能缺失突变体)的栅栏细胞宽度是完全展开的第五片叶的59%,在纵向切片上,clf-25突变体的栅栏细胞长度和厚度分别为同时期野生型的59%和65%[23]。clf-25突变体叶片栅栏细胞数量分别为野生型叶片宽度方向细胞数量的55%和叶长方向细胞数量的67%。clf-25突变体的叶片细胞总数也远少于野生型叶片细胞总数[23]。同野生型相比,clf突变体在叶片发育过程中细胞分裂期和细胞伸长期的时间虽没有明显变化,但clf突变体的细胞数量和细胞伸长率都明显低于野生型[23]。有实验表明,clf突变体的叶片的细胞数量显著减少[23]。由此可知clf突变体植物的叶片能够正常形成,但是叶片的大小和数量却显著降低。
4 CLF影响植物根及侧枝生长
生长素的极性运输影响植物根的生长和发育。拟南芥中的生成细胞需要IAA28(吲哚-3-乙酸-28)依赖的生长素信号才能开始分裂[26]。在拟南芥中,PIN(PIN-FORMED)家族是生长素运输载体,定位在质膜上。其中PIN1在中柱基底膜定位并将生长素运输到根尖[27,28]。在拟南芥根尖,缓慢分裂的静止中心和周围的干细胞构成了根干细胞生态位(Stem Cell Niche,SCN)[29]。而CLF甲基转移酶可以抑制原根中干细胞的活性[30],抑制细胞的分裂从而能在一定时间内限制根的伸长,所以当CLF缺失后,突变体的主根长度和侧根数量都会较野生型有明显变化。
有研究表明,clf-81植株(CLF功能缺失突变体)同野生型相比,其主根的长度会比野生型主根更长,侧根数量和密集程度也较野生型增加,而clf-59(CLF过表达突变体)植株同野生型相比,主根长度显著缩短,侧根数量也较野生型有大量减少[29]。arf-7和arf-19(生长素响应因子AUXIN RESPONSE FACTOR,ARF功能缺失突变体)无侧根生成,clf-81、arf-7、arf-19三突变体亦没有侧根生成。这说明,CLF可在上游调控ARF7,ARF19来抑制侧根生成。用生长素响应基因DR5沿主根标记生成细胞,clf-81植株的能够被标记的静态点同野生型相比有显著增加[31,32],这暗示CLF能抑制生成细胞的产生。并且在clf-1(CLF缺失突变体),clf-81植株中,PIN1的表达量有明显的上调,证明CLF能够直接抑制PIN1的表达。在clf-29突变体中,NRT2.1(NITRATE TRANSPORTER 2.1)的表达量也显著升高,NRT2.1能够编码拟南芥中的关键根硝酸盐转运蛋白从而抑制侧根起始物的生成[33]。还有研究表明,clf-28(CLF缺失突变体)的侧枝同野生型相比明显增多[34]。所以CLF能通过调节不同基因的表达来影响根的伸长和侧根的形成。附图为CLF参与植物部分器官形态建成调控网络。
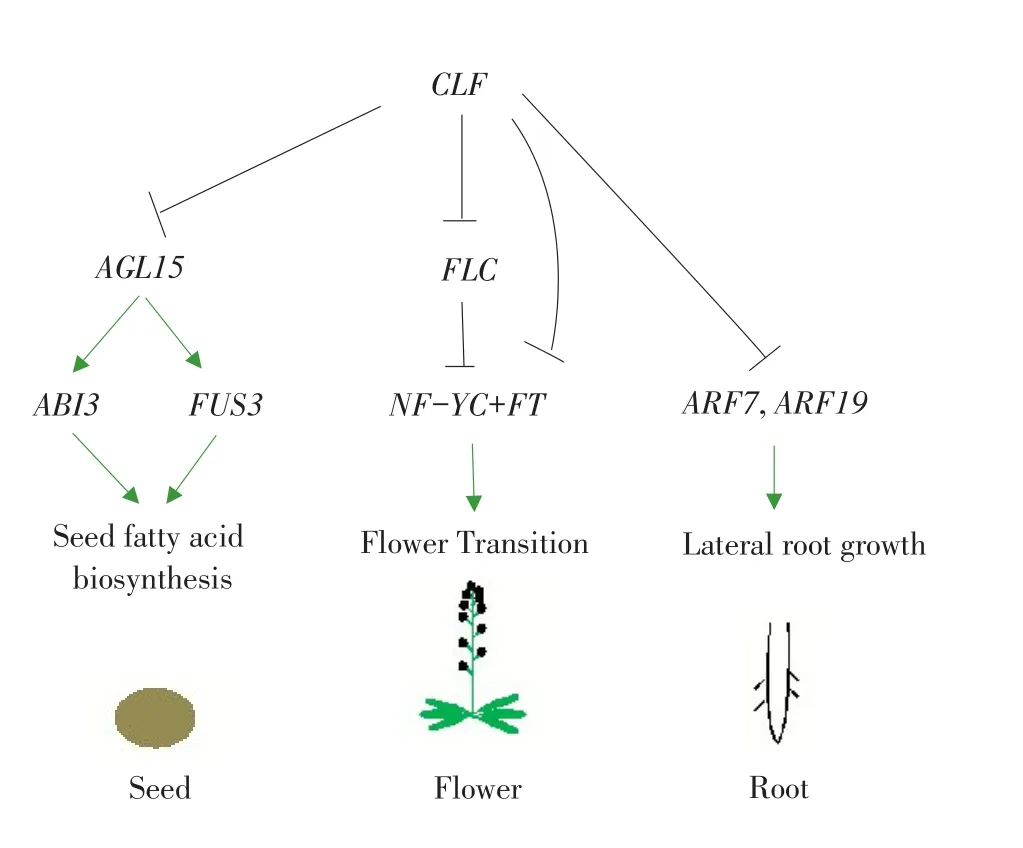
附图 CLF参与植物器官形态建成
5 CLF对植物生长发育的其他影响
除了本文上述所讨论的基因外,还有许多其他基因也受到CLF的调控。在野生型拟南芥中,至少有6 854个以上的基因位点是H3K27三甲基化的富集区域,这些靶基因受到PRC2蛋白调控,往往具有时空表达特异性[35]。如I类KNOX(KNOTTED1-LIKE HOMEOBOX)基因,它能够在胚胎发生和整个成熟发育过程中在茎顶端分生组织中起作用,维持细胞分裂不分化的状态[36,37]。DOG1(DELAYOF GERMINATION1)据报道是种子休眠的主要调节基因,它的缺失会形成不休眠种子[38-40]。DOG1在种子休眠前成熟过程中表达,其积累与休眠水平相关。低温也会上调DOG1的表达从而抑制休眠被打破[39]。而CLF表达会增加DOG1位点上H3K27三甲基化沉积,负调控DOG1,打破休眠并诱导萌发[41]。由CLF和SWN控制的H3K27三甲基化在植物脱落酸诱导的响应元件上富集,有助于长期抑制ABA诱导的衰老,并潜在地加强了植物的胁迫耐受性[42]。FIT(FER-LIKE IRON DEFICIENCY INDUCED TRANSCRIPTION FACTOR)推测是铁元素摄取反应的转录因子,CLF突变后,FIT表达量升高,研究发现clf突变体比野生型更耐铁缺乏[43]。AGO1(ARGONAUTE1)可以选择性招募micro RNA和siRNA并切碎他们。CLF突变后,由于AGO1泛素化增加导致特定组织的miRNA活性因此受损[44]。由此可知,CLF在植物整个生长发育和形态建成中起到了十分重要的作用。附表为CLF参与调控的基因。

附表 CLF参与调控的基因
6 结语
自1997年发现CLF以来,对于CLF的相关研究已取得很大成果。现在国内对于CLF的研究主要与PRC2相关,对其基因本身的探究相对较少。主要分析CLF具有的H3K27的三甲基化的抑制作用。而国外学者对于CLF研究在于它在生物形态建成方面时发挥的功能,探究生物在生长过程中CLF与上下游基因的调控网络机制。在形态建成方面,CLF涉及植物生长发育的方方面面,包括到根的伸长,种子发育,叶片生长及花发育。但是,CLF基因在植物生长发育过程中发挥的作用现在还处于继续探究并完善的阶段。
此外,CLF蛋白结构高度保守,在番茄,大米,二穗短柄草等其他植物中亦发现其同源物质。因此我们对这个基因的研究不应只停留在模式作物中。在水稻,番茄等农作物上,关于CLF的研究相对较少,而有实验表明CLF对于植物果实的成熟有着很重要的调控作用,所以研究CLF对于经济作物的增产方面会具有重要意义。不仅如此,在观赏性植物中,CLF也为促进新品种的产生和提升观赏性提供了更多可能。
