危重症新型冠状病毒肺炎患者2例治疗体会
2020-07-22胡泽凡李琳胡忠诚
胡泽凡,李琳,胡忠诚
(孝感市第一人民医院麻醉科,湖北 孝感 432100)
新型冠状病毒肺炎(COVID-19)具有传染性极强、潜伏期长、临床表现多样、易感人群广等特点[1],疫情暴发后,我院与重庆医疗队紧密合作,成功救治2例COVID-19危重症患者,现报道如下。
1 患者资料
病例1:患者,女,40岁,身高156 cm,体质量57 kg,有武汉居住史,于 2020年1月23日从武汉返回孝感,1月27日出现发热、咳嗽、乏力、全身肌肉酸痛及呼吸困难症状,于2月1日以“发热、咳嗽、乏力伴呼吸困难”就诊并确诊为COVID-19入住我院隔离病区。患者自诉既往体质较弱,伴高血压及糖尿病。入院查体:体温37.5 ℃,心率(HR)102次/min,呼吸频率(RR)28次/min,血压(BP) 119/78 mmHg,脉搏血氧饱和度(SpO2) 89%~92%;空腹血糖14.6 mmol/L。神志清,精神较差,急性热病面容;双肺呼吸音粗,可闻及湿性啰音。血常规提示:白细胞(WBC)4.33×109/L,淋巴细胞32.9%。
入院后行咽拭子核酸检测阳性,胸部CT检查提示双肺间质性改变并多发磨玻璃影、浸润影高密度影(图1A);按国家卫生健康委员会颁布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》诊断标准;诊断为重型COVID-19。
病例2:患者,男,70岁,身高171 cm,体质量69 kg,因“咳嗽伴发热4 d”入院,4 d前因接触武汉亲属后出现发热及咳嗽,并在当地卫生院给予抗病毒及抗炎治疗后无好转,于2月5日凌晨自觉症状加重并全身酸痛、呼吸困难等症状前往我院治疗,行胸部CT及核酸检测后考虑为病毒性肺炎,入住我院隔离病区。患者既往有冠心病冠脉支架植入史、糖尿病多年,体质差。入院前最高体温38.0 ℃,伴恶心、呕吐及腹泻,呕吐物为胃内容物。入院时伴明显胸闷、气短及呼吸困难。入院后查体:体温37.7 ℃,HR 110次/min,RR 30次/min,BP 98/60 mmHg,SpO285%~89%;痛苦病容,双肺呼吸音粗,可闻及湿性啰音,心律不齐。胸部CT提示:双肺多发斑片状高密度影,考虑病毒性肺炎可能(图2A);咽拭子核酸检测阳性;血常规提示WBC 10.96×109/L,中性粒细胞比(PMD) 90.6%,淋巴细胞6.2%;磷酸肌酸激酶(CPK)59.9 IU/L。血糖6.92 mmol/L,白蛋白34.1 g/L,白球比0.94,乳酸脱氢酶(LDH) 575 IU/L,CPK 525 IU/L,C反应蛋白(CRP)156.72 mg/L,钾3.56 mmol/L,氯104.2 mmol/L,钙 2.19 mmol/L,心电图示窦性心动过速(HR 112次/min)并心律不齐。按国家卫生健康委员会颁布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》标准诊断为重症COVID-19。
2 治疗过程
病例1:患者入院后给予莲花清瘟胶囊(4粒/次,口服,3次/d)、奥司他韦胶囊(75 mg,口服,2次/d)、雾化吸入干扰素α-1b (30 μg/次,2次/d)等抗病毒,盐酸莫西沙星针(400 mg/次,静脉滴注,1次/d)抗感染。2月3日,患者仍低热,体温37.3~37.5 ℃,并出现胸闷、气短、呼吸困难及少尿,SpO2在82%~85%之间,给予高流量面罩吸氧,加阿比多尔(200 mg,口服,3次/d),胸腺法新针(日达仙)1.6 mg,皮下注射,1次/d。抗病毒治疗,甲强龙针(40 mg,静脉滴注,2次/d),泮托拉唑针(40 mg,静脉滴注,1次/d)。2月3日复查胸部CT提示:双肺感染,病毒性肺炎(较前进展)(图1B);血常规提示WBC 12.74×109/L,PMD占80.4%,淋巴细胞12.6%;血生化提示钾3.02 mmol/L,白蛋白10.2 g/L,血糖14.82 mmol/L,CPR 99.32 mg/L,CPK 29 IU/L,LDH 492 IU/L;血气分析为pH 7.34,动脉血二氧化碳分压(PaCO2) 33 mmHg,动脉血氧分压(PaO2)55 mmHg,剩余碱(BE)-3.2 mmol/L,面罩吸氧下末梢动脉血氧饱和度(SaO2)86%~88%(吸氧6 L/min),经我院和重庆专家团队讨论后考虑已进展为危重症COVID-19合并呼吸衰竭,修正治疗方案给予哌拉西林舒巴坦(3 g,静脉滴注,3次/d)及莫西沙星针(400 mg/次,静脉滴注,1次/d)抗感染,胰岛素及二甲双胍(0.5 g口服,2次/d)控制血糖,无创呼吸机辅助通气治疗,继续使用甲强龙(40 mg,静脉滴注,2次/d)冲击、加用免疫球蛋白(15 g/d),静脉滴注、静脉补充白蛋白(10 g/d,静脉滴注)、氨基酸、脂肪乳、补钾(氯化钾缓释片1 g,2次/d,口服)等营养支持治疗,甲强龙治疗3 d后逐渐减量,白蛋白疗程为10 d,免疫球蛋白疗程为8 d。
病例2:患者于2月5日入院后给予α-2a干扰素500万U雾化吸入,2次/d;利托那韦600 mg,2次/d抗病毒,莲花清瘟胶囊(3粒/次,口服,3次/d) ,奥司他韦胶囊(75 mg,2次/d)抗病毒等对症支持治疗,高流量面罩吸氧后患者SpO2可维持在90%~93%,继续上述治疗方案治疗3 d后患者持续低热,伴胸闷、气短、呼吸困难加重、少尿甚至无尿、下肢水肿等症状,2月8日复查胸部CT提示,双肺多处肺实变(图2B);病情进展迅速持续加重,血常规提示WBC 14.65×109/L,PMD 94.1%,淋巴细胞3.5%,血生化示:钾3.8 mmol/L,谷草转氨酶(AST) 98.8 IU/L,尿素(BUN) 8.19 μmol/L,肌酐(Cr)152 μmol/L,谷丙转氨酶(ALT)62.5 IU/L,碱性磷酸酶(ALP)59.9 IU/L,血气分析示:pH 7.23,PaCO231 mmHg,PaO252 mmHg,BE-5.1 mmol/L,吸入氧浓度(FiO2)21%。经我院和重庆专家团队讨论后考虑患者已进展为危重症COVID-19并呼吸衰竭并肝、肾功能损害,修正治疗方案停用莫西沙星、哌拉西林舒巴坦改泰能(1 g,静脉滴注,1次/8 h),停用利托那韦改阿比多尔(200 mg,口服,3次/d),加用多稀磷脂酰胆碱(20 mL,静脉滴注,1次/d)、还原型谷胱甘肽(1.2 g,静脉滴注,1次/d)护肝,补充白蛋白(10 g/次,静脉滴注,1次/d),胰岛素控制血糖,同时使用无创呼吸机辅助通气治疗,甲强龙冲击(40 mg,静脉滴注,2次/d),加用免疫球蛋白(15 g/d),补充脂肪乳、氨基酸补液支持等的综合治疗,动态监测动脉血气及肝肾功能。甲强龙治疗5 d后逐步减量,白蛋白疗程为7 d,免疫球蛋白疗程为10 d。
3 结果
综合治疗15 d后,2例患者自诉胸闷、咳嗽有所缓解,食欲及精神状态明显好转,复查胸部CT提示病灶较前明显吸收(图1C、D,图2C、D),最终脱机后SpO2在93%以上,复查2次核酸阴性,顺利康复出院。
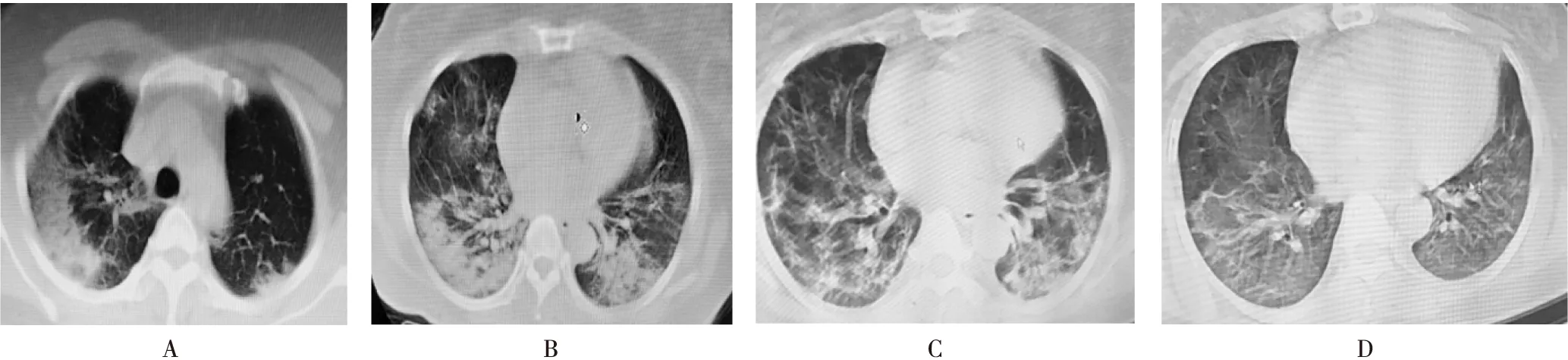
A:2月1日胸部CT;B:2月3日胸部CT;C:2月19日胸部CT;D:3月10日胸部CT.图1 病例1胸部CT结果

A:2月5日胸部CT;B:2月8日胸部CT;C:3月23日胸部CT;D:3月28日胸部CT.图2 病例2胸部CT结果
4 讨论
本文对2例危重症COVID-19患者疾病的发生、发展及治疗过程进行了详细描述,有助于临床医生更好地了解和认识这一传染性极强的新型疾病。目前尚无特异性针对COVID-19的抗病毒药物。所用药物选择国家卫健委发布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》的目录用药,早期使用莲花清瘟、奥司他韦、利托那韦、干扰素雾化效果不佳,后期症状加重。目前,COVID-19的感染侵袭机制尚不完全明确,可能机制是新型冠状病毒通过与细胞血管紧张素转换酶2 (ACE2) 结合感染人体[2-3],造成机体损伤可能与诱导过度免疫反应有关,导致“自我攻击”,造成多器官损伤[4]。
研究发现,COVID-19患者外周血中CD4及CD8细胞数量明显减少,但其免疫细胞状态高度激活,主要表现为炎性细胞Th17增加和CD8细胞的高细胞毒性,提示患者可能存在严重免疫损伤[5]。炎症早期使用小剂量激素可减少渗出和水肿,防止毛细血管扩张、白细胞浸润,后期可抑制毛细血管、纤维母细胞增生,阻止肺纤维化、粘连形成[6-8]。炎症早期,参与的细胞因子、趋化因子可相互作用以保持系统平衡,当部分炎症因子被过度激活后,引发 “炎症因子风暴”,带来更严重的炎症反应,造成免疫病理损伤[8-10]。甲强龙是一种合成的糖皮质激素,起效迅速,生物半衰期短,无盐皮质激素的作用,停留肺部血药浓度高,安全性良好[11]。在炎症因子风暴来临时使用激素治疗,可有效抑制细胞因子和炎性介质的产生,减轻肺部炎症过度反应,使得炎症反应下调[7]。控制炎症反应的关键是避免炎症因子风暴的激活[9-10]。因此,激素使用的时机显得尤为重要,错过最佳的治疗时机,造成病情继续发展或恶化。使用小剂量激素甲强龙抑制过度的免疫反应,促使体温尽早恢复正常、减轻临床症状及体征、改善低氧血症、控制病灶进展、减少并发症的发生、缩短患者住院时间等[12],3~5 d后减量,再使用人血丙种球蛋白1周,以提高危重患者的抗感染能力,恢复患者免疫力,从而防止重症患者病情恶化,降低危重症患者死亡率,提高治愈率[12]。有研究表明,COVID-19重症患者血清白蛋白水平均有不同程度下降,推测可能因为在机体严重感染情况下白蛋白分解代谢速率加快,同时感染急性期反应蛋白合成增加,同时重症患者多存在营养摄取不足,导致白蛋白合成数量和速度下降,出现低白蛋白血症[13]。血清白蛋白水平与重症疾病的预后密切相关[14-15]。Vincent等[16]研究发现低蛋白血症与临床不良预后强相关,低白蛋白是病情严重程度及预后判断的可靠指标。人血白蛋白来自健康人的血浆成分,可使组织和血管之间水分的动态平衡进行调节,并能维持血浆容量和血浆的胶体渗透压[17]。在COVID-19加重期机体肺部出现过度的炎性反应,可使大量的炎性细胞对毛细血管内皮细胞直接损伤,导致肺泡毛细血管网通透性增加,出现毛细血管渗漏综合征[18],早期使用白蛋白提高肺毛细血管胶体渗透压,减少肺毛细血管炎性渗出,提高重症患者氧合,纠正低氧血症,防止危重症患者出现多器官功能损害。
本文2例患者均合并Ⅱ型糖尿病,应用糖皮质激素影响血糖控制,我们应用降糖口服药并配以胰岛素治疗,将患者空腹血糖均控制于8 mmol/L,餐后2 h控制于13 mmol/L以内,减少血糖波动所致的免疫系统紊乱、内环境紊乱、合并感染、低血糖昏迷等并发症[19]。2例危重症患者早期使用小剂量糖皮质激素和白蛋白,能有效抑制细胞因子和炎性介质的产生,减轻肺部炎症过度反应,减轻肺间质水肿,同时配合无创呼吸机通气治疗,提高氧合并及时纠正低氧血症,是阻断危重症患者出现多器官功能损害的关键治疗措施。
