大肠杆菌中三酶耦联合成α-酮异戊酸
2020-07-22李雅婷周丽周哲敏
李雅婷,周丽,周哲敏
(江南大学 生物工程学院,江苏 无锡,214122)
α-酮异戊酸(α-ketoisovalerate)在医药、食品、化妆品等领域应用广泛[1]。α-酮异戊酸钙是α-酮酸片的主要成分之一,适用于慢性肾病患者[2-3];在饲料里加入α-酮异戊酸能有效刺激家畜的肌肉生长[4-5];同时,α-酮异戊酸也是维生素B5的重要合成原材料[6]以及异丁醇合成过程中必不可少的中间体[7]。
目前,通过化学合成法和生物转化法可合成α-酮异戊酸,其中又以化学合成法较为常见。然而,化学合成法工艺繁琐且反应条件严苛,伴随有毒副产物的产生,不适用于大规模工业生产[8]。生物转化法以L-缬氨酸为底物在氨基酸脱氨酶和氨基酸氧化酶的催化下转化为α-酮异戊酸[9]。利用氨基酸氧化酶法产α-酮酸在我国已实现工业化。然而,酶转化法的效率较低,且反应过程中会有H2O2的生成,且难以除去[10-12]。利用发酵法生产α-酮异戊酸可以有效地消除有毒副产物的产生且成本更低,更利于环保。目前利用大肠杆菌发酵生产α-酮异戊酸的研究很少,所报道的大多数是利用谷氨酸棒杆菌为宿主菌进行α-酮异戊酸的发酵积累[13-15]。
在生物体中从头合成α-酮异戊酸,必须共同表达多个关键酶。各酶在细胞内的均衡高效表达可使催化过程更协调,有利于促进目标产物的合成,因此选择合适的共表达策略至关重要。目前在大肠杆菌中实现多酶共表达的策略主要有2种,包括多质粒共转化系统和多顺反子系统[16]。多质粒共转化系统将基因分别置于不同的质粒中进行共同表达,因此表达基因的数量受到筛选标记和复制起点的可相容性等因素的限制,且有研究表明多个质粒共转化后有的基因并没有表达[17]。同时,多顺反子系统将多个基因置于同一质粒中进行表达,存在基因的排列顺序影响其表达水平的问题[18]。研究发现,应用多顺反子载体在一个启动子下游共表达2个基因,启动子后面第2个基因编码的蛋白质表达水平明显弱于启动子后第1个基因编码的蛋白质[19],为了解决这一问题,当需要控制不同基因的转录水平时,可以给每个基因添加独立的启动子,使每个基因都可以独立转录[20],同时也可以通过调节基因在质粒上的不同顺序,平衡各个基因的表达水平。此外,不同的终止子对于mRNA的量有很大影响,并且终止子的效率与mRNA的量有一定的相关性[21]。添加有效的终止子也可以帮助基因进行正确的转录,以促进蛋白质的高效均衡表达[22]。
本研究通过克隆枯草芽孢杆菌来源的乙酰乳酸合成酶基因BsalsS、大肠杆菌来源的乙酰乳酸异构还原酶基因EcilvC和二羟基酸脱水酶基因EcilvD,构建了1株三酶串联表达合成α-酮异戊酸的重组大肠杆菌。通过调整基因的排列顺序、添加终止子等策略,对多个酶的平衡表达进行了调节,经体外转化测定,筛选出1株最优的重组菌,并实现了发酵合成α-酮异戊酸,为以大肠杆菌为宿主生产α-酮异戊酸及其衍生物奠定了基础。
1 材料与方法
1.1 菌株、质粒与引物
菌株E.coliBL21(DE3)、E.coliDH5α、E.coliMG1655、B.subtilis168,质粒pETDuet-1由本实验室保藏,质粒pUC-Term由苏州金唯智生物科技有限公司合成。本研究所用引物见表1,由苏州金唯智生物科技有限公司合成。

表1 本研究所用引物
1.2 主要试剂与培养基
Prime Star max DNA聚合酶、ExTaqDNA聚合酶、T4 DNA连接酶、Quick CutBamH I、HindIII、EcoR I、SacI、NotI、DNA Marker、Protein Marker(Broad),宝生物工程(大连)公司;质粒提取试剂盒、纯化试剂盒、抗生素、IPTG、丙酮酸钠,生工生物工程(上海)股份有限公司;α-酮异戊酸,sigma。其他试剂为国药试剂。
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。
2YT培养基(g/L):胰蛋白胨16,酵母粉10,NaCl 5。
M9-2培养基(g/L):Na2HPO46, KH2PO43, NaCl 0.3,NH4Cl 1,酵母粉5,葡萄糖36,MgSO42 mmol/L,微量元素0.1%(体积分数)。
微量元素(g/L): FeSO4·7H2O 10.0,CuSO4·5H2O 3.0,MnSO4·4H2O 0.5,ZnSO4·7H2O 5.25,(NH4)Mo7O240.1,Na2B4O7·10H2O 0.2,CaCl22.0,溶于 1 mol/L HCl 溶液中。
1.3 主要仪器
PCR仪、凝胶成像仪、蛋白电泳仪,BIO-RAD公司;UV-1 800 PC型紫外可见分光光度计,上海美普达有限公司;pH计,梅特勒-托利多仪器(上海)有限公司;生物传感仪,山东省科学院;高效液相色谱仪,日立(HITACHI)公司;Prevail Organic Acid 色谱柱(250 mm×4.6 mm,5 μm),美国奥泰公司。
1.4 重组质粒的构建
1.4.1 不同基因顺序质粒的构建
分别以B.subtilis168基因组、E.coliMG1655基因组为模板,以表1中P1+P2、P13+P14、P25+P26为上下游引物,克隆基因BsalsS、EcilvC、EcilvD。将质粒pETDuet-1与克隆基因用表1中对应的酶切位点进行双酶切后,利用T4 DNA连接酶在16 ℃进行过夜连接,连接产物转化至E.coliDH5α感受态细胞中,挑选阳性转化子进行菌落PCR验证,测序后得到重组质粒pET-BsalsS、pET-EcilvC、pET-EcilvD。分别以pET-BsalsS、pET-EcilvC、pET-EcilvD为模板,以表1中P3+P4、P15+P16、P27+P28为上下游引物,克隆片段PT7-BsalsS、PT7-EcilvC、PT7-EcilvD。将质粒pET-BsalsS与PT7-EcilvD用对应的酶切位点进行双酶切后连接,得到重组质粒pET-BsalsS-EcilvD。同样的方法可得到重组质粒pET-EcilvC-BsalsS、pET-EcilvC-EcilvD、pET-EcilvD-BsalsS、pET-EcilvD-EcilvC。分别以表1中P5+P6、P7+P8为上下游引物,以B.subtilis168基因组、质粒pET-EcilvC-EcilvD/pET-EcilvD-EcilvC为模板,获得片段BsalsS与质粒骨架后进行吉布森组装,得到重组质粒pCDS、pDCS。分别以表1中P17+P18、P19+P20为上下游引物,以E.coliMG1655基因组、质粒pET-BsalsS-EcilvD/pET-EcilvD-BsalsS为模板,获得片段EcilvC与质粒骨架后进行吉布森组装,得到重组质粒pSDC、pDSC。分别以表1中P29+P30、P31+P32为上下游引物,以E.coliMG1655基因组、质粒 pET-EcilvC-BsalsS为模板,获得片段EcilvD与质粒骨架后进行吉布森组装,得到重组质粒pCSD。各质粒基因排列顺序如图1所示。

图1 不同基因排列次序的共表达策略
1.4.2 基因终止子的添加
分别以质粒pUC-Term、pCSD为模板,以表1中P21+P22、P23+P24为上下游引物,获得片段EcilvC-Term与质粒骨架后进行吉布森组装,得到重组质粒pCTSDT。分别以质粒pUC-Term、pCTSDT为模板,以表1中P9+P10、P11+P12为上下游引物,获得片段BsalsS-Term与质粒骨架后进行吉布森组装,得到重组质粒pCTSTDT(图2)。
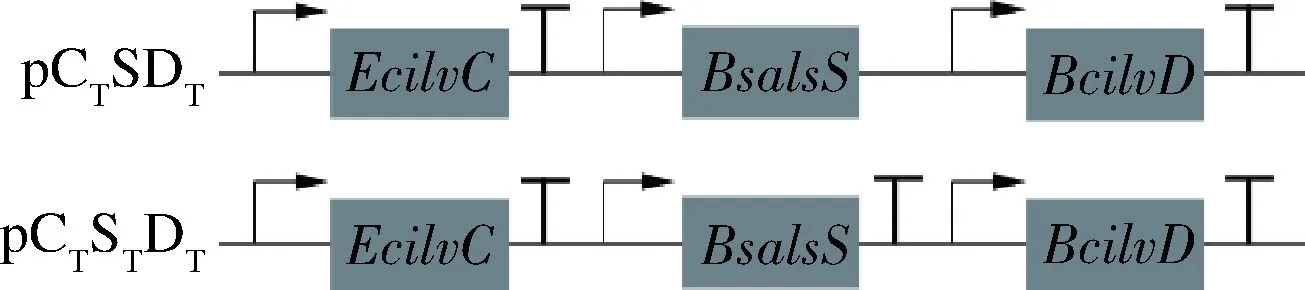
图2 基因终止子添加策略
将重组质粒pET-BsalsS、pET-EcilvC、pET-EcilvD、pSDC、pCSD、pCDS、pDSC、pDCS、pCTSDT、pCTSTDT分别转化至E.coliBL21(DE3)感受态细胞中,得到重组菌S、C、D、SDC、CSD、CDS、DSC、DCS、CTSDT、CTSTDT。保存至-80 ℃冰箱中。
1.5 重组菌的诱导表达及最优菌株筛选
将保存至-80 ℃冰箱的重组菌株在含有100 μg/mL氨苄抗生素的LB固体培养基上划线活化,挑取单菌落接种于含有100 μg/mL氨苄抗生素的5 mL LB液体培养基中,37 ℃、200 r/min振荡培养8 h,按照体积分数1%的接种量转接至含有100 μg/mL氨苄抗生素的50 mL 2YT培养基中,与37 ℃、200 r/min培养至OD600约为0.8时,加入终浓度为0.4 mmol/L的IPTG诱导,诱导温度为30 ℃,诱导20 h后收集菌体。
离心收集菌体,调节菌体浓度OD600为40,用pH 7.0的0.1 mol/L的磷酸盐缓冲液重悬菌体后进行超声破碎得粗酶液。将粗酶液统一稀释8倍,利用Bradford法进行粗酶液的蛋白浓度测定并利用SDS-PAGE电泳分析目的蛋白表达情况。
体外转化反应体系为1 mL,其中含有100 μL粗酶液,50 μL 1 mol/L丙酮酸钠,10 μL TPP,10 μL NADPH,剩下的液体用pH 7.0的0.1 mol/L的磷酸盐缓冲液补足。置于30 ℃金属浴中反应30 min后,于100 ℃煮沸10 min灭活,离心取上清液,检测上清液中产物α-酮异戊酸的含量。
1.6 α-酮异戊酸的检测
α-酮异戊酸的HPLC检测条件[23]:色谱柱Prevail Organic Acid,流动相为pH 2.5、25 mmol/L的KH2PO4溶液,流速1 mL/min,柱温40 ℃,紫外检测器波长210 nm,进样量10 μL。
2 结果与分析
2.1 AlsS、IlvC、IlvD三酶耦联表达体系的构建
以B.subtilis168基因组为模板克隆目的基因BsalsS,以E.coliMG1655基因组为模板分别克隆EcilvC、EcilvD基因,经琼脂糖凝胶电泳验证,目的条带大小与理论值相符。电泳结果如图3所示。

M-标准DNA;1-BsalsS;2-EcilvC;3-EcilvD
对重组菌S、C、D、SDC进行诱导表达。SDS-PAGE电泳(图4)表明当3个基因分别单独表达时,均能获得明显条带;而当3个基因串联表达时,3个蛋白表达量均有明显的下降,且AlsS与IlvD大小相近,在SDS-PAGE电泳中并不能明显地分开,IlvC由于在串联体系的最末尾,表达量极低。

M-标准蛋白; 1-对照; 2-S; 3-C; 4-D; 5-SDC
对于多基因的共表达,通常需要选择合适的共表达策略。KIM等[19]研究发现,当1个启动子下游共表达2个以上的目的基因时,紧跟在启动子后面的基因表达水平明显高于远离启动子的基因表达水平,这可能是由于远离启动子的基因转录不完全而引起的。同时,PERRAKIS等[24]通过对多种基因共表达的研究表明,共表达的多个基因的DNA序列大小和组成也可能影响基因的表达水平。因此,基因顺序的不同对于多基因是否能够均衡表达有着相当关键的作用。接下来针对3个基因排列顺序进行优化。
2.2 不同基因排列顺序对三酶表达水平与催化性能的影响
对重组菌SDC、CSD、CDS、DSC、DCS进行诱导表达。对其蛋白表达量进行检测,并以丙酮酸钠为底物进行反应并测定产物α-酮异戊酸的合成水平,结果如图5所示。

a-不同基因顺序蛋白表达;b-不同基因顺序蛋白浓度测定;c-不同基因顺序α-酮异戊酸催化合成 1-对照; 2-SDC;3-DSC; 4-DCS; 5-CSD; 6-CDS
由SDS-PAGE图(图5-a)可以看出,重组菌CSD蛋白表达总量有明显提升,且对粗酶液中的总蛋白浓度进行测定,也初步论证了这一点(图5-b)。如图5-c所示,重组菌CSD催化底物丙酮酸钠生成0.40 g/L α-酮异戊酸,比优化前菌株SDC产量提高42.86 %。因此,基因在载体上的顺序在很大程度上影响基因的表达及催化效率,这与之前的文献报道[19]相符。选择重组菌株CSD作为后续研究菌株。
虽然经过基因顺序优化之后,产量有了明显的提升,但是其总产量却仍然很低,猜测多基因串联在表达水平上彼此存在竞争关系,虽然已经尽量对多基因的表达进行协调,但还是存在转录水平不完全、表达不均衡等问题。针对这个问题,我们决定对表达较弱的相关基因通过添加终止子的策略进行完整的表达体系构建。
2.3 添加终止子对三酶表达水平与催化性能的影响
对重组菌CTSDT、CTSTDT进行诱导表达。比较添加不同终止子的蛋白表达效果及体外转化效率, SDS-PAGE图(图6-a)及粗酶液的蛋白浓度测定(图6-b)结果显示,添加了终止子后,重组菌CTSDT的蛋白总量有了明显的提升。体外转化结果如图6-c所示,当EcilvC添加终止子,α-酮异戊酸产量有了明显提升,为0.91 g/L,对比未加终止子前的0.40 g/L,α-酮异戊酸产量提高了1.28倍。

a-添加终止子蛋白表达; b-蛋白浓度测定;c-添加终止子α-酮异戊酸催化合成 1-对照; 2-CSD; 3-CTSDT; 4-CTSTDT
通过添加终止子策略对基因实现精细化调控是较为常见的调控手段。WANG等[22]通过对266种终止子转录效率的研究表明,添加有效的终止子可以帮助基因进行正确的转录,形成更加稳定的mRNA,从而实现对基因的精细化调控。MAIRHOFER等[25]通过在E.coli中添加不同的T7终止子组合,有效地提高了终止子的终止效率。本研究中由于基因EcilvC表达量不高,通过添加了终止子提高其终止效率,转录形成更多正确的mRNA,从而有效地提高了产物α-酮异戊酸的产量。于是,选择重组菌株CTSDT作为后续的研究菌株。
2.4 α-酮异戊酸发酵合成
利用体外粗酶液转化需要外源添加辅酶TPP与NADPH,操作繁琐且成本较高,而通过发酵法利用菌体自身代谢实现产物α-酮异戊酸的积累是一个较为简单且有效的方法。于是,在质粒构建优化完成后,我们利用M9-2培养基,对重组菌株CTSDT进行摇瓶发酵验证。在发酵过程中,每间隔4 h进行取样并同时调节pH在7左右。结果如图7所示,当发酵16 h时,α-酮异戊酸的产量达到1.70 g/L,与未经过改造的重组菌SDC相比较,提升了3.36倍。而在接下来的培养过程中,α-酮异戊酸产量有所下降,因为α-酮异戊酸是多条代谢途径的中间产物[26],猜测可能是α-酮异戊酸在体内被进一步消耗生成其他代谢物。
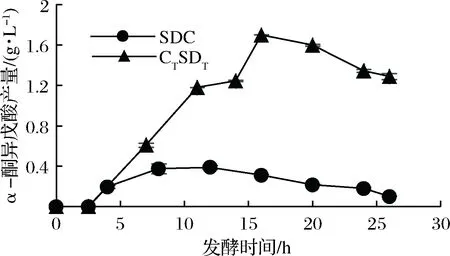
图7 重组菌发酵合成α-酮异戊酸验证
利用大肠杆菌发酵生产α-酮异戊酸,与传统的酶法转化氨基酸生产α-酮异戊酸相比,具有更加绿色环保且高效等优点。LI等[12]通过酶法转化L-缬氨酸生成α-酮异戊酸,反应16 h仅生成0.56 g/L α-酮异戊酸,本研究仅通过优化了关键代谢途径的基因表达,利用大肠杆菌发酵16 h可生成1.70 g/L α-酮异戊酸,极大地提高了产物的产量,且发酵过程中不会产生H2O2等毒副产物,方便后续提取分离。
3 结论
本研究通过克隆α-酮异戊酸合成过程的3种基因,在大肠杆菌体内过表达了该途径。通过优化3个基因的排列顺序和终止子添加方式,获得了最优菌株CTSDT。重组菌株CTSDT体外催化合成α-酮异戊酸水平为0.91 g/L;以葡萄糖为碳源发酵16 h 可获得1.70 g/L α-酮异戊酸,比未优化前的菌株SDC产量提高了3.36倍。在接下来的研究中,将尝试敲除α-酮异戊酸的进一步消耗途径基因,如ilvE、panB等,以实现产物α-酮异戊酸的高效发酵合成。本研究实现了在大肠杆菌中发酵法生产α-酮异戊酸,为大肠杆菌发酵法生产α-酮异戊酸提供了研究思路。
