内镜下萎缩性胃炎分级对胃癌筛查的指导价值*
2020-07-22张观坡叶显宗江传燊曾德华李达周
张观坡 叶显宗 江传燊 曾德华 郑 锦 柳 刚 王 蓉 李达周 王 雯&
中国人民解放军联勤保障部队第900医院 厦门大学附属东方医院消化内科福建医科大学福总临床医学院1(350025)中国人民解放军联勤保障部队第900医院病理科2
背景:普及胃镜筛查是提高早期胃癌诊断率的有效途径。为使筛查更有效率,筛查时间间隔应根据胃癌风险分层决定。目的:探讨通过内镜下萎缩性胃炎分级能否确定胃癌风险分层。方法:纳入2015年1月—2019年12月在中国人民解放军联勤保障部队第900医院至少接受过2次胃镜检查的患者,记录人口学资料和胃镜检查信息。采用木村-竹本分类法对内镜下萎缩性胃炎进行分级,根据分级结果将患者分为轻度组(无萎缩和C-1)、中度组(C-2、C-3)和重度组(O-1及以上),分析内镜分级与胃癌发生风险之间的相关性。结果:共8 736例患者纳入研究,轻、中、重度组分别为4 154例(47.6%)、2 409例(27.6%)和2 173例(24.9%);平均胃镜随访时间为(1 052±643) d,两次胃镜检查平均间隔时间为(518±271) d。内镜诊断与病理诊断萎缩性胃炎的总体符合率为88.9%。胃镜随访中共发现41例胃癌,胃癌检出率由轻度组至中、重度组依次递增(0.07%、0.54%和1.15%, P<0.001)。结论:基于内镜下萎缩性胃炎分级可对患者进行胃癌风险分层,指导制订个体化的胃镜随访间期。
胃癌是我国最常见的恶性肿瘤之一,国家癌症登记中心数据显示,2014年我国胃癌年龄标化发病率为19.51/10万人,年龄标化死亡率为13.30/10万人[1];全世界约有42.6%的胃癌新发病例和45.0%的胃癌死亡病例发生在中国[2]。胃癌的转归和预后与诊断时的肿瘤分期密切相关,然而我国目前的胃癌诊断中早期胃癌仅占10%~15%[3]。因此,逐步普及胃癌筛查是提高我国早期胃癌诊断率,进而改善患者预后的有效途径。
近年来,随着我国国民经济水平和国人健康意识的提高,越来越多的就诊者主动要求接受频繁的胃镜检查,从而占用大量医疗资源。因此,针对不同胃癌风险个体制订不同的随访方案,可降低低危个体的恐癌心理和胃镜检查频率,同时密切监控高危个体的胃黏膜病变,及早发现早期病变并进行内镜治疗,从而有效降低公共卫生费用的支出。本研究旨在评估通过内镜下萎缩性胃炎分级确定胃癌风险分层,从而指导制订胃镜随访间期的价值。
对象与方法
一、研究对象
从中国人民解放军联勤保障部队第900医院消化内镜中心2015年1月—2019年12月的胃镜检查数据中筛选出年龄40~80岁、至少接受过2次胃镜检查且临床资料基本完整的个体。纳入标准:胃镜检查图像至少包括贲门正镜、贲门倒镜、胃底、胃体上部、胃体中部、胃体下部、胃体小弯侧、胃角、胃窦、幽门。排除标准:首次胃镜检查发现胃癌。研究方案经医院伦理委员会审核批准。所有患者胃镜检查时均于胃窦小弯取1块活检行Warthin-Starry染色检测幽门螺杆菌(Helicobacterpylori, Hp),如存在可疑病灶则增加相应部位活检块数;存在活检禁忌证者行13C-尿素呼气试验确定Hp感染状态。Hp阳性患者接受14 d铋剂四联疗法根除Hp治疗(奥美拉唑20 mg bid,阿莫西林1 000 mg bid,克拉霉素500 mg tid,胶体果胶铋500 mg tid;阿莫西林过敏者改用左氧氟沙星500 mg qd),治疗结束1个月后行13C-尿素呼气试验评估Hp是否根除,或是在第二次胃镜检查时取活检行Warthin-Starry染色确认Hp是否根除。
二、方法
记录入组患者的性别、年龄等人口学资料以及首次胃镜检查和胃镜随访信息,包括萎缩性胃炎程度、Hp感染情况、活检病理结果、胃癌部位和分期等。内镜图片和病理切片分别由2名高年资消化内科主治医师和2名高年资病理主治医师进行复审。内镜下萎缩性胃炎分级采用木村-竹本(Kimura-Takemoto)分类法[4]:内镜下萎缩界限未越过贲门为闭合型(close type,C型),越过贲门为开放型(open type,O型)。根据萎缩界限的具体位置,C型进一步分为C-1(萎缩界限局限于胃窦部)、C-2(萎缩界限刚过胃角)、C-3型(萎缩界限超过胃角但未达贲门);O型进一步分为O-1(萎缩界限刚过贲门)、O-2(萎缩界限遍及整个胃底)、O-3型(萎缩界限延伸至胃体;图1)。根据分级结果将患者分为轻度组(无萎缩和C-1)、中度组(C-2、C-3)和重度组(O-1及以上),分析内镜分级与胃癌风险等的关系。
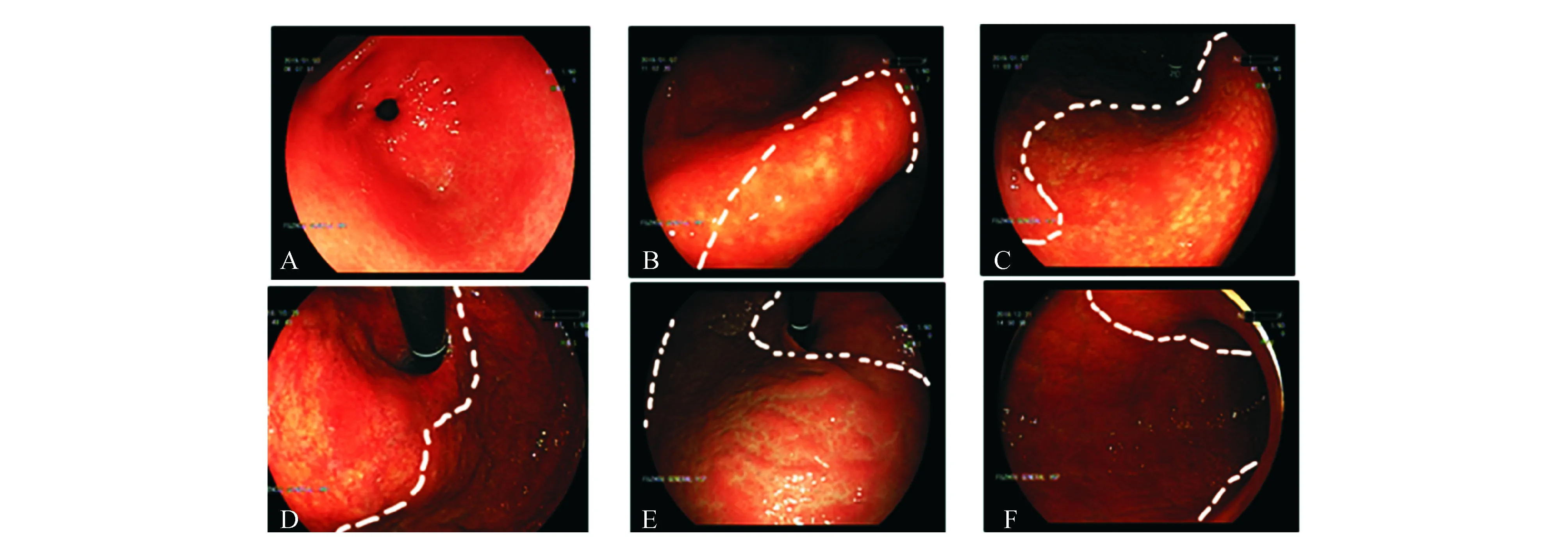
A: C-1; B: C-2; C: C-3; D: O-1; E: O-2; F: O-3
三、统计学分析
结 果
一、一般资料
共8 736例行2次及以上胃镜检查者纳入研究,其中男性4 231例,女性4 505例,平均年龄(62.8±3.7)岁,胃镜随访时间(首次与末次胃镜检查间隔时间)平均为(1 052±643) d,两次胃镜检查间隔时间平均为(518±271) d。首次胃镜检查时,内镜下提示萎缩性胃炎7 541例,其中C-1 2 959例,C-2 1 473例,C-3 936例,O-1 1 281例,O-2 647例,O-3 245例;1 195例内镜下未观察到胃黏膜萎缩。轻度组(无萎缩和C-1)、中度组(C-2、C-3)和重度组(O-1及以上)分别为4 154例(47.6%)、2 409例(27.6%)和2 173例(24.9%),各组胃镜随访时间、检查次数和检查间隔时间见表1。
二、Hp感染和根除情况
入组患者中4 832例(55.3%)Hp感染阳性,其中4 682例(96.9%)接受根除治疗,根除成功4 299例,根除率为91.8%,根除失败383例;97例未接受根除治疗,53例相关资料缺失。不同组别患者的Hp感染和根除情况见表2,轻、中、重度组Hp阳性率分别为33.2%、74.7%和76.0%,三组间差异有统计学意义(P<0.05);Hp根除率分别为92.2%、93.1%和90.1%,三组间差异无统计学意义(P>0.05)。
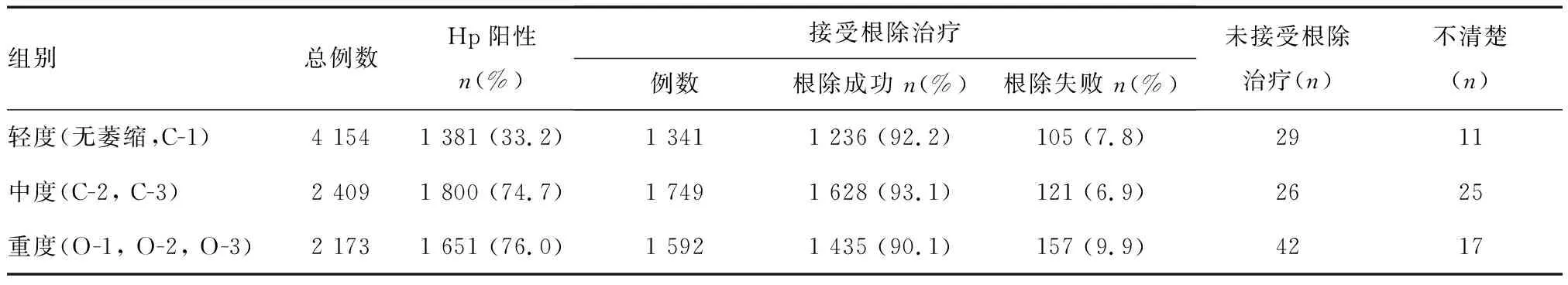
表2 不同萎缩程度患者的Hp感染和根除情况
三、内镜诊断与病理诊断萎缩性胃炎的符合率
7 541例内镜下诊断为萎缩性胃炎的患者中,407例因存在活检禁忌证而未取活检,7 134例获得活检病理诊断,其中6 339例病理诊断为胃黏膜萎缩,诊断总体符合率为88.9%。内镜下不同萎缩分级患者的诊断符合率见表3,诊断符合率随萎缩程度的加重而增高(P<0.05)。
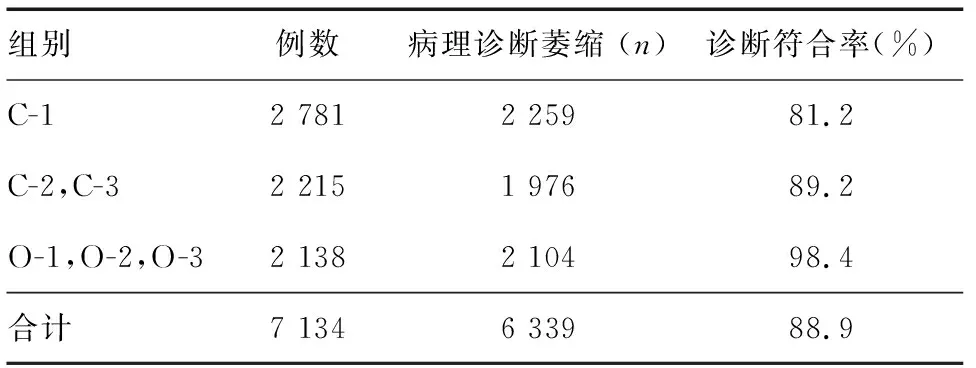
表3 内镜诊断与病理诊断萎缩性胃炎的符合率
四、胃癌检出率
胃镜随访中共发现41例胃癌,胃癌总体检出率为0.47%,其中早期胃癌32例,进展期胃癌9例(图2)。根据内镜下萎缩分级分层分析,胃癌检出率由轻度组至中、重度组依次递增(0.07%、0.54%和1.15%,P<0.001;表1)。
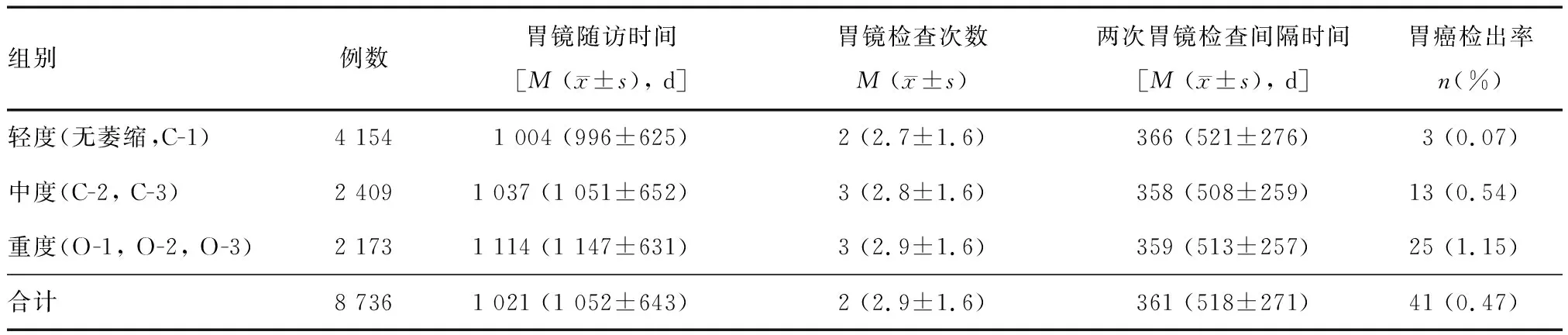
表1 不同萎缩程度患者胃镜随访时间、检查次数、检查间隔时间和胃癌检出率
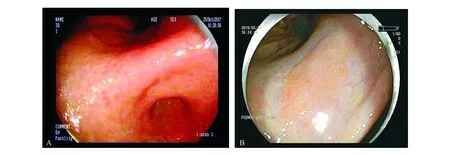
A:2017年内镜下提示萎缩性胃炎C-2;B:2019年随访提示胃角处早期胃癌
进一步以60岁为临界点分析年龄与胃癌发生之间的关系,结果显示60岁及以上年龄段患者的胃癌检出率显著高于年龄小于60岁的患者(0.60%对0.30%,P<0.05;表4)。

表4 不同年龄分组患者胃癌检出率
讨 论
胃癌的转归和预后与诊断时的肿瘤分期密切相关,晚期胃癌医疗费用高、治疗效果差,5年生存率不足20%,而早期胃癌的5年生存率在90%以上,治疗费用也相对较低[5]。日本于20世纪60年代开始进行早期胃癌筛查,2015年的统计数据显示早期胃癌诊断率已超过50%,胃癌总体5年生存率超过60%[6]。普及胃癌筛查和推广内镜下早诊早治也是提高我国早期胃癌诊断率、降低胃癌死亡率的有效途径。为使筛查更有效率,筛查时间间隔应根据胃癌风险分层决定。
近年来,随着国人健康意识的增强,胃镜检查已成为包括胃癌在内的上消化道肿瘤筛查的重要手段。胃镜和活检病理检查可发现胃黏膜萎缩、肠化生、上皮内瘤变等癌前状态/病变和早期胃癌,是早期胃癌筛查的金标准。然而,我国慢性萎缩性胃炎患者基数庞大,由中华医学会消化内镜学分会组织开展的一项横断面调查纳入源自10个城市、33个医学中心共8 892例有上消化道症状且经胃镜检查证实的慢性胃炎患者,其中经病理证实的萎缩性胃炎比例高达25.8%[7]。由于公众的恐癌心理,越来越多的就诊者主动要求接受频繁的胃镜检查,占用大量医疗资源,且内镜医师因疲于应付繁重的胃镜检查而导致每例受检者的单位检查时间缩短,可能使早期胃癌和癌前状态/病变筛查质量下降。
既往研究中,内镜诊断萎缩性胃炎的敏感性较低,以病理诊断为金标准,敏感性仅为42%[7]。近年来,随着放大内镜和图像增强内镜的推广应用,诊断准确性不断提高[8]。本组患者内镜与病理诊断萎缩性胃炎的总体符合率达88.9%,且符合率随萎缩程度的加重而增高。临床工作中,由于部分活检无法深达黏膜肌层,导致病理诊断时不能对萎缩进行严格分级,需多点活检才能采用新悉尼系统的病理分级标准。本研究采用内镜下萎缩性胃炎木村-竹本分类法,中度萎缩和重度萎缩与病理诊断的符合率达到89.2%和98.4%,诊断准确性高且可在胃镜操作时进行实时评价,提示其对筛选胃癌高危人群有一定指导价值。
进一步分析木村-竹本分类法对胃癌风险的预测价值,结果显示重度组(O-1, O-2, O-3)胃癌检出率为1.15%,显著高于中度组(C-2, C-3)和轻度组(无萎缩,C-1)的0.54%和0.07%。Masuyama等[9]采用木村-竹本分类法的研究结果也提示,胃癌发生风险随萎缩范围和程度的加重而增加,C-1、C-2、C-3、O-1、O-2、O-3所对应的胃癌检出率分别为0%、0.25%、0.71%、1.32%、3.70%和5.33%。因此,基于内镜下萎缩性胃炎分级对患者进行分层管理是可行的。2015年发布的《幽门螺杆菌胃炎京都全球共识》推荐无症状患者进行Hp根除治疗的最佳时机为非萎缩性胃炎阶段[10]。本研究分析显示不同萎缩程度患者的Hp感染率差异显著,感染率随萎缩程度的加重而增高,但Hp根除率相当,均在90%以上。
国家消化系统疾病临床医学研究中心联合中华医学会消化内镜学分会于2017年推出的《中国早期胃癌筛查流程专家共识意见(草案)》建议采用新型胃癌筛查评分系统进行胃癌风险分层以指导胃镜随访间期[2]。本研究结果显示,内镜下萎缩性胃炎分级与病理诊断有较高的符合率,萎缩程度与胃癌发生风险之间有一定相关性,因此可根据内镜分级对患者的胃癌风险进行分层,个性化决策胃镜随访间期。基于轻、中、重度组胃癌检出率的统计学差异,可将无萎缩和C-1视为低危组,C-2和C-3视为中危组,O-1及以上视为高危组。此外,本研究分析显示60岁以上患者的胃癌检出率显著增高,提示对于该年龄段的轻度萎缩甚至无萎缩患者也不应忽视胃镜随访。
既往研究[11]发现无Hp感染的胃癌主要为印戒细胞癌和胃底腺癌,且无萎缩的胃黏膜多无Hp感染。本研究胃镜随访中检出的41例胃癌均非胃底腺癌,2例印戒细胞癌均在轻度组,表现为无萎缩或较小范围的萎缩。由此认为,即使是对于完全无萎缩和无Hp感染的患者,也不应否认胃镜随访的必要性。
我国人口基数庞大,内镜医师缺口也非常大,如果每例初次胃镜检查发现萎缩性胃炎的患者都每年复查一次,将大量占用真正需要接受内镜监测者的医疗资源。本研究分析显示,基于内镜下萎缩性胃炎分级可对患者进行胃癌风险分层,指导制订个体化的胃镜随访间期。内镜下萎缩性胃炎木村-竹本分类归入低危组的患者可考虑每2~3年进行一次胃镜随访。本组病例中低危患者占47.6%,这部分患者的胃镜随访间期如从1年调整至2~3年,可在不降低胃癌检出率的前提下,有效减少医疗机构和医保部门的负担,同时降低内镜检查并发症发生率。
