枣粉对陕北白绒山羊肉抗氧化性能的影响
2020-07-22孙旺斌薛瑞林
冯 平,孙旺斌,张 骞,薛瑞林,付 琪
(1. 榆林学院生命科学学院,榆林 719000;2. 榆林市佳县方塌镇瑞兴种羊场,榆林 719208)
0 引 言
陕北白绒山羊是肉绒兼用型品种,其肉质具有细嫩、口感好、高蛋白、低脂肪、低胆固醇等特点[1]。近年来随着生态环境的限制和羊肉需求量的增多,绒山羊养殖方式从传统的放牧转变为舍饲和半舍饲集约化养殖,但高密度的集约化养殖会造成绒山羊生长发育迟缓、免疫功能减弱,抗氧化能力低,从而导致羊肉品质下降。目前,通过营养调控提高羊肉的抗氧化能力,改善肉品质已成为一种重要的手段。许多学者进行相关研究,胡宇超等[2]发现发酵麸皮多糖能提高肉羊肌肉中调控抗氧化酶相关基因的表达量,可增强肌肉的抗氧化能力;Hukerdi 等[3]在羔羊饲粮中补充橄榄叶发现,随着橄榄叶水平的增加,羔羊肌肉中的脂质氧化程度降低,谷胱甘肽过氧化物酶(GSH-Px)活力增加;Adeyemi 等[4]发现棕榈油和菜籽油能提高山羊肌肉组织中的抗氧化物质,如α-生育酚和类胡萝卜素的含量;Deng 等[5]在湖羊的饲粮中添加紫苏籽,发现紫苏籽能降低背最长肌中丙二醛(Malondialdehyde,MDA)的含量,增加抗氧化酶活性,改善肌肉氧化状态和肉品质。但饲粮中添加枣粉改善山羊肉抗氧化性能方面的研究还比较少[6]。枣粉中含有丰富的多糖、皂甙、黄酮类等活性物质,是天然的抗氧化剂[7]。
鉴于此,本文以陕北白绒山羊为研究对象,旨在探讨饲粮添加枣粉对绒山羊肉色,脂质氧化,蛋白氧化状态、抗氧化系统和抗氧化酶基因的影响,明确枣粉在绒山羊饲粮中的适宜添加量,从而为指导生产高品质的绒山羊肉提供参考。
1 材料与方法
1.1 材料与试剂
从陕西省榆林市佳县瑞兴羊场选取舍饲条件下健康的6 月龄陕北白绒山羊(初始体质量(20.15±1.63)kg)40 只,按照每组8 只(公母各4 只)分成5 组,分别饲喂枣粉添加量为0(对照组)、10%(I 试验组)、15%(II 试验组)、20%(III 试验组)、25%(IV 试验组)的饲料,枣粉等比例代替基础日粮中的玉米秸秆,枣粉由当地同一批次的残次陕北红枣全枣加工而成,所用枣粉均为同一批次生产,枣粉的营养成分与抗氧化性能见表1。日粮参照配方配制并制成颗粒状,试验日粮组成见表2。每日饲喂两次,分别为08:00 和20:00,自由饮水,并定期清理羊舍。饲养试验预试期10 d,饲喂期70 d。饲喂试验结束后进行屠宰,宰前禁食24 h,禁水2 h,宰后1 h 内用已消毒剪刀迅速从羊背最长肌取约2 g 肌肉放入无菌无酶管中,于-80 ℃保藏待用,另各取约20 g 左右肌肉于-20 ℃保藏,进行肉色、脂质氧化和蛋白氧化指标测定。

表1 枣粉的营养成分与抗氧化性能 Table 1 Nutritional content and antioxidant capability of jujube power
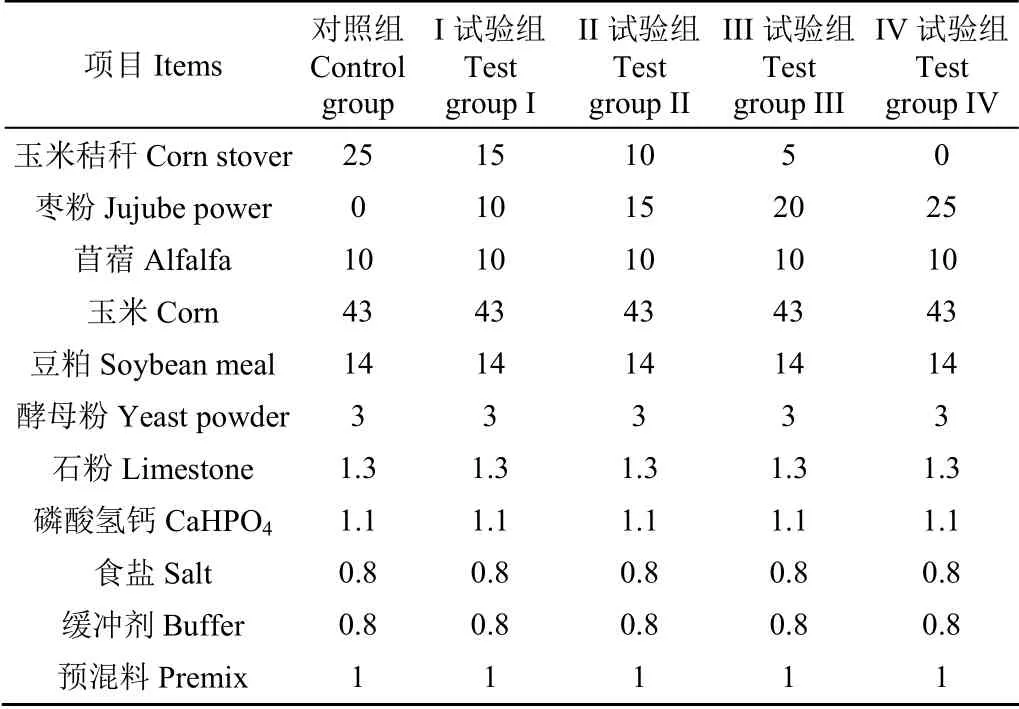
表2 日粮组成 Table 2 Dietary composition %
磷酸氢二钠、磷酸二氢钠、氯化钠(均为分析纯),北京国药试剂有限公司;超氧化物歧化酶(Superoxide Dismutase,SOD)试剂盒(检测范围:5.0~122.1 U/mg)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)试剂盒(检测范围:20.0~330.0 U/mg)、过氧化氢酶(Catalase,CAT)试剂盒(检测范围:0.2~24.8 U/mg)、丙二醛(Malondialdehyde,MDA)试剂盒(检测范围:0~113.0 nmol/mg)、总抗氧化能力(Total Antioxidant Capacity,T-AOC)试剂盒(检测范围:0.2~55.2 U/mg),南京建成生物工程研究所;2, 2-联氮基-双-(3-乙基苯并噻唑啉-6- 磺酸) 二铵盐( 2, 2'-Azino-Bis(3-Ethylbenzothiazoline-6-Sulfonic acid),ABTS),美国Amresco 公司;焦碳酸二乙酯,美国Thermo Fisher 公司;RNAiso Plus、6×loading buffer、Marker DL2000、Premix Taq®Version 2.0、PremeScript TM RT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTM,大连宝生物工程有限公司。
1.2 仪器与设备
XHF-DY 型高速分散器,宁波新芝生物科技股份有限公司;5810-R 型低温台式冷冻离心机,德国Eppendorf公司;TU-1810 型紫外/可见分光光度计,北京普析通用仪器有限公司;CR-400 型色差仪,日本柯尼卡美能达公司;电热恒温箱,上海一恒科学仪器有限公司;BG-power 5000 型稳压稳流电泳仪,北京百晶生物科技有限公司;水平电泳槽、凝胶成像分析仪、CFX96TM 型实时定量聚合酶链式反应(Real-time Quantitative Polymerase Chain Reaction,qPCR)仪,美国Bio-Rad 公司;普通PCR 仪,美国Applied Biosystems 公司。
1.3 方法
1.3.1 瘤胃降解率的测定
参照姜富贵等[8]的方法并稍作修改,对安装有永久性瘤胃瘘管的陕北白绒山羊进行营养物质48 h 瘤胃降解率的测定,计算试验羊的瘤胃的干物质消化率(Dry Matter Digestibility,DMD)和粗蛋白消化率(Crude Protein Digestibility,CPD),计算公式如下

1.3.2 生长性能测定
分别在试验开始和结束时对试验羊进行空腹称量,试验期间记录每次的投料量和料槽中剩余的料量,以计算每只羊每天的采食量。由此计算试验羊的平均日采食量(Average Daily Feed Intake,ADFI)、平均日增重(Average Daily Gain,ADG)和料肉比(Feed Conversion Ratio,FCR),计算公式如下

1.3.3 肉色的测定
用CR-400全自动色差仪测定绒山羊背最长肌的亮度(L*值)、红度(a*值)以及黄度(b*值),每个样品测定3 次,取平均值。
1.3.4 肌红蛋白含量的测定
参照罗玉龙等[9]的方法,切碎部分背最长肉样,称取5 g,按1∶9 g/mL 比例加入45 mL 磷酸盐缓冲液(40 mmol/L、pH 值6.8),4 000 r/min 冰浴匀浆20 s 后静置5 min 后过滤,在525 nm 波长下测定滤液的吸光度,空白对照为磷酸盐缓冲液。肌红蛋白(Myoglobin,Mb)质量分数(mg/g)按下式计算

式中7.6 为Mb 在波长525 nm 处的吸光系数,L/(mol·cm);1 cm 为比色皿宽度;17 000 为Mb 的平均分子质量,Da;10 为稀释倍数;A525为525 nm 波长下滤液的吸光度。
1.3.5 蛋白氧化状态的测定
参照Kim 等[10]的方法,称取已剪碎肉样5 g,按1∶5 g/mL 比例加入25 mL 磷酸盐缓冲液(40 mmol/L、pH值6.8),4 000 r/min 冰浴匀浆20 s 后静置1 h,混液离心25 min(4 ℃,3 000 r/min)后取上清液,滤纸过滤后收集滤液,分别在525、545、565、572 nm 波长下测定滤液的吸光度,结合Krzywicki[11]的方法分别计算出氧合肌红蛋白(Oxymyoglobin,OMb)和高铁肌红蛋白(Metmyoglobin,MMb)的相对含量(%),如下式所示

式中R1、R2、R3分别为572、565、545 nm 波长与525 nm波长处吸光度的比值。
1.3.6 抗氧化指标测定
将预冷的生理盐水漂洗绒山羊背最长肌,滤纸吸干表面水分后剪碎肉样,准确称取0.5 g 肉样,按1∶5 g/mL比例加入生理盐水,8 000 r/min 冰浴匀浆30 s,混液离心10 min(4 ℃,4 000 r/min)后取上清液,即得到10%的肌肉提取液。采用硫代巴比妥酸法测定组织中的丙二醛(Malondialdehyde,MDA)含量,采用比色法测定总抗氧化能力(Total Antioxidant Capacity,T-AOC),超氧化物歧化酶(Superoxide Dismutase,SOD),谷胱甘肽过氧化物酶(Glutathione Peroxidas,GSH-Px)和过氧化氢酶(Catalase、CAT)活力,所用试剂盒均购自南京建成生物工程研究所,测定时按试剂盒说明书进行操作。
1.3.7 自由基清除率的测定
参照Wen 等[12]的方法,并稍作修改。首先配制ABTS+自由基溶液,14 mmol/L 的ABTS 原液与2.45 mmol/L 的过硫酸钾等体积混合,在室温避光条件下反应16 h,将ABTS+自由基溶液用磷酸盐缓冲液(pH 值7.4)稀释,使其在30 ℃下,734 nm 波长处的吸光度为0.75±0.02,即得到ABTS+自由基工作液。取上述10%肌肉提取液50 μL加入试管中,再加6 mL ABTS+自由基工作液,空白管用去离子水代替样品溶液,30 ℃避光水浴6 min 后,在734 nm 波长处测定其吸光度。自由基清除率(Radical Scavenging Ability,RSA,%)计算公式为

式中A空白为空白溶液吸光度,A 为样品溶液吸光度。
1.3.8 基因表达量的测定
称取约100 mg 肉样,参照罗玉龙等[13]的方法提取肉样的总RNA,提取的RNA 通过琼脂糖凝胶电泳检测RNA 质量,并测定吸光度(A260nm/A280nm)及质量浓度。样品吸光度在1.8-2.2 之间可用于后续试验。将RNA 样品稀释至500 ng/μL 后反转录为cDNA,反转录方法参照试剂盒说明操作,反转录后的cDNA 于-80 ℃保存待用。以cDNA 为模板,参照试剂盒说明书,采用两步法测定SOD、CAT、GSH-Px、LOX 的mRNA 相对表达量。以18S 为管家基因,采用2-ΔΔCt法计算目的基因的相对表达量,SOD、CAT、GSH-Px、LOX、18S 引物由上海生工生物工程有限公司设计并合成,引物序列如表 3 所示。

表3 qPCR 引物 Table 3 Primers of qPCR
PCR 体系为:12.5 μL SYBR®Premix Ex Taq TMII(TLi RNaseH Plus),引物F 和R 各1.0 μL,2.0 μL cDNA模板,8.5 μL RNase Free dH2O。升温程序为:预变性95 ℃、30 s;变性95 ℃、5 s,退火60 ℃、30 s,延伸72 ℃、30 s,35 个循环;延伸72 ℃、10 min。
1.4 数据统计分析
用SPSS 20.0 软件对数据进行ANOVA 统计分析,采用双变量相关分析法(Pearson)对数据进行相关性分析,采用Excel 2003 软件进行图表处理。
2 结果与分析
2.1 不同枣粉添加水平对绒山羊瘤胃降解率及生长性能的影响
粗饲料DMD 和CPD 的瘤胃降解率是评价饲料可消化性的重要指标[14]。由表4 可知,II、III 和IV 组的干物质消化率显著高于对照组和I 组(P<0.05),并随着枣粉添加量提高,DMD 值逐渐增加,说明枣粉饲料能在瘤胃中被较好的降解利用。与对照组相比,II、III 和IV 组的平均日采食量(ADFI)和平均日增重(ADG)均显著增加(P<0.05),并且IV 组的料肉比显著高于对照组(P <0.05),由于枣粉中含有多糖、皂甙、黄酮类等活性物质,能改善饲料的适口性,从而利于白绒山羊生长性能的提高。

表4 枣粉对绒山羊瘤胃降解率及生长性能的影响 Table 4 Effects of jujube powder on rumen degradation rate and growth performance of Cashmere goat
2.2 不同枣粉添加水平对绒山羊肉色的影响
肉色是评定肌肉外观的重要指标,能反映肉质性状[15]。肉色的指标分别是L*、a*和b*值,其中L*代表亮度,与肌肉的光泽度有关;a*代表红度,肌红蛋白含量与a*有关,在一定范围内a*值越高,则肉色越好,b*值则代表黄度。由表5 可知,枣粉水平对绒山羊的肉色有显著影响,其中对照组的L*值(32.81)最低,随着枣粉水平的提高,L*值增加,与对照组相比,I、II、III、IV 组的L*值分别提高了14.29%、6.49%、17.25%和18.23%;b*值在II 组中最大,显著高于对照、I 和IV 组(P<0.05);对照组和I 组的a*值较低,显著低于II、III 和IV 组(P <0.05),III 组的a*值最高(20.62),表明枣粉水平为20%时,绒山羊的肉色较好。

表5 枣粉对绒山羊肉色的影响 Table 5 Effects of jujube powder on meat color of Cashmere goat
2.3 不同枣粉添加水平对绒山羊肉脂质氧化程度的影响
丙二醛(MDA)是组织内脂质氧化的终产物,其含量越高说明机体产生的过氧化脂质越多,氧化损伤就越严重[16]。由表6 可知,对照组、I 组的MDA 含量显著高于其他3 组(P<0.05),并随着枣粉水平提高,绒山羊肉中的丙二醛含量逐渐降低,在 IV 组中达到最低(1.788 nmol/mg),但与III 组(2.123 nmol/mg)没有显著差异(P>0.05)。脂质氧化能生成氢过氧化物、共轭二烯烃等,这些氧化产物有介导肌红蛋白氧化的能力,进而影响色泽。随着MDA 值的降低,a*值增加,说明a*值的变化可能是由脂质氧化驱动肌红蛋白氧化导致的[17]。枣粉水平能影响肌肉中丙二醛的含量,有效应对氧化应激,抑制组织内的氧化,其原因是枣粉中含有丰富的多糖、黄酮类物质,能及时清除组织中的自由基,抑制自由基诱导产生的氧化损伤[18]。
2.4 不同枣粉添加水平对绒山羊蛋白氧化状态的影响
肌红蛋白是红色素的主要成分,其含量及氧化还原状态与肉色密切相关[19]。由表6 可知,肌红蛋白(Mb)含量随枣粉水平的提高而增加,对照组的Mb 含量最低(7.85 mg/g),显著低于II、III 和IV 组(P<0.05)。III组的Mb 含量最高(11.48 mg/g),显著高于对照组、I和II 组(P<0.05),但与IV 组差异不显著(P>0.05),这与a*值的趋势一致,进一步印证了III 组肉色最好。枣粉中含有丰富的矿物质元素,羊摄食后,这些矿物质元素能参与组织中Mb 的合成,增加了Mb 的含量[20]。
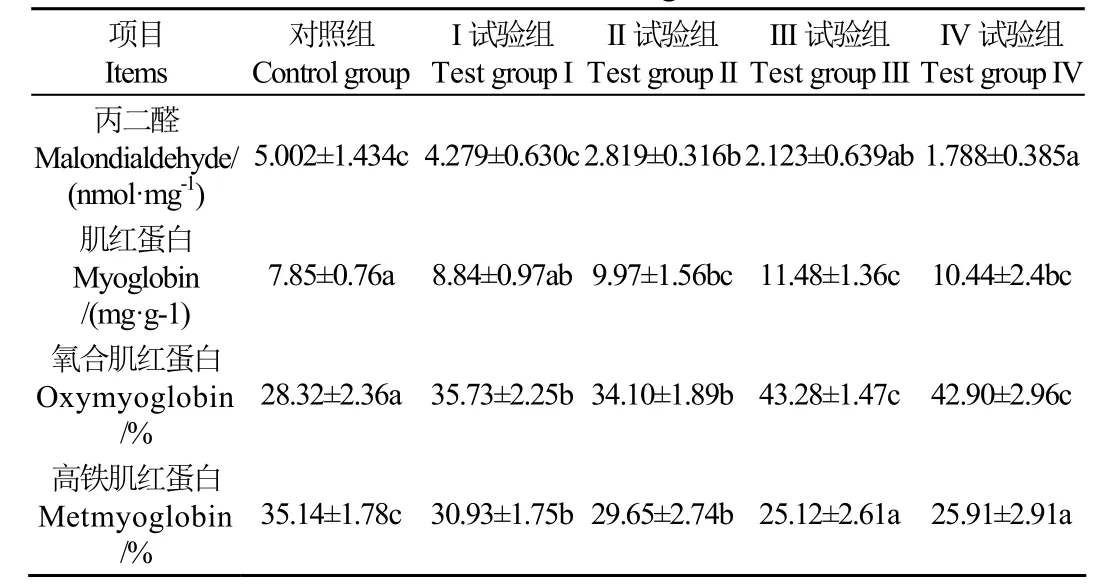
表6 枣粉对绒山羊肉脂质及蛋白氧化状态的影响 Table 6 Effects of jujube powder on lipid and myoglobin oxidation of Cashmere goat meat
肌红蛋白的氧化还原态包括鲜红色的氧合肌红蛋白(OMb)和褐色的高铁肌红蛋白(MMb),肉中OMb 越高,肉色越深,而MMb 含量高对肉色不利[21]。一般肉中的MMb 高于20%时,肉的红色逐渐变暗,达到50%时,肉呈现红褐色,若高于70%则肉变为褐色,失去销售价值。在表6 中,对照组的OMb 最低(28.32%),显著低于I、II、III 和IV 组(P<0.05),而MMb 最高(35.14%)。随着枣粉水平提高,绒山羊肉中的OMb 增加,而MMb减少,III、IV 组中OMb 的相对含量显著高于对照组、I和II 组(P<0.05),而MMb 含量显著低于对照组、I和II 组(P<0.05),两者呈相反的结果。III 组的OMb和MMb 的相对含量与IV 组没有显著差异,可以推断20%枣粉添加量能有效抑制蛋白氧化,防止肉色劣变。肌肉组织的内源抗氧化保护机制能在一定程度上防止蛋白质的氧化,在饲粮中添加枣粉能够增加抗氧化性能,影响绒山羊肉的OMb 和MMb 相对含量,进而改善肉色。
2.5 不同枣粉添加水平对绒山羊抗氧化能力的影响
动物组织中的抗氧化防御体系主要由酶系统和非酶系统组成,酶系统主要包括过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)等抗氧化酶;非酶系统主要包括维生素E、维生素C、胡萝卜素等抗氧化物质[22-23]。T-AOC 能衡量肉中总的抗氧化能力,RSA 则反映组织中所有抗氧化物质对自由基的清除能力。由表7 可知,对照组中总抗氧化能力(Total Antioxidant Capacity,T-AOC)(0.653 U/mg)和自由基清除率(Radical Scavenging Ability,RSA)值(17.421%)均为最低(P<0.05),随着枣粉添加量的提高,绒山羊肉中的T-AOC 和RSA 值均显著增加(P<0.05),IV 组中的T-AOC 和RSA 值最大,试验结果表明在饲粮中添加枣粉能显著提高肌肉的抗氧化能力。
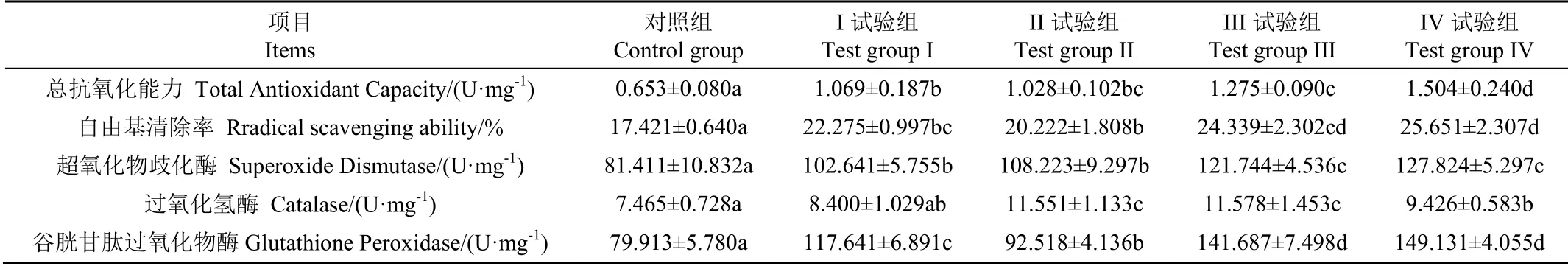
表7 枣粉对绒山羊肉抗氧化能力的影响 Table 7 Effects of jujube powder on antioxidant capacity of Cashmere goat meat
在抗氧化酶中,SOD 能清除组织内的自由基,产生H2O2和O2;CAT 广泛存在于动物组织中,能继续催化H2O2分解成H2O 和O2,清除细胞中的H2O2;GSH-Px 可直接清除组织和胞液内的脂质过氧化物,并与维生素E 协同作用阻止脂质过氧化[24-25]。由表7 可知,SOD 活力随枣粉水平的提高而增加,与对照组相比,I、II、III 和IV 组的SOD活力分别提高了26.08%、32.92%、48.90%和57.01%,均与对照组差异显著(P<0.05)。对照组的CAT 活力最低(7.465 U/mg),与对照组相比,I、II、III 和IV 组的CAT活力分别提高了12.53%、54.74%、55.10%和26.27%,CAT活力在III 组达到峰值(11.578 U/mg),显著高于对照组、I 和IV 组(P<0.05),这表明饲粮添加枣粉能提高肌肉的CAT 活力,但添加量并不是越高越好。随着枣粉水平的提高,肌肉中GSH-Px 活力增加,与对照组相比,I、II、III和IV组的GSH-Px活力分别提高了47.21%、15.73%、77.30%和86.62%,IV 组的GSH-Px 活力最高,显著高于对照组、I、和II 组(P<0.05),但与III 组差异不显著(P >0.05)。综合分析,III 和IV 组的抗氧化酶活力最高,说明20%和25%枣粉添加量能有效提高绒山羊肉的抗氧化酶活力,但两者部分指标差异不显著,因此可选20%枣粉添加量。
2.6 不同枣粉添加水平对绒山羊相关酶基因的影响
调控抗氧化酶的基因包括SOD、CAT 和GSH-Px 基因,这些基因的表达量的高低能反映抗氧化酶的活性[26];而脂氧合酶(Lipoxygenase,LOX)基因能调控LOX酶活性,并反映肉中MDA 含量。由表8 可知,对照组的SOD、CAT 和GSH-Px 基因表达量均最低(P<0.05),随着枣粉水平的提高,抗氧化酶的基因表达量增加,SOD 和GSH-Px 基因表达量增加趋势一致。III、IV 组的SOD、GSH-Px 基因表达量显著高于对照、I 和II 组(P<0.05);II、III 和IV 组的CAT 基因表达量显著高于对照组和I 组(P<0.05),这从分子水平上验证了饲粮中添加枣粉能提高绒山羊肉的的抗氧化能力。在肌肉组织中,LOX 催化生物膜中的不饱和脂肪酸发生氧化反应,生成脂质过氧化物后分解形成小分子物质,LOX 基因表达量越高,脂质氧化程度越高[27]。由表8可知,对照组和I 组的LOX 基因表达量显著高于II、III 和IV 组(P<0.05),在枣粉水平为20%和25%时,绒山羊肉中LOX 基因表达量最低(1.013 和1.083),说明枣粉抑制了LOX 基因的表达,改善了绒山羊肉的抗氧化性能。
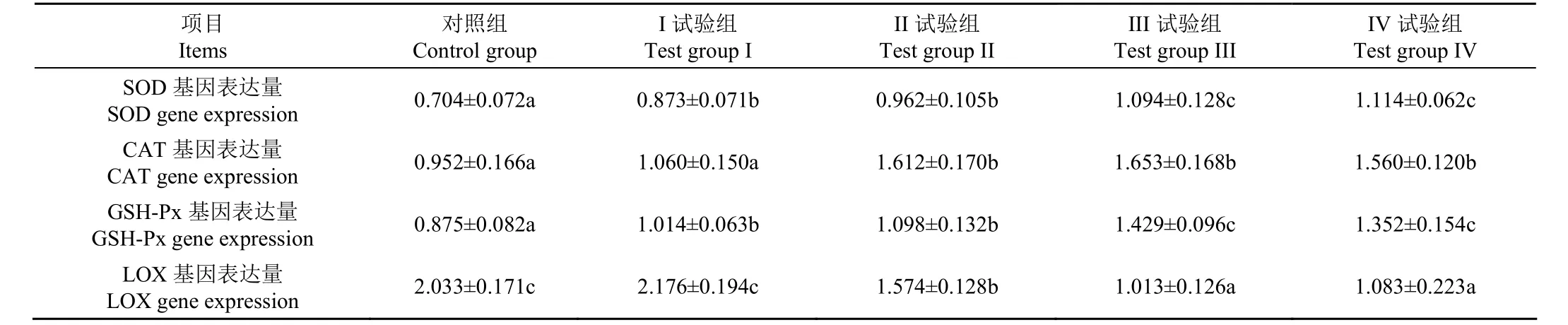
表8 枣粉对绒山羊相关酶基因表达量的影响 Table 8 Effects of jujube powder on related gene expression of Cashmere goat meat
2.7 抗氧化酶与酶基因表达量之间的相关性分析
绒山羊肉中抗氧化酶与酶基因的相关性分析见表9,SOD 基因表达量与SOD 酶活、CAT 酶活、GSH-Px 酶活之间呈极显著正相关(P<0.01),与MDA 呈极显著负相关(P<0.01),说明SOD 基因的高表达能提高SOD 酶活、CAT 酶活和GSH-Px 酶活,并抑制了组织中的MDA 含量。CAT 基因表达量与CAT 酶之间呈显著正相关(P <0.05),CAT 基因表达活跃时,CAT 酶活力随着增加,这更好地解释了肌肉中CAT 酶的活性依赖于基因表达调控[28]。GSH-Px基因表达量与SOD 酶活、GSH-Px 酶活之间呈极显著正相关(P<0.01)。在本研究中,枣粉能显著提高绒山羊肌肉中SOD、CAT 和GSH-Px 的基因表达量,并提高了抗氧化酶的活性,进而提高肌肉的抗氧化能力,这可能与枣粉中较高的多糖、黄酮类物质有关[29]。LOX 基因表达量与MDA呈极显著正相关(P<0.01),与SOD 酶活、CAT 酶活和GSH-Px 酶活之间呈极显著负相关(P<0.01)。
2.8 绒山羊肉中抗氧化指标的相关性分析
由表10 可知,绒山羊肉中SOD 酶与a*值呈显著正相关(P<0.05),Mb 与T-AOC、CAT 酶呈极显著正相关(P<0.01),OMb 与RSA、GSH-Px 呈极显著正相关(P<0.01),说明肉中的抗氧化酶能够影响肉的色泽,组织的抗氧化系统可协同作用清除自由基,影响Mb 的氧化状态,使OMb 的含量处于主导地位,进而改善肉色[30]。

表9 绒山羊肉中抗氧化酶与酶基因的相关性分析 Table 9 Correlation analysis between antioxidant enzyme and related gene of Cashmere goat meat

表10 绒山羊肉中抗氧化指标的相关性分析 Table 10 Correlation analysis of antioxidant parameters for Cashmere goat meat
MDA 与MMb 之间呈显著正相关(P<0.05),组织中的MDA 含量高时,能促进OMb 向MMb 转化,破坏肉色稳定性,使羊肉肉色发生劣变[16]。CAT 酶与SOD 酶呈显著正相关(P<0.05),与T-AOC 呈极显著正相关(P <0.01),GSH-Px 酶活力与RSA 呈极显著正相关(P <0.01),说明抗氧化酶之间能协同作用,并且组织中的非酶抗氧化物质能促进酶活力的提高,提高绒山羊肉的抗氧化能力[31]。寇涛等[32]发现添加二甲基甘氨酸钠后,鸡肉中的SOD 酶、GSH-Px 酶活力和T-AOC 值均增加,这与本试验的研究结果一致。羊肉中的MDA 含量与a*值呈显著负相关(P<0.05),与OMb 值呈极显著负相关(P<0.01),说明MDA 含量高能加速OMb 的氧化,促进MMb 含量生成,并造成a*值下降;本试验结果表明,T-AOC、CAT 酶与MMb之间呈极显著负相关(P<0.01);Xiao 等[33]和Zhou等[34]研究表明组织中抗氧化系统能抑制肌红蛋白氧化,降低MMb 的生成。本研究未对血液指标进行讨论,从肌肉组织角度可以推断饲粮中添加枣粉能通过增强山羊的抗氧化系统抑制肌红蛋白氧化来改善肉色;RSA、CAT 和GSH-Px 酶与MDA 呈显著负相关(P<0.05),SOD 酶与MDA 呈极显著负相关(P <0.01),机体中的抗氧化系统能发挥抗氧化作用,清除组织中的自由基,抑制脂质氧化,因此在饲粮中添加枣粉能够改善抗氧化性能,稳定肉色。
3 结 论
本研究通过饲粮中的不同枣粉水平(0,10%,15%,20%和25%)研究了陕北白绒山羊肉的抗氧化性能,具体如下:
1)枣粉提高了白绒山羊的瘤胃降解率和生长性能,其中15%、20%和25%添加组的干物质消化率、平均日采食量和平均日增重均显著高于对照组(P<0.05)。
2)枣粉改善了羊肉的肉色,20%枣粉水平时,羊肉的红度(a*)值(20.63)、肌红蛋白(Myoglobin,Mb)含量(11.48 mg/g)和氧合肌红蛋白(Oxymyoglobin,OMb)(43.28%)相对含量最高,高铁肌红蛋白(Metmyoglobin,MMb)(25.12%)相对含量最低,绒山羊肉的蛋白氧化程度低。
3)饲粮中添加枣粉能显著提高肌肉的抗氧化能力,20%和25%添加组的总抗氧化能力(Total Antioxidant Capacity,T-AOC)和自由基清除率(Radical Scavenging Ability,RSA)值显著高于对照组(P <0.05),20%添加组的超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)和谷胱甘肽过氧化物酶活(Glutathione Peroxidase,GSH-Px)均显著高于对照组(P <0.05);20%添加组的SOD、CAT 和GSH-Px 基因表达量显著高于对照组(P<0.05)。枣粉水平为20%时,抗氧化效果最好。综合上述指标,推荐20%为适宜的枣粉添加量。
