奶牛乳房炎大肠杆菌的分离鉴定及其主要毒力基因原核表达载体的构建
2020-07-21门倩云张勇李宗帅申玉龙李海江杨洋陈婷婷王琪赵兴绪
门倩云,张勇,李宗帅,申玉龙,李海江,杨洋,陈婷婷,王琪,赵兴绪
(甘肃农业大学动物医学院,甘肃 兰州 730070)
奶牛乳腺炎(Cowmastitis)是危害奶牛养殖业的三大疾病之一,主要由病原微生物引起[1].目前研究发现,引起奶牛乳房炎的病原微生物种类繁多,包括细菌、真菌、病毒、支原体等200多种,其中细菌感染占主要因素[2].金黄色葡萄球菌(Staphylococcusaureus)、链球菌(Streptococcus)和大肠杆菌(Escherichiacoli)是引起奶牛隐性乳房炎的3种主要细菌[3].其中大肠杆菌(E.coli)为埃希氏菌属(Escherichia)的代表菌,被认为是临床型奶牛乳房炎的首要致病菌,广泛存在外界环境中,可通过多种途径侵入奶牛的乳房组织,引发炎症反应而导致奶牛乳房炎.大肠杆菌具有很多毒力因子[4-5],包括毒素基因、毒力岛基因、粘附素基因、溶血素基因、外膜蛋白基因等.这些毒力因子帮助大肠杆菌在机体内完成了寄居、繁殖、致病的过程.大肠杆菌的致病性与携带的这些毒力基因有关[6-7].
大肠杆菌外膜蛋白不仅是一种结构蛋白,而且是大肠杆菌的一种重要的毒力因子.外膜蛋白可作为免疫过程中的保护性抗原,可以帮助细菌抵抗宿主免疫流行性疾病,影响大肠杆菌侵入人体的过程.外膜蛋白基因选作制作亚单位疫苗的研究被很多学者认为很有前景.fimH所编码的fimH蛋白即菌毛黏附素是大肠杆菌常见的一种定居因子,能够与甘露醇蛋白受体结合介导细菌与宿主细胞黏附.因此此定居因子具有较强的免疫原性,能刺激机体产生特异性抗体.trat蛋白是细胞外膜上的一种脂蛋白,被认为在血清抵抗中起作用.trat蛋白不仅与表面清除有关,因为它位于细菌的外膜上,当trat蛋白过度表达时,它会与调理素结合,并与细菌和病毒抗原结合,促进宿主巨噬细胞的吞噬作用[8],可作为研究的候选基因.本研究对张掖地区47份罹患乳房炎奶样进行了大肠杆菌的分离鉴定,药敏试验,分析其耐药性,检测其所携带的毒力基因,并选取fimH,OmpF,trat,OmpC基因构建原核表达载体,为后续制作张掖地区奶牛乳房炎大肠杆菌亚单位疫苗提供了生物素材.
1 材料与方法
1.1 材料
1.1.1 主要仪器 电子天平,超净工作台(美国,THERMO),恒温培养箱(上海一恒科技有限公司),正置光学显微镜(日本,OLYMPUS),PCR扩增仪(美国,BIO-RAD),凝胶成像系统(美国,BIO-RAD),Eppendorf 5417离心机(Eppendorf,德国),DYY-12型电脑三恒多用电泳仪与DYCP-31A型电泳槽(北京六一仪器厂).
1.1.2 主要试剂 革兰氏染色液、大肠杆菌生化鉴定管、LB培养液、MH-A琼脂、伊红美兰琼脂、麦康凯琼脂,营养肉汤琼脂培养基等购自青岛海博生物技术有限公司,无菌脱纤维绵羊血购自北京索莱宝生物科技有限公司,细菌药敏片购自杭州滨和微生物试剂有限公司、细菌DNA提取试剂盒购自天根生化科技(北京)有限公司、 PCR产物纯化试剂盒和胶回收试剂盒购自OMEGA公司,质粒提取试剂盒购自北京康为世纪生物科技有限公司, 2×EasyTaq PCR SuperMix(+dye)、 2000 DNA Marker、 8K DNA Marker、 DH5α购自北京全式金生物技术有限公司,高保真DNA聚合酶购自南京诺唯赞生物科技有限公司,HindⅢ-HF (R3104V)、BamHⅠ-HF (R3136S)内切酶购自 NEBiolabs(北京), PET32a(+)质粒为本实验室保存,引物由兰州天启基因生物科技有限公司和天津金唯智生物科技有限公司合成.
1.2 试验方法
1.2.1 乳样的采集 用乳汁体细胞检测法检测了张掖地区8个牛场罹患隐性乳房炎的22头牛,用毛巾清洁乳头及周边组织,依次用碘酊和75%酒精消毒,弃前3把乳汁,收集乳样5~10 mL离心管中,封口膜封口冰浴运回实验室,共采集到47份乳样.
1.2.2 细菌的分离培养及形态学观察 将奶样接种于伊红美兰培养基和麦康凯培养基进行分离培养.将分离得到的疑似大肠杆菌在普通培养基进行培养后分别接种至盛有10 mL普通营养肉汤的冻存管中置于37 ℃热恒温摇床上24 h进行增菌并编号记录D1, D2, D3, D4,…,共24株.挑选特征符合的单菌落进行革兰氏染色,镜检,革兰氏阴性短杆菌者为疑似菌株,进行后续的生化鉴定.
1.2.3 大肠杆菌的生化鉴定 革兰氏染色后,经油镜镜检为革兰氏阴性的小杆菌纯化培养,将纯化后的大肠杆菌菌株用无菌接种环移取少许纯培养物,接种于细菌微量生化反应管中,放入37℃恒温培养箱培养,生化试验按《伯杰氏鉴定细菌学手册》与《伯杰氏分类细菌学手册》方法进行[9],鉴定各种反应所需时间,观察结果,查看生化反应管中培养基颜色变化情况或者生化反应管中是否有气泡产生[10].其中包括溶血试验,糖发酵(葡萄糖/乳糖/蔗糖/甘露醇)试验,枸橼酸盐利用试验,三糖铁试验,MR/V-P试验,吲哚试验[11-13].
1.2.4 大肠杆菌的16 S rRNA鉴定 根据已发表的大肠杆菌16S~32S rRNA基因保守序列设计合成了引物[12],上游5′-AGAGTTTGATCCTGGCTCAG-3′,下游5′-TACGGCTACCTTGTTACGAC TT-3′;提取菌落形态、镜检结果符合大肠杆菌特征、生化鉴定结果为疑似的菌株基因组DNA,以其作为模板进行PCR扩增,扩增产物送兰州天启基因生物科技有限公司测序.测序结果在NCBI中用BLAST程序进行比对(http://www.ncbi.nlm.nih.gov/BLAST).
1.2.5 药物敏感性试验 采用纸片扩散法(Kirby-Bauer)对大肠杆菌进行药敏试验.用无菌接种环蘸取大肠杆菌新鲜菌落,用无菌生理盐水稀释成0.5麦氏比浊度(1.5×108CFU/mL)的大肠杆菌菌液.移液枪吸取100 μL轻轻涂抹于MH琼脂平皿表面.平皿于超净工作台中静置3~5 min,使其表面菌液晾干,用无菌的镊子将药敏纸片放置于平皿表面并轻轻按压.每个平皿放4种药敏纸片,每株菌设3个平行.将平皿倒置于37 ℃恒温培养箱培养18~24 h,最后用游标卡尺测量抑菌圈的直径大小,记录结果.结果判定:按照美国临床实验标准委员会标准(CLSI),通过抑菌圈直径的大小判定大肠杆菌对抗生素的敏感性.分为耐药(R)、中介(I)和敏感(S).
1.2.6 大肠杆菌毒力基因的检测 采用PCR技术,以24株大肠杆菌为研究对象,检测引物参照文献[14-16]合成毒力基因检测引物,检测其23种毒力因子(F17A,papC,sfaDE,fimH,afaD-8,STb,LT1,stx1,stx2,cnf1,cnf2,iucD,colV,hlyA,OmpC,OmpF,ECs3703,irp2,fyuA,eaeA,ler,afaE-8,trat).PCR扩增条件: 95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34个循环;72 ℃终延伸10 min.扩增体系:上下游引物各1 μL,DNA模板1 μL,2×Easy Taq PCR Super Mix酶10 μL,双蒸水8 μL.PCR产物在含1%的琼脂糖进行电泳,用凝胶成像系统采集和保存图像.
1.2.7 大肠杆菌主要毒力基因原核表达载体的构建 引物设计与合成:针对分离的24株大肠杆菌检测到的主要毒力基因fimH、OmpF、trat和OmpC,根据GenBank已经公布的它们的序列(fimH基因,序列号:AY392522.1;OmpF基因,序列号:CP046006.1;trat基因,序列号:MK878890.1和OmpC基因,序列号:CP016182.2),利用Snapgene软件设计引物并加入BamH Ⅰ-HF(AAGCTT)、HindⅢ-HF(GGATCC)酶切位点设计引物(表1),引物由兰州天启基因生物科技有限公司合成.

表1 扩增全长的目的基因引物序列信息
1.2.8 大肠杆菌trat,OmpF,OmpC和fimH基因全序列扩增和重组质粒构建 以分离鉴定的大肠杆菌DNA为模板,扩增trat,OmpF,OmpC,fimH基因的全长序列.扩增体系(50 μL)如下:25 μL高保真DNA聚合酶,上下游引物各1 μL,模板1 μL,双蒸水22 μL.扩增条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34个循环;72 ℃终延伸10 min结束反应.PCR扩增完成后,产物经含1%的琼脂糖凝胶电泳回收,将回收产物和 PET32a(+)质粒进行双酶切,体系(50 μL)如下:BamH Ⅰ-HF酶1 μL、Hind Ⅲ-HF酶1 μL,纯化后目的产物25 μL,Cut Buffer 5 μL,双蒸水18 μL,在37 ℃双酶切2 h,双酶切产物回收纯化后经T4 DNA Ligase连接,连接体系(20 μL),T4DNA Ligase 1 μL,10×Ligase Buffer 2 μL,目的基因载体共5 μL,其中目的基因与载体比例为1∶3,双蒸水12 μL,在16 ℃连接3 h,将连接产物转化至DH5α感受态细胞中,并均匀涂在含AMP+(100 mg/mL)的LB琼脂培养基上,37 ℃恒温培养16~18 h,利用PET32a(+)通用引物T7/T7-ter验证阳性菌.阳性菌增菌培养后提取质粒并经双酶切鉴定正确后送天津金唯智生物有限公司测序,扩全序列基因引物和验证阳性菌引物(表1).重组质粒分别命名为PET-32a-fimH、 PET-32a-OmpF、 PET-32a-trat和 PET-32a-OmpC.
2 结果与分析
2.1 细菌分离纯化培养及形态学观察
本试验菌株在麦康凯培养基(图1-A)上生长出粉红色的单一菌落;在伊红美兰培养基(图1-B)上长出黑色带金属光泽的单一菌.在普通培养基(图1-C)上长出无色单一的菌落,边缘整齐、稍凸起、光滑并兼湿润;革兰氏染色镜检(图1-D)为粉红色、短杆状、两端钝圆.

A:麦康凯培养基菌落形态;B:伊红美兰培养基菌落形态;C:普通培养基菌落形态;D:大肠杆菌革兰氏染色.A:Colony morphology of Mac Conkey medium;B:Colony morphology of eosin methylene blue medium;C:Colony morphology of common medium;D:Gram chromatogram of E.coli图1 大肠杆菌鉴定Figure 1 Identification of Escherichia coli
2.2 生化试验结果
菌株经生化鉴定大肠杆菌均能发酵葡萄糖、乳糖、蔗糖和甘露醇产酸并产气;三糖铁试验变黄;吲哚试验阳性、 MR试验阳性, V-P试验阴性、枸橼酸盐利用阴性结果见(表2),表中(+为阳性反应;-为阴性反应;⊕为产酸产气).由生化鉴定结果(图2)可知本试验分离菌株的生化特性与肠杆菌科细菌生化鉴定结果基本保持一致.但有部分菌株在 M R试验中产生阴性反应,在糖酵解反应时有的菌株只产酸不产气或既不产气也不产酸.

表2 生化鉴定结果分析
2.3 部分大肠杆菌16S r RNA鉴定
大肠杆菌生化鉴定试验结果中并不是每个菌株都符合大肠杆菌标准的试验结果(图3),从生化鉴定试验不完全符合标准的菌株中挑选了7株和符合大肠杆菌标准的1株进行测序,测序结果在blast进行序列比对,比对结果证明这8株都是大肠杆菌.
2.4 药物敏感性试验结果
对分离的24株大肠杆菌进行药敏试验,结果分析(图4):分离出的大肠杆菌对头孢西丁、多粘菌素B、阿米卡星、头孢曲松和妥布霉素高度敏感;对头孢吡肟、头孢噻吩、复方新诺明、氨曲南、头孢噻肟和链霉素处于中介,对头孢哌酮、头孢吡肟、头孢他啶、哌拉西林、庆大霉素、氧氟沙星和头孢曲松处于多重耐药,对头孢唑啉、卡那霉素、氨苄西林和头孢呋辛四种抗生素无明显现象.

图2 部分菌株生化鉴定Figure 2 Biochemical identification of some strains

M:DL2000;1~8:D1,D2,D3,D4,D5,D6,D7,D8.M:DL2000;1~8:D1,D2,D3,D4,D5,D6,D7,D8.图3 部分菌株16 S rRNA扩增结果Figure 3 Partial results of 16 S rRNA amplification
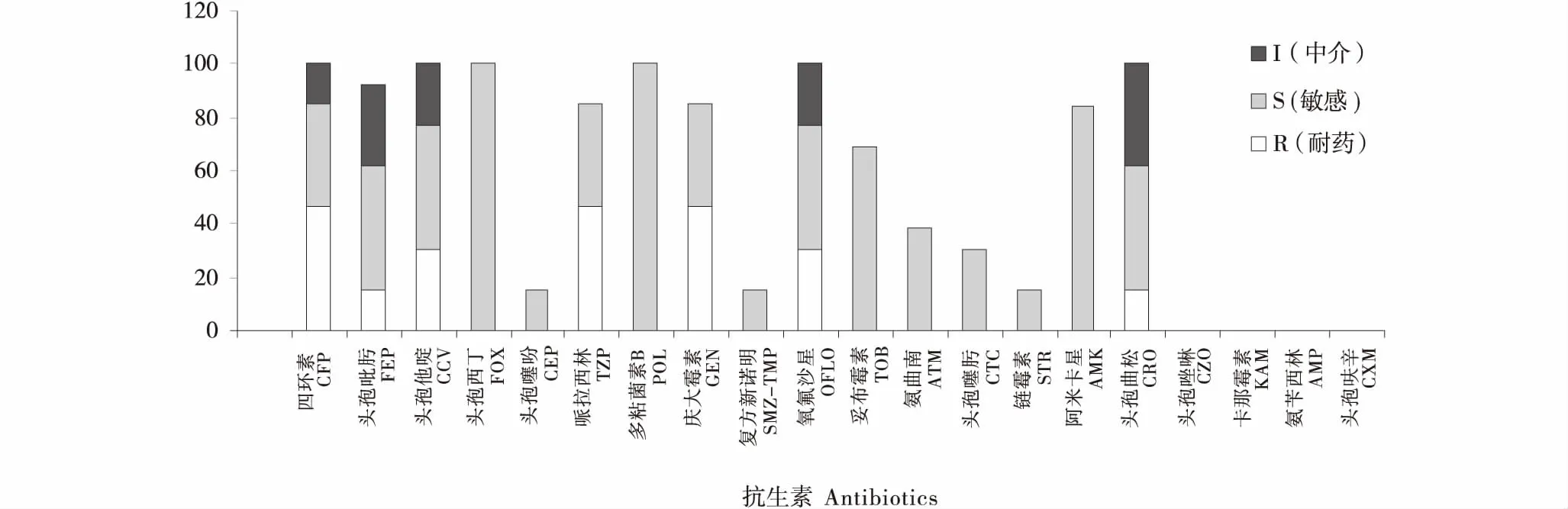
图4 药敏结果分析Figure 4 Analysis of drug sensitivity result
2.5 大肠杆菌毒力基因检测结果
通过PCR对23种毒力基因进行检测,结果发现(图5):iucD,OmpC,trat,ECs3703和OmpF的检出率为100%, 的检出率为96.15%,colv的检出率为7.69%,cnf1的检出率为4.34%,flyvA,STb,irp2,sfadE,cnf2,LT1,sfaDE,ler,afaD-8,afaE-8,eaeA,stx2,hlyA,F-17A和stx1均未检出.
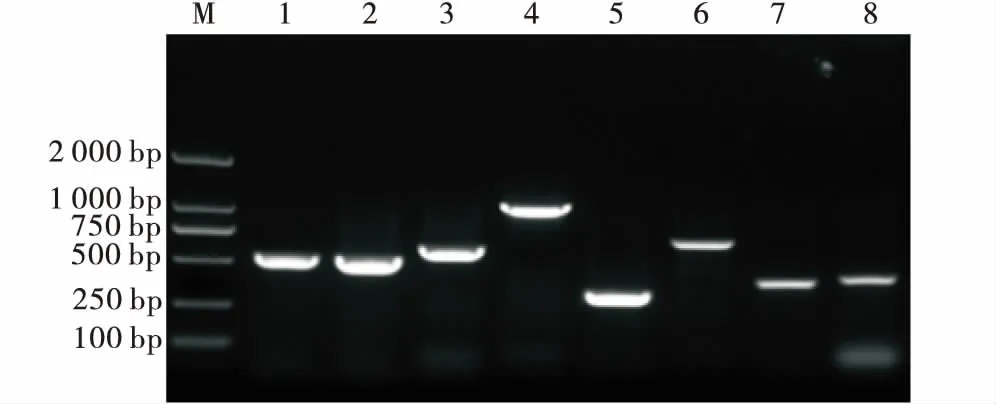
M:DL2000;1~8:fimH,Cnf1,iucD,OmpC,trat,ECs3703,OmpF,colv.M:DL2000;1~8:fimH,Cnf1,iucD,OmpC,trat,ECs3703,OmpF,colv.图5 毒力基因PCR检测结果Figure 5 PCR results of virulence gene
2.6 大肠杆菌trat,OmpF,OmpC和fimH基因全序列扩增结果
本试验以提取的大肠杆菌基因组DNA为模板,PCR扩增trat,OmpF,OmpC和fimH基因的全序列并回收,PCR回收产物用1%琼脂糖凝胶电泳检测.结果显示,PCR扩增产物在750 bp和1 000 bp左右处有清晰明亮的DNA单一条带(图6),与预期trat,OmpF,OmpC和fimH基因的全序列大小(732,1 074,1 104,903 bp)大致符合,经克隆测序比对,结果是大肠杆菌的trat,OmpF,OmpC和fimH基因的全序列.
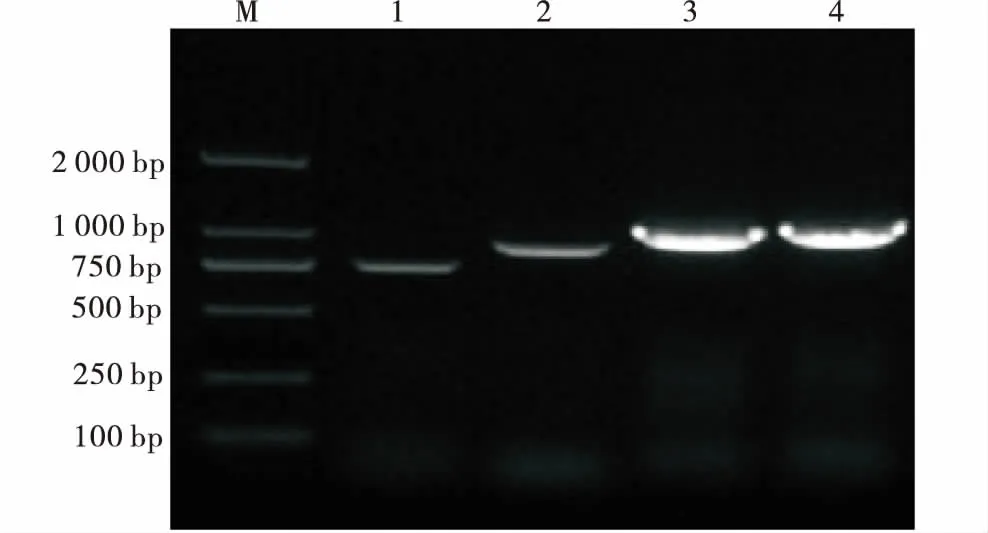
M:DL2000;1:trat;2:fimH;OmpF;OmpC.图6 目的基因PCR扩增Figure 6 PCR amplification of the target gene
2.7 重组PET-32a-fimH、 PT-32a-OmpF、 PET-32a-trat和PET-32a-OmpC质粒的双酶切鉴定结果
用BamH Ⅰ-HF和HindⅢ-HF在37 ℃双酶切2 h后,用1%的琼脂糖凝胶电泳检测酶切产物,结果显示,重组质粒比原质粒PET-32a(+)略大(图7),且在1 000 bp以下、略大于1 000 bp和5 000 bp左右有特异性的2条带,比较低的一条带与预期trat,OmpF,OmpC和fimH基因的大小(732,1 074,1 104,903 bp)大致符合,经天津金唯智生物工程有限公司测序,在PET-32a(+)载体的多克隆位点出现fimH、OmpF、trat和OmpC目的基因序列,将测序结果在BLAST与大肠杆菌的fimH基因(序列号:AY392522.1)、OmpF基因(序列号:CP051219.1)、trat基因(序列号:MK878890.1)和OmpC基因(序列号:CP016182.2)进行同源性比对,结果显示同源性为100%且未发生一个碱基突变,说明重组质粒构建成功.

A:fimH的双酶切鉴定;B:OmpF的双酶切鉴定;C:trat的双酶切鉴定;D:OmpC的双酶切鉴定;M:Marker;1:PET32a;2:重组质粒双酶切.A:PET32a-fimH by dual-enzyme digestion;B:PET32a-OmpF by dual-enzyme digestion;C:PET32a-trat by dual-enzyme digestion;D:PET32a-OmpC by dual-enzyme digestion.M:Marker 1:PET32a;2:Double enzyme digestion of recombinant plasmid.图7 双酶切鉴定Figure 7 Double digestion verification
3 讨论
奶牛乳房炎是影响奶牛生产性能的重要群发普通疾病之一,在其众多致病菌中大肠杆菌是临床型奶牛乳房炎中分离率高居首位的细菌[17-18].本试验分离出的菌落形态和镜检结果符合大肠杆菌的菌株生物特性的菌株,经溶血试验检测均为β溶血.生化鉴定中有部分菌株在甲基红试验中产生阴性反应,在糖酵解反应时只产气不产酸或只产酸不产气,但将这几株不完全符合大肠杆菌生化鉴定标准的菌株进行16S rRNA测序鉴定结果均为大肠杆菌.因此我们可以利用细菌的保守区域16S rRNA,通过基因分析来鉴定细菌的种属,判断细菌的变异情况,为疾病的防控提供更加详细的分子生物信息.药敏试验结果显示:分离的24株大肠杆菌对20种抗生素的敏感度试验中,其中24株对头孢西丁和多贴菌素B十分敏感,其中20株对阿米卡星高度敏感、17株对妥布霉素物高度敏感,11株大肠杆菌对庆大霉素和氧氟沙星表现出多重耐药现象,这与文献报告十分相似[14].奶牛乳房炎的病原菌一般具有地域性,不同地区分离菌株对抗生素的敏感性跟耐药性也会有差异.因此本试验药敏结果对张掖地区部分奶牛场患乳房炎的奶牛的临床用药也具有一定的参考意义.
有研究发现,细菌缺乏致病性,通常与E.coli的毒力相关.毒力与毒力基因存在必要的相对应性,毒力基因是致病菌的致病性和代谢活性相互依赖的表达[19].在不同菌株之间观察到的致病性差异可能与大肠杆菌的毒力基因和奶牛个体相关,本试验所检测的毒力基因iucD,OmpC,trat,ECs3703和OmpF的检出率为100%,fimH的检出率为96.15%,colV的检出率为7.69%,cnf1的检出率4.34%,这些毒力基因在分离的菌株中部分或全部被检测到.张泽辉在辽宁地区乳房炎源大肠杆菌毒力基因进行筛选时,其主要流行的毒力基因为OmpC(100%),fimH(89.9%),ECs3703(88.6%),OmpF(73.4%)[19],这一结果与本试验基因检测率相似,均有较高的检测率,这可能与菌属的基因型有关,推测两地区大肠杆菌的基因型表现出高度相似.在普通大肠杆菌和致病性大肠杆菌以及其他肠道细菌中发现的最常见的粘附素是1型菌毛fimH基因,它们对生物膜的形成有影响.这一发现与本试验的结果一致,fimH基因在所分离出的菌株中有很高的检测率.
外膜蛋白对细菌抵抗有害物质或不利环境起着重要作用,它能够保护细菌细胞免受或减少多种有害物质的影响,外膜蛋白形成的非特异性的离子通道对革兰氏阴性细菌吸收营养物质和排泄自身代谢废物也起着关键作用[18].本试验检测出的大肠杆菌的外膜蛋白OmpC、OmpF可作为后期亚单位疫苗的候选蛋白,并具有很大的产品化潜力.fimH蛋白即菌毛黏附素是具有较强的免疫原性,能刺激机体产生特异性抗体[16].trat基因也编码外膜蛋白,被认为在血清抵抗中起作用[20],也可以作为候选蛋白.本试验选择fimH,OmpF,trat和OmpC基因成功构建原核表达载体,为进一步研发奶牛乳房炎大肠杆菌亚单位基因工程疫苗提供了生物素材,有一定的临床应用前景.
4 结论
1) 本试验成功从张掖地区奶牛场采集的47份乳样中分离并鉴定出24株大肠杆菌,大肠杆菌也是该地区奶牛乳房炎感染的优势菌群.
2) 药敏结果建议头孢西丁、多贴菌素B、阿米卡星和妥布霉素这四种药可作为张掖地区治疗奶牛乳房炎的首选抗生素药物.
3) 本试验对大肠杆菌的23种毒力基因进行了检测,检出率分别为OmpC(100%),OmpF(100%),iucD(100%),ECs3703(100%),trat(100%),fimH(96.15%),colv(7.69%)和cnf1(4.34%).
4) 成功克隆了大肠杆菌的trat、fimH、OmpF和OmpC基因,构建了PET-32a-fimH、PET-32a-OmpF、PET-32a-trat和PET-32a-OmpC原核表达载体.
