MIL-101的制备及其VOCs吸附性能研究
2020-07-21朱文健刘建峰胡小才袁爱华陈海丰
朱文健,刘建峰,胡小才,杨 振,袁爱华,陈海丰,唐 盛
(1.江苏科技大学 冶金与材料工程学院,张家港 215600) (2.上海外高桥造船有限公司, 上海 200120) (3.江苏科技大学 环境与化学工程学院,镇江 212003) (4.江苏科技大学 海洋装备研究院,镇江 212003)
在工业生产中存在着严重的空气污染问题,其中PM2.5和臭氧的前体物——挥发性有机化合物(volatile organic compounds, VOCs)的排放不仅会造成环境污染,而且会对周边人群和生物健康产生危害,因此已引起社会的高度重视.目前,工业VOCs的治理普遍采用活性炭吸附浓缩+催化燃烧工艺,但活性炭具有吸附容量小、吸附位点易失活等缺点.随着最新环保法的实施,国家对VOCs的排放要求越来越严格,传统的活性炭吸附材料已难以满足企业VOCs治理并达标排放的标准,因此,寻找新型吸附剂并实现其商业化应用是当前研究热点[1].金属有机框架(metal-organic frameworks,MOFs)因具有化学结构可调、高孔体积和比表面积大等优点,已成为当前最具应用前景的新型气体吸附材料[2].MOFs与VOCs之间的吸附机制主要依靠物理填孔作用,其吸附效果与吸附剂及吸附物质的几何形状和外层电子性质有关.制备经济性、高吸附性和潜在工业应用价值的MOFs材料是当前的研究热点[3].
MIL-101最早由法国Ferey课题组率先合成,它在气体吸附和催化方面具有较好的应用前景.目前,有关MIL-101大多采用氢氟酸为添加剂制得,且很少能够达到3 100 m2/g的BET比表面积,文献报道的MIL-101比表面积大多在2 200 m2/g左右.研究表明,在合成过程中以氢氟酸为添加剂时,反应温度会对MIL-101的结晶度和吸附性能有较大影响.文献[4]发现,用氢氟酸为添加剂在170~200 ℃制备的MIL-101结晶度低于220 ℃[4];文献[5]在220 ℃制备的MIL-101对苯、甲苯的吸附性能达到1 000 mg/g左右;文献[6]用210 ℃制备的MIL-101对苯的吸附性能仅有103.4 mg/g;文献[7]在200 ℃制备的材料常温下对甲苯和甲醇的吸附量仅有0.53和1.47 mmol/g.利用氢氟酸做添加剂,在制备后期需要经过繁琐的活化处理过程除去杂质,这种制备方法不仅耗材、耗时、耗能,而且由于氢氟酸的特殊化学性,不利于工业应用推广,因此找出能够代替氢氟酸的添加剂,合成温度低,同时具有较好VOCs吸附性能的材料对实际的工业应用推广具有重要意义.用醋酸钠代替氢氟酸作为添加剂能增强对苯二甲酸的溶解能力,在较低温度下不经过后续纯化处理即可获得孔道干净的MIL-101.目前,仅考察了用醋酸钠法制备的MIL-101 CO的有关性能,与用传统方法制备的MIL-101在VOCs吸附性能的对比未见报道.
文中以醋酸钠为添加剂,在180 ℃通过水热法制备金属有机框架MIL-101,利用扫描电镜(SEM)、X射线衍射仪(XRD)、比表面测试仪等对合成的产物进行表征,通过静态吸附法研究其VOCs吸附性能,与在220、210和200 ℃以氢氟酸为添加剂制备的MIL-101和商业用活性炭的吸附性能进行对比研究,并讨论其他气体对水的吸附选择以及气体吸附循环表现.
1 实验
1.1 MIL-101的合成及纯化处理
合成所用药品和试剂均为购买的分析纯,使用时未作进一步提纯,所用水为去离子水.
称取4.001 5 g Cr(NO3)3·9H2O和1.661 3 g H2BDC于100 mL烧杯中,取54 mL去离子水倒入烧杯,再加入0.461 4 g无水醋酸钠,常温搅拌1 h.将溶液倒入反应釜中,180 ℃下反应28 h,自然冷却到室温,过滤,水洗3遍,所得绿色粉末即为MIL-101,将产物放入烘箱,150 ℃烘干1 h.
对干燥后的产物进行纯化处理来去除反应时的溶剂.将产物置于圆底烧瓶并浸泡在DMF中(每克粉末对应50 mL DMF),在60 ℃下冷凝回流3 h,冷却过滤,放入烘箱,100 ℃烘干1 h以上。接着,再用无水乙醇100 mL在60 ℃下冷凝回流10 h,过滤后将粉末放入真空干燥箱60 ℃过夜干燥,最后所得墨绿色粉末即为纯化的MIL-101.
1.2 结构表征
样品的微观形貌用Merlin Compact场发射扫描电镜(德国蔡司)观察.采用XRD-6000型粉末X射线衍射仪(日本岛津)进行物相表征,电压为40 kV,电流为35 mA,测试角度为5 °~20°,扫描速率为3°/min,连续扫描.红外谱图采用傅立叶变换红外光谱仪(美国安捷伦公司)测试,用溴化钾压片法制备样品,记录波数400~4 000 cm-1.热重分析用热重分析仪(美国PerkinElmer公司)在N2下从室温升高至800 ℃进行测定.比表面积和孔径分析采用BELsorp-MAX仪器(日本麦奇克拜尔有限公司)测试,测试前样品在150 ℃真空活化12 h,测试范围0~1 MPa,测试温度为77 K,N2纯度为99.99 %。根据得到的N2吸附曲线进行孔结构和比表面积分析:用相对压力0.05~0.35处的吸附数据(BET方法)计算样品的比表面积,用相对压力0.99处的吸附数据计算样品的孔体积.
1.3 VOCs静态吸附测试和疏水性测试
VOCs的吸附等温线由BELsorp-MAX型吸附仪测试,采用静态吸附法进行测试.称取30~50 mg样品,装入试管后在150 ℃进行12 h的真空脱气活化处理,预处理完成后,称取并记录样品管和样品的质量.通过前后两次的质量计算最后有效样品的质量.将预处理好的样品移至蒸汽吸附端进行等温测量.吸附环境温度由自带循环恒温装置的杜瓦瓶提供,吸附气体源由苯、甲醇、甲苯、水的市售液体在50 ℃自然挥发.
2 结果与分析
2.1 X射线衍射及扫描电镜分析
图1为经过DMF和乙醇纯化后的MIL-101的XRD谱图.从图中可以看出,MIL-101在5.2°、8.5°、9.1°处出现明显的特征峰,与MIL-101的XRD标准谱图一致,且在17.5°处没有明显的对苯二甲酸峰,说明所得MIL-101纯度较高,后期纯化去除了未反应的对苯二甲酸[8].图2为MIL-101的SEM图,从图中可以看出,所得MIL-101为八面体形貌,粒径约为500 nm.
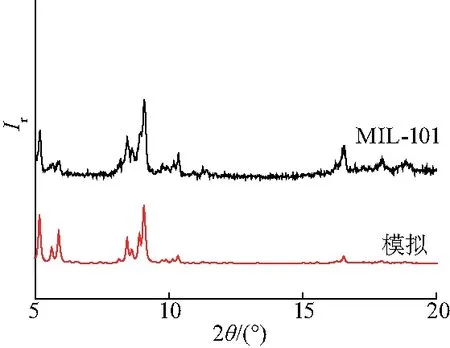
图1 MIL-101的粉末X射线衍射图Fig.1 X ray diffraction patterns of MIL-101

图2 MIL-101的SEM图Fig.2 SEM image of MIL-101
2.2 红外光谱分析
图3是MIL-101的红外光谱图,在1 624和1 400 cm-1处的吸收峰可归因于O-C-O骨架结构的吸收振动,表明样品中存在二羧酸有机骨架;1 017和750 cm-1处的吸收峰由苯环骨架振动引起;600 cm-1附近的吸收峰可能由COO-基团的面内、面外弯曲引起[9].
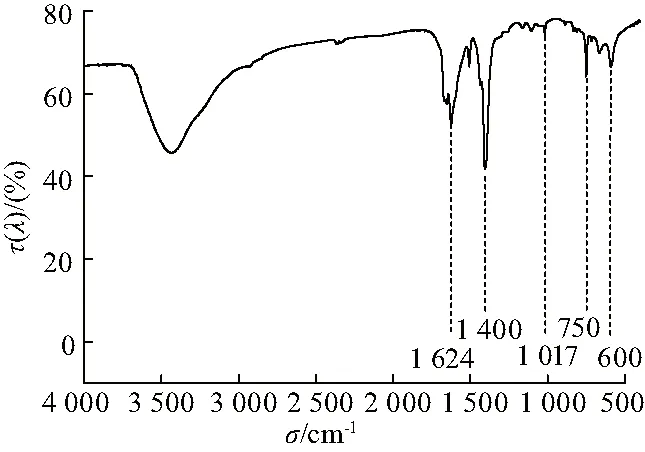
图3 MIL-101的红外吸收光谱Fig.3 Infrared spectra of MIL-101
2.3 热重分析
图4是MIL-101的热重分析曲线.在室温~100 ℃内,失重率达到6%,这是由于MIL-101中的结晶水及配位水从孔道中脱出所致;在250~500 ℃内,失重率达到50%,说明MIL-101骨架开始分解,结构发生坍塌.
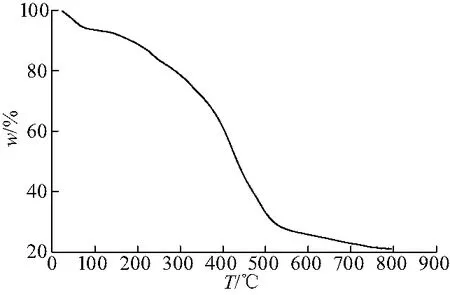
图4 MIL-101的热重曲线Fig.4 Thermogravimetric curve of MIL-101
2.4 N2吸附等温线
图5为MIL-101在77 K时的氮气吸附脱附等温线,该曲线为Ⅰ型吸附等温线.低压区的N2吸附量迅速上升,说明结构中存在大量的微孔,N2首先被吸附到MIL-101较小的孔道内.吸附曲线在p/p0=0.14~0.24内出现第2个吸附台阶,说明MIL-101存在两种类型的孔道.吸附曲线在p/p0≈1时急剧上升,说明N2在材料表面发生聚集.同时吸附和脱附曲线重合,没有观察到明显的滞后环,表明MIL-101结构中几乎不存在介孔.计算得到的BET比表面积为2 809.2 m2/g,与文献[10]报道的MIL-101一致,孔体积为1.953 2 cm3/g.

图5 MIL-101在77 K时的N2吸脱附等温Fig.5 N2 adsorption desorltion isothermsof MIL-101 at 77 K
利用77 K时的N2吸附等温线,采用HK方法得到其孔径分布,如图6.由图可以看出,分别在0.5、1.51和2.16 nm处出现明显的孔分布.在0.5~1.51之间的孔可能是MIL-101制备过程中的缺陷所致.

图6 MIL-101的孔径分布Fig.6 Geometric pore size distribution of MIL-101
2.4 苯、甲醇、甲苯和水的吸附性能
图7为25 ℃时MIL-101对苯、甲醇、甲苯和水的吸附曲线.由图可以看出,MIL-101对苯、甲醇、甲苯和水的吸附量分别为1 300、1 121.7、750和1 200 mg/g.苯和甲苯的吸附等温线为Ⅰ型,当p/p0小于0.1时,吸附量迅速上升并接近饱和;当p/p0在0.1 ~ 0.9时,吸附量缓慢增加;当p/p0在0.9~1时,吸附量又有小幅度的增加.根据吸附剂的孔容限制效应,大尺寸的分子被吸附的量小,导致吸附容量相对较小.由于MIL-101的孔容一定,甲苯的动力学直径(0.67 nm)大于苯(0.58 nm),因此甲苯被吸附的量小,甲苯的吸附量小于苯.甲醇和水的吸附等温线与苯和甲苯不同,存在两个明显的吸附台阶.在低压条件下,以MIL-101中的不饱和金属位吸附为主.由于甲醇的动力学直径(0.43 nm)大于水(0.27 nm),因此甲醇分子会受到孔道周围更强叠加力场的吸附,从而低压条件下对甲醇的吸附量比水高,在高压条件下,发生多层吸附或孔填充.相同孔容条件下,由于水的分子动力学直径比甲苯小很多,因此吸附水的量明显比甲醇多,导致吸附量大于甲醇[11-13].
表1是文中制备的MIL-101的吸附性能与其他文献方法对比结果.从表中可以发现,利用醋酸钠制备的MIL-101对苯的吸附性能接近文献报道的最高值,甲苯吸附性能略低于标准制备温度(氢氟酸为添加剂)制备的MIL-101,优于氢氟酸为添加剂较低温度下制备的MIL-101对苯、甲苯和甲醇的吸附性能.以醋酸钠为添加剂制备的MIL-101在VOCs吸附性能方面表现优异,制备温度比其他方法低,且不需经过繁琐纯化处理即可获得孔道干净的MIL-101,有望推广到工业应用.

图7 25 ℃时苯、甲醇、甲苯、水MIL-101上的吸附等温线Fig.7 Adsorption isotherms of benzene,methanol,toluene and water on MIL-101 at 25 ℃

表1 与其他文献方法的吸附性能比较Table 1 Adsorption characteristics of adsorbentscompared with other articles
根据吸附等温线的初始坡度[14-15]可以评估苯、甲苯和甲醇对水的吸附选择性,斜率越大说明在水蒸汽的吸附竞争中优势越明显.吸附等温线的初始坡度斜率拟合结果如图8.根据拟合结果计算苯、甲苯和甲醇在25 ℃时对水的选择性分别为2.51、6.09和1.70.可以看出,MIL-101甲苯的吸附选择性最好,苯次之,甲醇最差.

图8 25 ℃时MIL-101的苯、甲醇、甲苯和水的初始斜率拟合结果Fig.8 Fitting initial slope for benzene,methanol,toluene and water for MIL-101 at 25 ℃
图9为25 ℃时MIL-101对苯循环吸附性能,每次吸附饱和后均在真空150 ℃下脱气2 h,以苯的第一次吸附容量(1 300 mg/g)为标准进行性能比较.从图中可以看出, MIL-101对苯5次循环的吸附量都保持在80%以上,说明MIL-101对苯的吸附以物理吸附为主,具有较好的吸附循环稳定性,易于再生和循环使用.

图9 25 ℃时MIL-101对苯的循环吸附性能Fig.9 Cyclic adsorption of benzene on MIL-101 at 25 ℃
图10是商业活性炭在25 ℃下对苯、甲醇、甲苯和水的吸附曲线.活性炭对苯、甲醇、甲苯和水的吸附量分别为275、380.25、310和375 mg/g,活性炭的吸附量明显低于MIL-101,这归因于MIL-101较高的比表面积和较大的孔容、孔径.吸附曲线表明,活性炭对苯、甲醇、甲苯等VOCs分子和水分子的吸附以物理吸附为主,而且在低压下对水的吸附量较小.综合来看,在25 ℃时,MIL-101对苯、甲醇和甲苯具有很好的吸附效果,有望成为替代活性炭的新型吸附剂.

图10 25 ℃时苯、甲醇、甲苯和水在活性炭上的吸附等温线Fig.10 Adsorption isotherms of benzene methanoltoluene and water on AC at 25 ℃
3 结论
采用醋酸钠为添加剂,通过水热法成功制备了MIL-101,其比表面积高达2 809.2 m2/g,孔容为1.953 2 cm3/g.MIL-101形貌规整,颗粒分散性好,对苯、甲醇和甲苯具有优异的吸附性能,分别达到1 300、1 121.7和750 mg/g,其吸附性能与氢氟酸法制备的MIL-101相当,优于在210和200 ℃制备的材料,且吸附性能明显高于商业活性炭.在与水的选择吸附中,甲苯的吸附选择性最好,苯次之,甲醇最差.结果表明,制备的MIL-101可作为高效吸附剂使用,在去除VOCs方面具有广泛的应用前景.
