基于高密度SNP遗传图谱的粳稻芽期耐低温QTL鉴定
2020-07-21姜树坤王立志杨贤莉母伟杰董世晨车韦才李忠杰迟力勇李明贤张喜娟李文华
姜树坤 王立志 杨贤莉 李 波 母伟杰 董世晨 车韦才 李忠杰 迟力勇 李明贤 张喜娟 姜 辉 李 锐 赵 茜 李文华,*
基于高密度SNP遗传图谱的粳稻芽期耐低温QTL鉴定
姜树坤1,*王立志1杨贤莉1李 波2母伟杰3董世晨3车韦才3李忠杰1迟力勇1李明贤1张喜娟1姜 辉2李 锐1赵 茜1李文华2,*
1黑龙江省农业科学院耕作栽培研究所/ 黑龙江省寒地作物生理生态重点实验室/ 黑龙江省农作物低温冷害工程技术研究中心, 黑龙江哈尔滨 150086;2黑龙江省农业科学院, 黑龙江哈尔滨 150086;3哈尔滨师范大学生命科学与技术学院, 黑龙江哈尔滨 150025
水稻直播由于省时、省工和节约成本而备受农户关注。然而, 芽期耐冷性不强致使现行推广的许多优良水稻品种不适于直播生产。因此, 挖掘鉴定芽期耐冷位点, 为后续的辅助育种提供基因资源就日益受到重视。本研究利用丽江新团黑谷和沈农265构建的重组自交系群体及其重测序构建的包含2818个bin标记的遗传图谱对水稻芽期的耐冷性进行QTL定位分析。共检测到5个芽期耐冷QTL, 分布在水稻的1号、3号、9号和11号染色体上, 增效等位基因均来自耐冷亲本丽江新团黑谷。这些QTL的LOD值的范围从3.05到24.01, 表型贡献率为8.0%~53.5%。其中, 表型贡献率最大的主效QTL是, 位于11号染色体长臂端的21.24 Mb~22.03 Mb之间, 物理图谱区间为790 kb。随后利用“选择作图”的策略进行了QTL验证和累加效应分析, 明确了可以通过QTL的累加聚合实现芽期耐冷能力的遗传改良, 聚合的增效QTL越多, 耐冷能力提升越明显。上述研究结果不仅可以增强人们对芽期水稻耐冷能力遗传基础的认识和理解, 也可以为后续直播品种的遗传改良提供理论依据和技术指导。
粳稻; 芽期耐冷性; 重测序; 遗传图谱; 数量性状基因座
作为世界上最重要的粮食作物之一, 水稻起源于热带、亚热带, 相较小麦、大麦等作物, 对低温更加敏感[1]。冷害是全球性自然灾害, 在世界许多国家均有发生, 尤以澳大利亚南部、日本、巴西、韩国、朝鲜为甚, 大规模冷害的发生会造成数十上百亿公斤粮食的损失[2-6]。我国多数稻作区均有低温冷害发生, 在华南和长江中下游的双季稻区, 春季的“倒春寒”和秋季的“寒露风”常常引起低温冷害[7]。东北地区平均3~4年就会遭遇一次大范围的冷害, 造成水稻大量减产, 危害粮食安全[8]。水稻萌发期、芽期、苗期、孕穗期、开花期和灌浆期易受低温冷害影响[9-10], 与产量有直接或间接关系。20世纪90年代以来, 我国的水稻生产发生了较大的变化。一方面, 水稻生产目标从追求产量向降低成本、提高经济效益转变; 另一方面, 随着我国经济的快速发展, 农村主要劳动力向城镇转移, 农村劳动力紧缺已成为水稻生产发展的主要限制因素。在这样的背景下, 水稻直播由于省时、省工和节约成本, 深得农民的欢迎, 并迅速推广。据不完全统计, 水稻直播面积在安徽省已达56.7万公顷, 湖北省为49万公顷, 江西省为43.3万公顷, 江苏省为69.3万公顷, 浙江省为37.3万公顷, 广东省为10万公顷, 黑龙江省的直播稻面积为40万公顷[11-12]。华南双季稻区早稻直播和东北高寒稻区的单季稻直播往往会遇到春季低温天气, 造成缺苗断垄, 导致严重减产[9-12]。这就要求用于直播的水稻种子有较强的芽期耐低温能力。而上述稻作区一直以育秧移栽为主, 芽期耐低温能力长期不作为育种目标, 致使许多高产、优质的水稻品种由于芽期耐低温能力弱而不能用作直播稻, 限制了直播稻的生产。因此, 水稻芽期耐冷性是其生长发育过程中不可忽视的重要性状。
自从20世纪30年代, 科研人员开始研究水稻冷害以来, 已在冷害发生的气象学原因、水稻耐冷的生理机制、遗传解析和基因克隆等方面积累了大量的研究成果[1,13-19]。但与萌发期、苗期和孕穗期冷害相比, 人们在水稻芽期耐冷性方面的研究稍显不足, 目前主要开展的是芽期耐冷基因的QTL定位研究。严长杰等[20]利用南京11和巴利拉的DH群体, 在7号染色体上鉴定出1个芽期冷害QTL。Zhang等[21]利用Lemont和特青的重组自交系群体, 在3号、7号和11号染色体上检测到3个控制水稻芽期耐冷性的QTL。乔永利等[22]利用密阳23和吉冷1号的F2:3群体, 在2号、4号和7号染色体上检测到3个芽期耐冷QTL。陈玮等[23]利用Lemont和特青的重组自交系群体, 在1号、3号、7号和11号染色体上检测到4个控制水稻芽期耐冷性的QTL。张露霞等[24]利用Asominori和IR24的重组自交系群体和相应的染色体片段置换系, 在5号和12号染色体上检测到3个芽期耐冷QTL。巩迎军等[25]利用越光和Kasalath的回交重组自交系群体, 在4号、6号和11号染色体上检测到4个芽期耐冷QTL。林静等[26]利用以籼稻9311为受体、粳稻日本晴为供体的染色体片段置换系, 在5号和7号染色体上鉴定出4个芽期耐冷QTL。Baruah等[27]利用栽培稻A58和野生稻W107的重组自交系群体, 在1号、11号和12号染色体上检测到了3个芽期耐冷QTL。Ji等[28]利用TN1和春江06的DH群体, 在2号、4号和11号染色体上鉴定出3个芽期耐冷QTL。周勇等[29]利用籼稻9311为受体、粳稻日本晴为供体的染色体单片段置换系, 在除1号和11号染色体以外的10条染色体上检测出18个芽期耐冷QTL。杨洛淼等[30]利用空育131和东农422的重组自交系群体, 在4号染色体上检测到1个芽期耐冷QTL。朱金燕等[31]利用广陆矮4号为受体, 日本晴为供体的染色体片段置换系, 在1号、6号、8号、9号和10号染色体上检测到8个芽期耐冷QTL。Yang等[32]利用华粳籼74为受体, 南洋占为供体的染色体片段置换系, 在5号和6号染色体上鉴定了2个芽期耐冷QTL。Zhang等[33]利用249份籼稻种质资源材料结合5K水稻芯片进行芽期耐冷的GWAS分析, 在1号、3号、4号、5号、6号、10号和12号染色体上共检测到13个芽期耐冷相关区域。
虽然人们对芽期耐冷性进行了较多的QTL鉴定分析, 而且在水稻的12条染色体上均检测到了QTL的存在, 但鉴定到的QTL多为微效QTL, 进行精细定位和后续研究难度较大。同时, 由于研究所用的遗传群体和试验环境等方面的不同, 研究结果不尽相同, 因此有必要采用与以往不同的遗传群体和更高密度的遗传图谱来对已报道的芽期耐冷QTL进行验证, 并检测新的芽期耐冷位点。本研究利用丽江新团黑谷和沈农265构建的重组自交系群体, 结合重测序技术构建的高密度bin遗传图谱, 挖掘控制芽期耐冷性的QTL, 以期为直播稻的耐冷设计育种提供有用的“基因资源”, 同时为阐明水稻芽期耐冷的遗传和分子机制提供参考。
1 材料与方法
1.1 试验材料
2004年, 以芽期耐冷性强的云南地方粳稻品种丽江新团黑谷(LTH)为母本, 芽期耐冷性弱的北方超级稻品种沈农265 (SN265)为父本配制杂交组合, 2005—2013年分别在辽宁沈阳(2005—2006, 2008—2009)、海南三亚(2008)和黑龙江哈尔滨(2011—2015)三地, 采用单粒传法(single seed descent, SSD)套袋自交11代获得包含144个株系的稳定遗传重组自交系群体(recombinant inbred lines, RILs)。
参照Huang等[34]报道的重测序手段, 采用“滑动窗口”法构建了丽江新团黑谷和沈农265的重组自交系群体bin遗传图谱。该bin连锁图谱共包含58,738个重组热点, 平均每个株系405个重组热点。最终产生了2818个重组bin标记(图1-A), 这些标记覆盖了大部分的重组热点(图1-B), 平均每条染色体上覆盖235个bin标记, 标记区间平均为128.8 kb[35]。
1.2 芽期耐冷性评价方法
亲本丽江新团黑谷(LTH)、沈农265 (SN265)和144份重组自交系群体材料存放于种子储藏柜中待用, 储藏条件为温度5°C, 相对湿度为10%。评价芽期耐冷性参照韩龙植等[36]的方法略作修改, 每个株系3次重复, 利用3次的平均值进行后续分析。首先将种子从储藏柜中取出, 在50°C恒温干燥箱内高温处理48 h, 使其充分干燥并打破种子休眠。每次重复挑选饱满粒100粒, 经0.1%的氯化汞溶液消毒10 min, 自来水冲洗3~4次, 去离子水洗涤3次, 于垫双层滤纸的直径9 cm培养皿中, 加入10 mL去离子水。盖上培养皿盖, 在30°C恒温培养箱(上海一恒MGC-250)内催芽2~3 d。然后从恒温箱中取出, 用去离子水冲洗1~2次。从发芽的种子中精心挑选芽长约1~2 cm的种子50粒, 种植于边长2 cm的营养钵盆中, 钵盆中事先放置配制好的营养育苗土。28°C光照培养箱(上海一恒MGC-450HP)内放置1 d后, 转入大型人工气候箱(日本三江平原项目援建霜冻害实验室)内处理48 h, 温度条件为2°C。处理后, 将试验材料转移到温度为20~30°C, 并有阳光的地方, 使其恢复生长, 每天适量浇水。恢复10 d后, 调查秧苗生长状态。按照图2的标准给处理后的秧苗恢复状态赋值, 共分为5级: 恢复后幼芽枯死的赋值为0; 恢复后幼芽停止发育, 出现畸形的赋值为1; 恢复后有一定生长能力, 叶色较淡, 但发育非常缓慢的赋值为2; 恢复后生长能力较强, 叶色淡, 发育较缓慢的赋值为3; 恢复后叶色较深, 能够快速生长的赋值为4。并按照不同级别进行加权计分。芽期耐冷级别=(0×0级的株数+1×1级的株数+2×2级的株数+3×3级的株数+4×4级的株数)/处理的材料总株数。
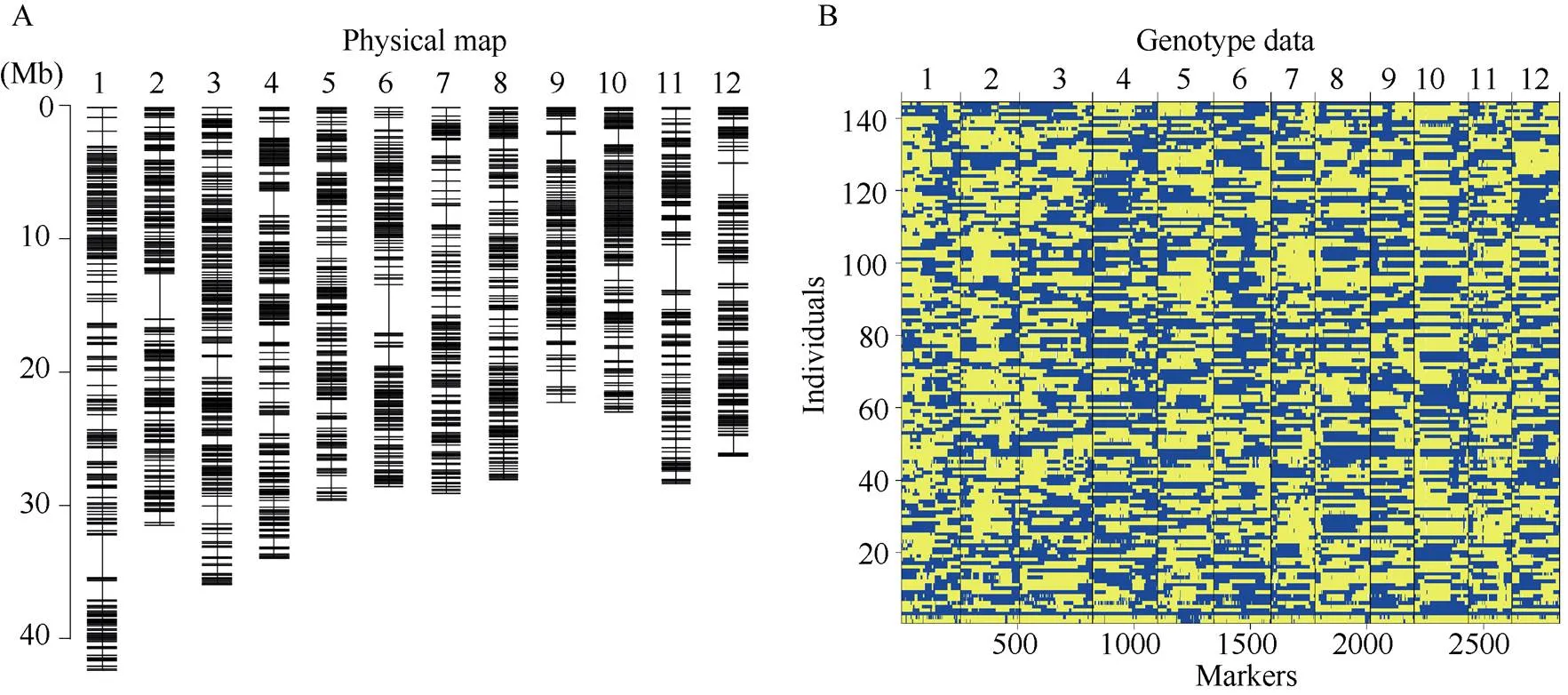
图1 丽江新团黑谷-沈农265重组自交系群体的物理图谱(A)和基因型(B)
物理图谱位置基于日本晴参考基因组(MSU Rice Genome Annotation Project Release 7), 黄色表示沈农265; 蓝色表示丽江新团黑谷。
Physical position is based on MSU Rice Genome Annotation Project Release 7 sequence. Yellow: SN265 genotype; Blue: LTH genotype.

图2 水稻芽期冷害评价等级标准
1.3 芽期耐冷性的QTL鉴定和QTL效应分析
采用R/qtl的CIM方法进行QTL定位, 采用命令进行排列组合1000次的LOD阈值(α=0.05)确定, 当实际求得的LOD值大于LOD阈值时, 就认为该区段存在1个QTL, 其置信区间为LOD峰值向下1个LOD值单位的区间[37]。
为了进一步验证本试验定位结果的准确性, 同时评价筛选到的QTL累加效应, 利用“选择作图”策略进行QTL验证和累加效应分析[38]。首先将控制芽期耐冷的其他QTL位点根据分子标记数据进行非增效基因的固定, 以此来避免其他QTL对后续分析的影响, 然后在RILs群体中筛选目标QTL区间的重组交换单株, 进而对QTL进行验证和累加效应分析。
2 结果与分析
2.1 亲本的芽期耐冷性比较及群体的芽期耐冷性分布
课题组前期的研究表明, 丽江新团黑谷与沈农265在多个不同时期的耐冷相关性状上存在显著差异, 丽江新团黑谷具有更优秀的综合耐冷特性。本研究中, 2个亲本在2°C低温处理2 d并恢复10 d后, 沈农265的平均芽期耐冷等级仅为0.813, 而丽江新团黑谷高达3.188 (图3和图4), 差异达到极显著水平。重组自交系群体的芽期耐冷性等级分布范围为0.313~3.688, 平均值为1.699, 标准差为0.767。整体上呈现近似正态分布, 并表现出较强的超亲分离(图4)。

图3 亲本丽江新团黑谷和沈农265芽期不经冷处理(A)和冷处理后(B)的比较
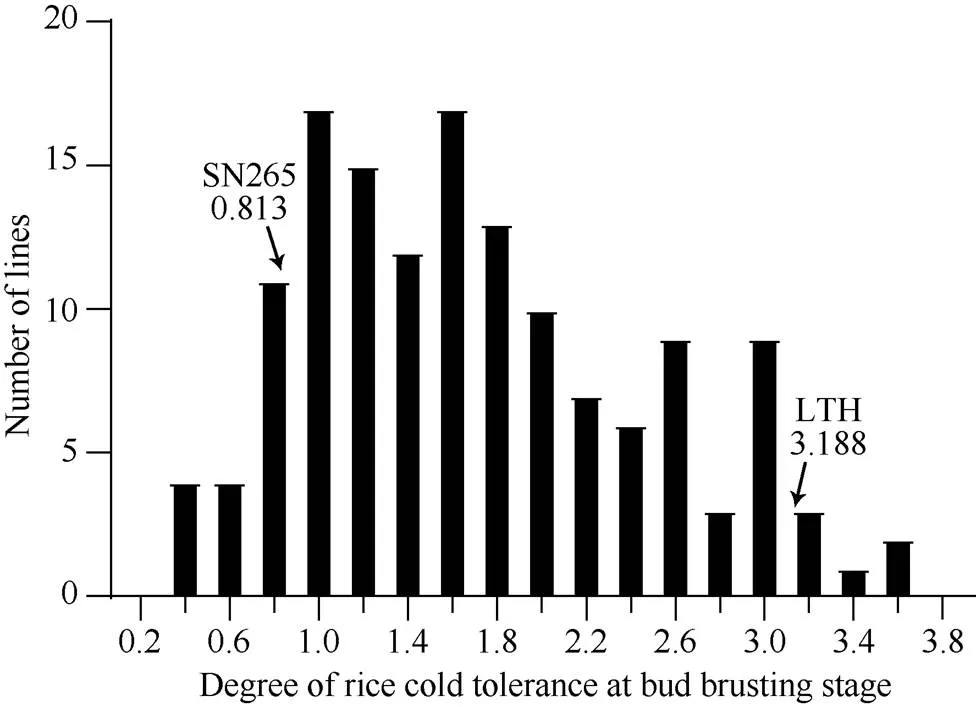
图4 重组自交系群体的芽期耐冷性分布
2.2 群体芽期耐冷性的QTL分布与效应
利用R/qtl软件共检测到5个控制水稻芽期耐冷性的QTL, 分布在水稻的1号、3号、9号和11号染色体上, 这些QTL的增效等位基因均来自于丽江新团黑谷(表1和图5)。表型贡献率最大的主效QTL是(LOD值为24.01), 位于11号染色体长臂端的21.24 Mb~22.03 Mb之间, 区间大小0.79 Mb。另外两个贡献率大于15%的主效QTL是(LOD值为5.36)和(LOD值为8.58), 分别位于水稻第9染色体上19.90 Mb~22.30 Mb之间和11号染色体上8.53 Mb~9.93 Mb之间, 区间大小分别为2.40 Mb和1.40 Mb。两个微效QTL是(LOD值为3.26)和(LOD值为3.05), 分别位于水稻1号染色体上0.43 Mb~0.93 Mb之间和3号染色体上29.40 Mb~32.87 Mb之间, 区间大小分别为0.50 Mb和0.61 Mb。没能从沈农265中检测到芽期耐冷性的增效等位QTL。
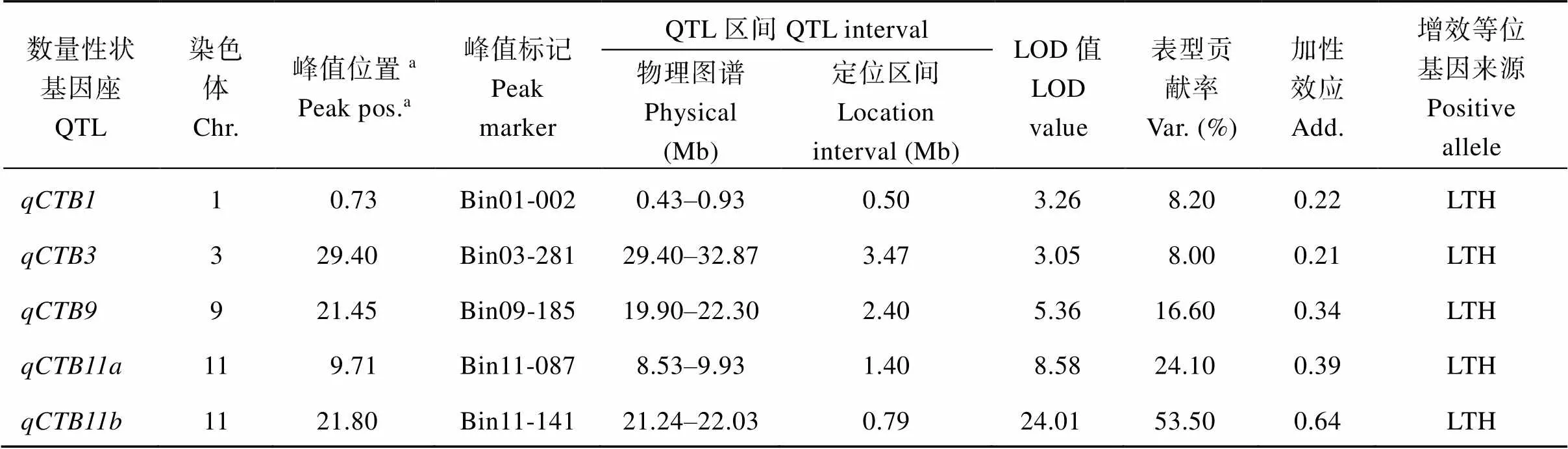
表1 利用丽江新团黑谷-沈农265的重组自交系群体检测的芽期耐冷QTL信息
a在水稻物理图谱上的位置(单位: Mb)。
aPositions in physical linkage map (unit: Mb). LTH: Lijiangxintuanheigu.
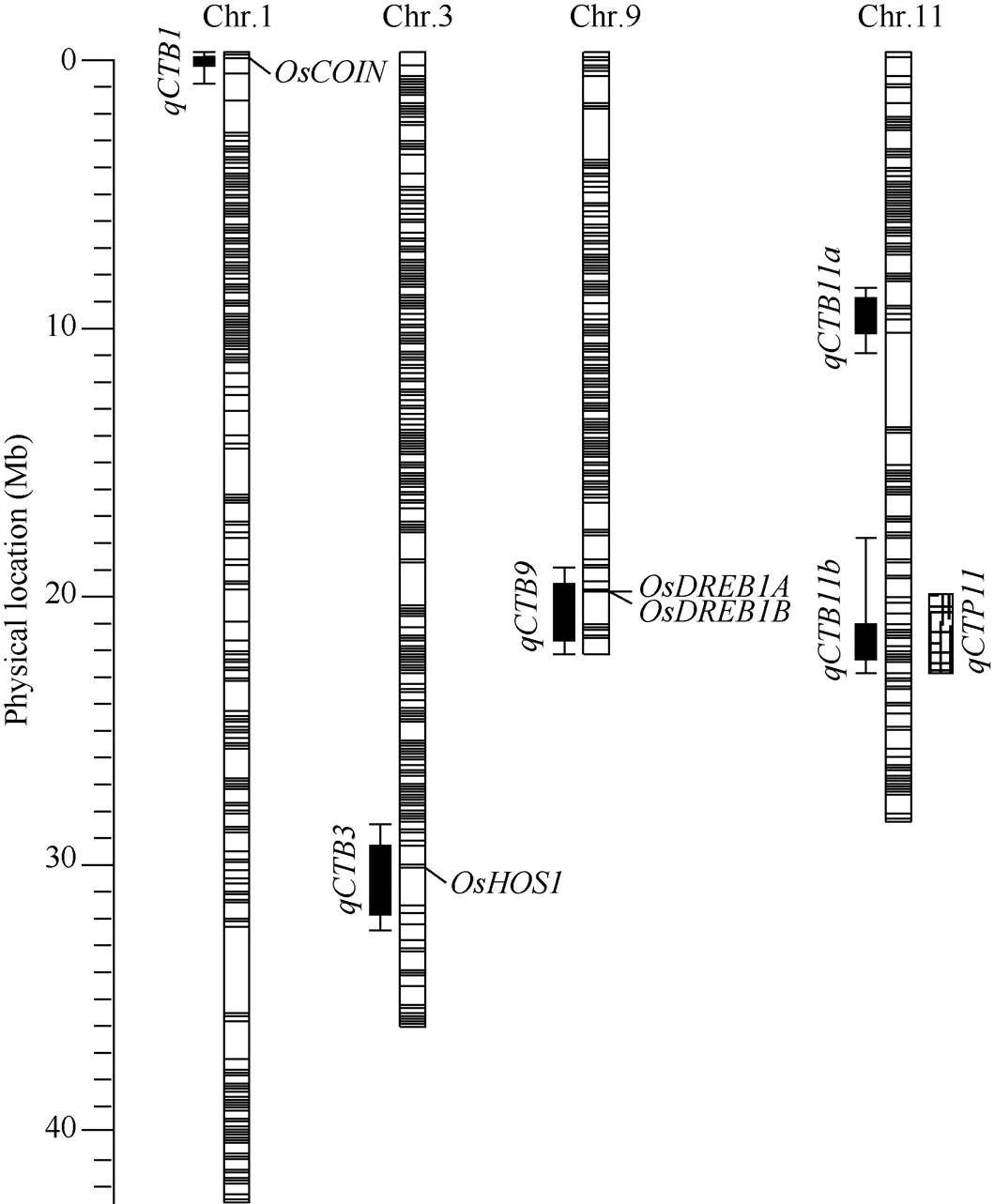
图5 控制芽期耐冷性的QTL在染色体上的位置分布
: 低温诱导的锌指蛋白[46];: 参与冷胁迫的E3泛素连接酶[47];,: 低温诱导的AP2/ EREBP转录因子基因[48];: 芽期耐冷QTL[27]。
: cold inducible zinc finger protein[46];: a rice E3-Ubiquitin Ligase in the modulation of cold stress response[47];: cold inducible AP2/EREBP transcription factor gene[48];: a QTL for cold tolerance at bud stage[27].
2.3 芽期耐冷性QTL的验证和累加效应分析
我们对检测到的芽期耐冷QTL进行了验证并评价了这些QTL的互作和累加效应。首先, 将控制芽期耐冷性的其他QTL利用分子标记辅助进行非增效基因的固定, 然后在重组自交系群体中筛选目标区间(待评价QTL区间)为增效等位基因的单株, 进而对这5个QTL进行验证。随后, 利用类似的策略, 通过标记辅助选择出不同QTL组合的单株, 进行QTL的互作分析和累加效应评价。不导入任何芽期耐冷QTL株系的芽期低温抗性等级为0.80 (图6和图7-A, X), 含有1个QTL株系的芽期低温抗性等级从1.03到2.33 (图6和图7-C~F), 含有的株系具有最高的芽期低温抗性等级(图6和图7-G)。含有2个QTL株系的芽期低温抗性等级从1.67到2.82 (图6和图7-H~M), 含有株系的芽期低温抗性等级普遍较高(2.44~2.82), 2个QTL之间的作用总体上表现为简单的加性效应, 互作效应较弱。由于受群体规模的影响, 并没有覆盖到全部的3个QTL聚合类型, 筛选到的6个类型含有3个QTL株系的芽期低温抗性等级从1.33到2.98 (图6和图7-N~S), 与两个QTL聚合的规律类似, 含有株系的芽期低温抗性等级普遍较高(2.52~2.98), 3个QTL之间的作用总体上也表现为简单的加性效应。4个QTL聚合的株系检测到3个类型, 均含有和, 它们的芽期低温抗性等级从3.00到3.06 (图6和图7-T~V)。共检测到同时聚合5个QTL的株系8个, 它们的芽期低温抗性等级从2.94到3.50 (图6和图7-W)。通过上述分析, 基本确定了芽期耐低温QTL在重组自交系群体中聚合时主要表现为加性效应。

图6 芽期耐冷QTL的验证和聚合效应分析使用的重组单株基因型
“-”: 缺失。“-”: missing.
3 讨论
3.1 水稻芽期耐冷性评价方法的比较
水稻芽期耐冷能力是决定水稻直播成苗率和整齐度的重要农艺性状, 尤其是在北方稻区和南方双季稻早稻进行直播栽培的重要抗逆性状。近年来, 随着直播技术的改良, 越来越多的地区在水稻直播时选择“芽种直播”或“盲谷播种”, 使得芽期耐冷特性成为决定品种是否适宜直播栽培的关键因素。因此, 准确评价试验材料的芽期耐冷特性就变得越来越重要。芽期耐冷鉴定方法中比较常用的是利用低温培养箱处理萌芽后的种子, 并利用秧苗成活率作为评价指标, 这种方法简单、直观、结果可靠[22-33]。本研究对这种方法进行了进一步的改进, 主要包括以下几个方面: 一是低温处理的温度和时间, 前人报道中, 多采用5°C 5 d[22-33], 本研究采用了2°C 2 d,既满足了低温处理的低温条件, 又缩短了处理时间。二是低温处理后的秧苗培养方式, 前人多使用全程水培[22-25], 本研究选择土培, 这样更接近水稻直播生产实际。三是芽期冷害等级的评价方式, 前人多是简单地将处理缓苗后的秧苗成活率作为芽期耐冷性鉴定的指标[22-25], 本研究为了更全面地反映每一个株系的综合抗性, 采用了不同级别加权合计的方式评价某一株系整体的耐冷水平。通过上述改进, 不仅缩短了处理时间, 而且还提高了鉴定的精准度。
3.2 重测序技术和高密度bin标记遗传图谱在水稻QTL分析中的应用
随着重测序成本的大幅下降和测序数据利用技术的日益成熟, 利用重测序技术结合“滑动窗口”法构建bin遗传图谱已成为水稻[39-41]、玉米[42-43]、高粱[44]等作物农艺性状遗传研究的重要技术手段。与传统的分子标记相比, 重测序获得的SNP标记具有高基因组覆盖度和高密度的优势, 它不仅显著提高了QTL鉴定和定位的准确性和精确性, 而且能够为后续的基因功能研究提供相对较小的染色体区间参考。本研究利用包含2818个bin标记的遗传图谱分别将控制水稻芽期耐冷性的QTL定位到了0.50 Mb~2.40 Mb的区间内, 最小的物理区间分别是500 kb ()和790 kb (), 相对较大的物理区间也仅分别是1.40 Mb ()、2.40 Mb ()和3.47 Mb (), 这远远小于传统分子标记高达5~10 cM的定位区间(约4 Mb~10 Mb)。500 kb左右的QTL定位区间虽然离直接完成基因克隆尚有一定的差距[45], 但是也为后续的精细定位提供了足够小的物理区间。此外, 传统的QTL分析作图群体主要是籼-粳亚种间杂交得到的, 少数为籼-籼交群体, 很少使用两个粳稻作为亲本材料的遗传群体, 主要是因为粳稻亚种内的多态性远远小于籼稻亚种内, 与籼-粳亚种间的多态性相比, 更是差距极大[46]。重测序技术成为解决这一问题的有效手段, 使得利用粳-粳交群体也可以构建高密度的遗传图谱, 为研究粳稻食味品质、孕穗期障碍型冷害等要求双亲均为粳稻的实验提供了极大的便利。

图7 控制芽期耐冷性的QTL效应及在LTH-SN265重组自交系群体中的聚合效果分析
A: 亲本沈农265 (SN265); B: 亲本丽江新团黑谷(LTH); C~G:、、、和的芽期耐冷效应; H:和的芽期耐冷聚合效应; I:和的芽期耐冷聚合效应; J:和的芽期耐冷聚合效应; K:和的芽期耐冷聚合效应; L:和的芽期耐冷聚合效应; M:和的芽期耐冷聚合效应; N:、和的芽期耐冷聚合效应; O:、和的芽期耐冷聚合效应; P:、和的芽期耐冷聚合效应; Q:、和的芽期耐冷聚合效应; R:、和的芽期耐冷聚合效应; S:、和的芽期耐冷聚合效应; T:、、和的芽期耐冷聚合效应; U:、、和的芽期耐冷聚合效应; V:、、和的芽期耐冷聚合效应; W:、、、和的芽期耐冷聚合效应; X: 无QTL的株系表型。
A: Shennong 265 (SN265); B: Lijiangxintuanheigu (LTH); C–G: Cold tolerance effect of,,,, andat bud stage; H: Cold tolerance cluster effect ofandat bud stage; I: Cold tolerance cluster effect ofandat bud stage; J: Cold tolerance cluster effect ofandat bud stage; K: Cold tolerance cluster effect ofandat bud stage; L: Cold tolerance cluster effect ofandat bud stage; M: Cold tolerance cluster effect ofandat bud stage; N: Cold tolerance cluster effect of,,andat bud stage; O: Cold tolerance cluster effect of,,andat bud stage; P: Cold tolerance cluster effect of,,andat bud stage; Q: Cold tolerance cluster effect of,,andat bud stage; R: Cold tolerance cluster effect of,,andat bud stage; S: Cold tolerance cluster effect of,,andat bud stage; T: Cold tolerance cluster effect of,,,andat bud stage; U: Cold tolerance cluster effect of,,andat bud stage; V: Cold tolerance cluster effect of,,,andat bud stage; W: Cold tolerance cluster effect of,,,,andat bud stage; X: none QTL line.
3.3 耐冷QTL全部来自LTH的可能原因及利用RIL群体进行QTL聚合评估的可行性
本研究中发现SN265和LTH构建的重组自交系群体存在芽期耐冷性的超亲分离, 但检测到的耐冷QTL全部来自LTH, 其原因主要是QTL检测时, 为了尽可能降低假阳性, 使用了相对较高的LOD阈值(3.0)。如果将LOD阈值降低到2.4, 能检测到一个可能的QTL-, 其LOD值仅为2.45, 表型贡献率很小, 仅为5.8%, 加性效应值为−0.13。该QTL的耐冷增效等位基因来自沈农265, 但由于表型贡献率太小, 还需要构建该QTL的高世代回交群体进行真伪验证。此外, 对检测的QTL进行效应评价, 尤其是对QTL进行聚合效果分析是QTL用于水稻育种实践的重要前提。但是, 一般而言, 由于重组自交系中导入片段相对较多, 排除遗传背景的噪音影响难度很大, 很可能影响QTL累加效应评估。所以, 重组自交系较少用于QTL的累加效应评估。本研究采用了“选择作图”的方法进行QTL的累加效应分析, 该方法的关键就是充分发挥已构建的高密度物理图谱和详细的群体基因型数据将目标QTL以外的其他QTL进行基因型固定, 以尽可能排除遗传背景的影响。我们之前也成功利用这一方法分析了水稻根系的QTL聚合效果[38]。当然, 以选择作图分析QTL聚合效果的能力肯定不如近等基因系或染色体片段代换系, 但在没有更高级的遗传群体时, 仍不失为一种有效手段。
3.4 本研究鉴定的水稻芽期耐低温QTL与其他研究结果的比较和育种应用潜力
随着农村劳动力的大规模转移和农业生产成本的不断攀升, 水稻直播生产越来越受到黑龙江省地广人稀的农业主产区农户的重视。但是, 由于独特的寒地生态环境, 黑龙江水稻直播不得不面对春季的低温环境。水稻芽期耐冷性是在低温下水稻幼芽细胞维持生活的能力, 从外观上表现为幼芽诱发和维持绿苗的能力, 是水稻直播必具备的重要农艺性状[22]。本文从芽期耐冷性强的云南地方粳稻品种丽江新团黑谷中, 鉴定出5个控制芽期耐低温能力的QTL, 同QTL数据库(Q-TARO: http://qtaro.abr.affrc. go.jp/)搜集整理的耐冷相关QTL比对发现,附近有一个已知的受冷诱导的锌指蛋白基因, 该基因过量表达可以增强水稻耐冷性, 同时增加脯氨酸含量[47]。区间内包含一个已知的耐冷相关基因, 它通过与互作来参与水稻的冷胁迫反应[48]。区间内包含2个成簇存在的耐冷相关基因, 分别是和, 二者均受冷诱导, 参与水稻的冷胁迫反应[49]。附近没有发现已经鉴定的冷害相关QTL和基因, 是一个新发现的位点。主效QTL-与Baruah等[27]鉴定的芽期耐冷QTL-位于相同的区间,来源于北海道地方品种A58。综上可以看出, 控制水稻芽期耐冷性的QTL在不同遗传背景条件下具有一定的重演性, 而且第11染色体上鉴定的主效位点具有较大的后续研究价值。我们也利用“选择作图”的方法评价了这些QTL的育种潜力和聚合效果, 发现芽期耐低温QTL主要表现为加性效应, 非常适于水稻的分子辅助育种。而且主效QTL-不仅自身具有很大的遗传效应, 而且在与其他QTL聚合时, 常常表现出更加突出的改良效果, 极具育种应用价值。
4 结论
构建了丽江新团黑谷和沈农265重组自交系群体包含2818个bin标记的遗传图谱。利用此群体和bin标记图谱, 共检测到5个芽期耐冷QTL, 分布在水稻的1号、3号、9号和11号染色体上, 表型贡献率分别为8.0%、8.2%、16.6%、24.4%和53.5%, 增效等位基因均来自耐冷亲本丽江新团黑谷。主效QTL-位于11号染色体长臂端的17.97 Mb~23.03 Mb之间。利用“选择作图”策略进行了QTL验证和累加效应分析, 明确了可以通过QTL的累加聚合实现芽期耐冷能力的遗传改良, 聚合的增效QTL越多, 耐冷能力等级越高。
[1] 刘次桃, 王威, 毛毕刚, 储成才. 水稻耐低温逆境研究: 分子生理机制及育种展望. 遗传, 2018, 40: 171–185. Liu C T, Wang W, Mao B G, Chu C C. Cold stress tolerance in rice: physiological changes, molecular mechanism, and future prospects., 2018, 40: 171–185 (in Chinese with English abstract).
[2] 矫江, 许显滨, 孟英. 黑龙江省水稻低温冷害及对策研究. 中国农业气象, 2004, 25(2): 27–29. Jiao J, Xu X B, Meng Y. Analysis of rice chilling injury and countermeasures in Heilongjiang province., 2004, 25(2): 27–29 (in Chinese with English abstract).
[3] 聂元元, 蔡耀辉, 颜满莲, 李永辉, 毛凌华, 颜龙安, 杨晓莉. 水稻低温冷害分析研究进展. 江西农业学报, 2011, 23(3): 63–66. Nie Y Y, Cai Y H, Yan M L, Li Y H, Mao L H, Yan L A, Yang X L. Research advances in chilling injury to rice., 2011, 23(3): 63–66 (in Chinese with English abstract).
[4] Cruz R P, Sperotto R A, Cargnelutti D, Adamski J M, de FreitasTerra T, Fett J P. Avoiding damage and achieving cold tolerance in rice plants., 2013, 2: 96–119.
[5] Borjas A H, Leon T B D, Subudhi P K. Genetic analysis of germinating ability and seedling vigor under cold stress in US weedy rice., 2016, 208: 1–14.
[6] Satoh T, Tezuka K, Kawamoto T, Matsumoto S, Satoh-Nagasawa N, Ueda K, Sakurai K, Watanabe A, Takahashi H, Akagi H. Identification of QTLs controlling low-temperature germination of the east European rice variety Maratteli., 2016, 207: 245–254.
[7] 吴立, 霍治国, 姜燕, 张蕾, 于彩霞. 气候变暖背景下南方早稻春季低温灾害的发生趋势与风险. 生态学报, 2016, 36: 1263–1271. Wu L, Huo Z G, Jiang Y, Zhang L, Yu C X. Trends and risk of spring low-temperature damage to early rice in southern China against the background of global warming., 2016, 36: 1263–1271 (in Chinese with English abstract).
[8] 郭丽颖, 耿艳秋, 金峰, 宋微, 邵玺文. 寒地水稻低温冷害防御栽培技术研究进展. 作物杂志, 2017, (4): 7–14. Guo L Y, Geng Y Q, Jin F, Song W, Shao X W. Research advances about low temperature, cold damage defense cultivation techniques of rice in cold region of china., 2017, (4): 7–14 (in Chinese with English abstract).
[9] 戴陆园, 叶昌荣, 余腾琼, 徐福荣.水稻耐冷性研究: I. 稻冷害类型及耐冷性鉴定评价方法概述.西南农业学报, 2002, 15(1): 41–45. Dai L Y, Ye C R, Yu T Q, Xu F R. Studies on cold tolerance of rice,L. : I. Description on types of cold injury and classifications of evaluation methods on cold tolerance in rice., 2002, 15(1): 41–45 (in Chinese with English abstract).
[10] 韩龙植, 曹桂兰, 芮钟斗, 安永平, 乔永利, 黄兴九, 高熙宗. 水稻芽期耐冷性与其他耐冷性状的相关关系. 作物学报, 2004, 30: 990–995. Han L Z, Cao G L, Yea J D, An Y P, Qiao Y L, Huang X J, Koh H J. Relationship between cold tolerance at the bud bursting period and other traits related to cold tolerance in rice., 30: 990–995 (in Chinese with English abstract).
[11] 陈品, 陆建飞. 长江中下游地区直播稻的生理生态特性及其栽培技术的研究进展. 核农学报, 2013, 27: 487–494. Chen P, Lu J F. Research advances on the physiological and ecological characteristics and cultivation techniques of direct seeding rice in the Middle-Lower Yangtze area., 2013, 27: 487–494 (in Chinese with English abstract).
[12] 张喜娟, 来永才, 孟英, 唐傲, 董文军, 冷春旭, 王立志, 姜树坤, 姜辉, 丁国华. 水直播对寒地粳稻产量和品质性状的影响. 中国稻米, 2016, 22(2): 43–46. Zhang X J, Lai Y C, Meng Y, Tang A, Dong W J, Leng C X, Wang L Z, Jiang S K, Jiang H, Ding G H. Effects of water direct seeding on yield and quality ofrice in cold area., 2016, 22(2): 43–46 (in Chinese with English abstract).
[13] 余会康, 郭建平. 气候变化下东北水稻冷害时空分布变化. 中国生态农业学报, 2014, 22: 594−601. Yu H K, Guo J P. Variation in spatial and temporal distribution of chilling injury of rice under climate change in Northeast China., 2014, 22: 594−601 (in Chinese with English abstract).
[14] Fujino K, Sekiguchi H, Matsuda Y, Sugimoto K, Ono K, Yano M. Molecular identification of a major quantitative trait locus,, controlling low-temperature germinability in rice., 2008, 105: 12623–12628.
[15] Liu C T, Ou S, Mao B, Tang J, Wang W, Wang H, Cao S, Schläppi M, Zhao B, Xiao G. Early selection of bZIP73 facilitated adaptation ofrice to cold climates., 2018, 9: 3302.
[16] Saito K, Hayano-Saito Y, Kuroki M, Sato Y. Map-based cloning of the rice cold tolerance gene., 2010, 179: 97–102.
[17] Zhang Z Y, Li J J, Pan Y H, Li J L, Zhou L, Shi H L, Zeng Y W, Guo H F, Yang S M, Zheng W W, Yu J P, Sun X M, Li G L, Ding Y L, Ma L, Shen S Q, Dai L Y, Zhang H L, Yang S H, Guo Y, Li Z C. Natural variation in CTB4a enhances rice adaptation to cold habitats., 2017, 8: 14788.
[18] Ma Y, Dai X Y, Xu Y Y, Luo W, Zheng X M, Zeng D L, Pan Y J, Lin X L, Liu H H, Zhang D J, Xiao J, Guo X Y, Xu S J, Niu Y D, Jin J B, Zhang H, Xu X, Li L L, Wang W, Qian Q, Ge S, Chong K. COLD1 confers chilling tolerance in rice., 2015, 160: 1209–1221.
[19] Mao D H, Xin Y Y, Tan Y J, Hu X J, Bai J J, Liu Z Y, Yu Y L, Li L Y, Peng C, Fan T, Zhu Y X, Guo Y L, Wang S H, Li D P, Xing Y Z, Yuan L P, Chen C Y. Natural variation in thegene confers chilling tolerance in rice and allowed adaptation to a temperate climate., 2019, 116: 3494–3501.
[20] 严长杰, 李欣, 程祝宽, 于恒秀, 顾铭洪, 朱立煌. 利用分子标记定位水稻芽期耐冷性基因. 中国水稻科学, 1999, 13: 134–138. Yan C J, Li X, Cheng Z K, Yu H X, Gu M H, Zhu L H. Identification of QTL for cold tolerance at early seeding stage in rice () via RFLP markers., 1999, 13: 134–138 (in Chinese with English abstract).
[21] Zhang Z H, Li S, Li W, Chen W, Zhu Y G. A major QTL conferring cold tolerance at the early seedling stage using recombinant inbred lines of rice (L.)., 2005, 168: 527–534.
[22] 乔永利, 韩龙植, 安永平, 张媛媛, 曹桂兰, 高熙宗. 水稻芽期耐冷性QTL的分子定位. 中国农业科学, 2005, 38: 217–221. Qiao Y L, Han L Z, An Y P, Zhang Y Y, Cao G L, Koh H J. Molecular mapping of QTLs for cold tolerance at the bud bursting period in rice., 2005, 38: 217–221 (in Chinese with English abstract).
[23] 陈玮, 李炜. 水稻RIL群体芽期耐冷性基因的分子标记定位. 武汉植物学研究, 2005, 23: 116–120. Chen W, Li W. Mapping of QTL conferring cold tolerance at early seeding stage of rice by molecular markers., 2005, 23: 116–120 (in Chinese with English abstract).
[24] 张露霞, 王松凤, 江铃, 万建民. 利用重组自交系群体检测水稻芽期耐冷性QTL. 南京农业大学学报, 2007, 30(4): 1–5. Zhang L X, Wang S F, Jiang L, Wan J M. QTL analysis of cold tolerance at the bud bursting period in rice (L.) by using recombinant inbred lines., 2007, 30(4): 1–5 (in Chinese with English abstract).
[25] 巩迎军, 阮雯君, 荀星, 董彦君, 林冬枝, 叶胜海, 张小明. 水稻芽性状耐冷性的QTL分析. 分子植物育种, 2009, 7: 273–278. Gong Y J, Ruan W J, Xun X, Dong Y J, Lin D Z, Ye S H, Zhang X M. QTL analysis of cold tolerance for two bud traits in rice., 2009, 7: 273–278 (in Chinese with English abstract).
[26] 林静, 朱文银, 张亚东, 朱镇, 赵凌, 陈涛, 赵庆勇, 周丽慧, 方先文, 王艳平. 利用染色体片段置换系定位水稻芽期耐冷性QTL. 中国水稻科学, 2010, 24: 233–236. Lin J, Zhu W Y, Zhang Y D, Zhu Z, Zhao L, Chen T, Zhao Q Y, Zhou L H, Fang X W, Wang Y P. Detection of quantitative trait loci for cold tolerance at the bursting stage by using chromosome segment substitution lines in rice ()., 2010, 24: 233–236 (in Chinese with English abstract).
[27] Baruah A R, Ishigo-Oka N, Adachi M, Oguma Y, Tokizono Y, Onishi K, Sano Y. Cold tolerance at the early growth stage in wild and cultivated rice., 2009, 165: 459–470.
[28] Ji Z J, Zeng Y X, Zeng D L, Ma L Y, Li X M, Liu B X, Yang C D. Identification of QTLs for rice cold tolerance at plumule and 3-leaf-seedling stages by using QTL Network software., 2010, 17: 282–287.
[29] 周勇, 朱孝波, 袁华, 郑英, 钦鹏, 魏应海, 王玉平, 黄世君, 李仕贵. 水稻单片段代换系芽期和苗期耐冷性分析及耐冷性QTL鉴定. 中国水稻科学, 2013, 27: 381–388. Zhou Y, Zhu X B, Yuan H, Zheng Y, Qin P, Wei Y H, Wang Y P, Huang S J, Li S G. Characterization of cold tolerance and identification of cold tolerance QTLs for rice single segment substitution lines at plumule and seedling stages., 2013, 27: 381–388 (in Chinese with English abstract).
[30] 杨洛淼, 王敬国, 刘化龙, 孙健, 郑洪亮, 邹德堂. 寒地粳稻发芽期和芽期的耐冷性QTL定位. 作物杂志, 2014, (6): 44–51. Yang L S, Wang J G, Liu H L, Sun J, Zheng H L, Zou D T. QTL mapping of cold tolerance for the germination period and the bud bursting period ofin cold area., 2014, (6): 44–51 (in Chinese with English abstract).
[31] 朱金燕, 杨梅, 嵇朝球, 王军, 杨杰, 范方军, 李文奇, 王芳权, 梁国华, 周勇, 仲维功. 利用染色体单片段代换系定位水稻芽期耐冷QTL. 植物学报, 2015, 50: 338–345. Zhu J Y, Yang M, Ji C Q, Wang J, Yang J, Fan F J, Li W Q, Wang F Q, Liang G H, Zhou Y, Zhong W G. Identification of cold tolerance at the plumule stage quantitative trait loci with single segment substituted lines in rice., 2015, 50: 338–345 (in Chinese with English abstract).
[32] Yang T F, Zhang S H, Zhao J L. Liu Q, Huang Z H, Mao X X, Dong J F, Wang X F, Zhang G Q, Liu B. Identification and pyramiding of QTLs for cold tolerance at the bud bursting and the seedling stages by use of single segment substitution lines in rice (L.)., 2016, 36: 96.
[33] Zhang M C, Ye J, Xu Q, Feng Y, Yuan X P, Yu H Y, Wang Y P, Wei X H, Yang Y L. Genome-wide association study of cold tolerance of Chineserice varieties at the bud burst stage., 2018, 37: 529–539.
[34] Huang X, Feng Q, Qian Q, Zhao Q, Wang L, Wang A, Guan J, Fan D, Weng Q, Huang T. High-throughput genotyping by whole-genome resequencing., 2009, 19: 1068–1076.
[35] Jiang S, Yang C, Xu Q, Wang L, Yang X, Song X, Wang J, Zhang X, Li B, Li H, Li Z, Li W. Genetic dissection germinability under low temperature by building a resequencing linkage map inrice., 2020, 21: 1284.
[36] 韩龙植, 魏兴华. 水稻种质资源描述规范和数据标准. 北京: 中国农业出版社, 2006. p 107. Han L Z, Wei X H. Descriptors and Data Standard for Rice (L.). Beijing: China Agriculture Press, 2006. p 107.
[37] Arends D, Prins P, Jansen R, Broman K. R/QTL: high-throughput multiple QTL mapping., 2010, 26: 2990–2992.
[38] 姜树坤, 张凤鸣, 白良明, 孙世臣, 王彤彤, 丁国华, 姜辉, 张喜娟. 水稻移栽后新生根系相关性状的QTL分析. 中国水稻科学, 2014, 28: 598–604. Jiang S K, Zhang F M, Bai L M, Sun S C, Wang T T, Ding G H, Jiang H, Zhang X J. QTL analysis on new root traits after rice transplanting., 2014, 28: 598–604 (in Chinese with English abstract).
[39] Yu H, Xie W, Wang J, Xing Y, Xu C, Li X, Xiao J, Zhang Q. Gains in QTL detection using an ultra-high density SNP map based on population sequencing relative to traditional RFLP/SSR markers., 2011, 6: e17595.
[40] Gao Z Y, Zhao S C, He W M, Guo L B, Peng Y L, Wang J J, Guo X S, Zhang X M, Rao Y C, Zhang C, Dong G J, Zheng F Y, Lu C X, Hu J, Zhou Q, Liu H J, Wu H Y, Xu J, Ni P X, Zeng D L, Liu D H, Tian P, Gong L H, Ye C, Zhang G H, Wang J, Tian F K, Xue D W, Liao Y, Zhu L, Chen M S, Li J Y, Cheng S H, Zhang G Y, Wang J, Qian Q. Dissecting yield-associated loci in super hybrid rice by resequencing recombinant inbred lines and improving parental genome sequences., 2013, 110: 14492–14497.
[41] Jiang N, Shi S, Shi H, Khanzada H, Wassan G M, Zhu C, Peng X, Yu Q, Chen X, He X, Fu J, Hu L, Xu J, Ou-Yang L, Sun X, Zhou D, He H, Bian J. Mapping QTL for seed germinability under low temperature using a new high-density genetic map of rice., 2017, 8: 1223.
[42] Liu H, Niu Y, Gonzalez-Portilla P J, Zhou H, Wang L, Zuo T, Qin C, Tai S, Jansen C, Shen Y, Lin H, Lee M, Ware D, Zhang Z, Lübberstedt T, Pan G. An ultra-high-density map as a community resource for discerning the genetic basis of quantitative traits in maize., 2015, 16: 1078.
[43] Song W, Wang B, Hauck A L, Dong X, Li J, Lai J. Genetic dissection of maize seedling root system architecture traits using an ultra-high density bin-map and a recombinant inbred line population., 2016, 58: 266–279.
[44] Zou G, Zhai G, Feng Q, Yan S, Wang A, Zhao Q, Shao J, Zhang Z, Zou J, Han B, Tao Y. Identification of QTLs for eight agronomically important traits using an ultra-high-density map based on SNPs generated from high-throughput sequencing in sorghum under contrasting photoperiods., 2012, 63: 5451–5462.
[45] 姜树坤, 徐正进, 陈温福. 水稻QTL图位克隆的特征分析. 遗传, 2008, 30: 1121–1126. Jiang S K, Xu Z J, Chen W F. Analysis of features of 15 successful positional cloning of QTL in rice.(Beijing), 2008, 30: 1121–1126 (in Chinese with English abstract).
[46] Jiang S K, Huang C, Zhang X J, Wang J Y, Xu Z J, Chen W F. Development of a high informative microsatellite markers (SSRs) framework for genotyping of rice (L.)., 2010, 9: 1697–1704.
[47] Liu K M, Wang L, Xu Y Y, Chen N, Ma Q B, Li F, Chong K. Overexpression of, a putative cold inducible zinc finger protein, increased tolerance to chilling, salt and drought, and enhanced proline level in rice., 2007, 226: 1007–1016.
[48] Lourenço T, Sapeta H, Figueiredo D D, Rodrigues M, Cordeiro A, Abreu I A, Saibo N J M, Oliveira M M. Isolation and characterization of rice (L.) E3-ubiquitin ligasegene in the modulation of cold stress response., 2013, 83: 351–363.
[49] Mao D H, Chen C Y. Colinearity and similar expression pattern of ricereveal their functional conservation in the cold-responsive pathway., 2012, 7: e47275.
Detection of QTLs controlling cold tolerance at bud bursting stage by using a high-density SNP linkage map inrice
JIANG Shu-Kun1,*, WANG Li-Zhi1, YANG Xian-Li1, LI Bo2, MU Wei-Jie3, DONG Shi-Chen3, CHE Wei-Cai3, LI Zhong-Jie1, CHI Li-Yong1, LI Ming-Xian1, ZHANG Xi-Juan1, JIANG Hui2, LI Rui1, ZHAO Qian1, and LI Wen-Hua2,*
1Institute of Crop Cultivation and Tillage, Heilongjiang Academy of Agricultural Sciences / Heilongjiang Provincial Key Laboratory of Crop Physiology and Ecology in Cold Region / Heilongjiang Provincial Engineering Technology Research Center of Crop Cold Damage, Harbin 150086, Heilongjiang, China;2Heilongjiang Academy of Agricultural Sciences, Harbin 150086, Heilongjiang, China;3Life Science and Technology College, Harbin Normal University, Harbin 150025, Heilongjiang, China
Direct seeded rice (DSR) has received much attention because of its time- and labour-saving and low-input demand. However, the long-term cultivation method of seedling-transplantation has led to loss of some low-temperature-tolerant genes expressed at the bud stage. It has made many currently popular rice varieties unsuitable for direct seeding production. Therefore, it is important to identify cold-tolerance genes at the bud stage and to provide genes for subsequent molecular marker assistant breeding. In this study, we used a recombinant inbred line population constructed by cross of Lijiangxintuanheigu (LTH) and Shennong 265 (SN265) and its linkage map containing 2818 markers to detect cold tolerance QTLs at the bud stage. A total of five QTLs were detected on rice chromosomes 1, 3, 9, and 11. All the cold tolerance alleles were from the cold-tolerant parent LTH. The LOD values of these QTLs ranged from 3.05 to 24.01, and the phenotypic variations ranged from 8.0% to 53.5%. Among them, the major QTLwas located in a 790 kb interval of 21.24 Mb to 22.03 Mb on the long arm of chromosome 11. Subsequently, the “selective mapping” strategy was used for QTL verification and pyramiding effect analysis. Genetic improvement of cold tolerance at the bud stage would be achieved through pyramiding more QTLs. These results not only promote people’s understanding of the genetic basis for cold tolerance at the bud stage in rice but also provide theoretical basis and technical guidance for genetic improvement of DSR varieties.
rice; cold tolerance at bud bursting stage; re-sequencing; genetic map; QTLs
10.3724/SP.J.1006.2020.92066
本研究由国家重点研发计划项目(2018YFD0300105-5-2), 国家自然科学基金项目(31661143012), 国家重点研发项目黑龙江省级资助(768001), 黑龙江省自然科学基金优秀青年基金项目(YQ2019C020)和黑龙江省农业科学院长期性基础性项目(2018CQJC002, 2019CQJC002)资助。
This study was supported by the National Key Research and Development Program of China(2018YFD0300105-5-2), the National Natural Science Foundation of China(31661143012), the Provincial Funding for the National Key Research and Development Program in Heilongjiang Province (768001), the Natural Science Foundation of Heilongjiang Province of China (YQ2019C020), and the Heilongjiang Province Agricultural Science and Technology Innovation Project (2018CQJC002, 2019CQJC002).
姜树坤, E-mail:sk_jiang@126.com, Tel: 023-68251264, 李文华, E-mail: nkylwh@163.com
E-mail: sk_jiang@126.com
2019-12-08;
2020-03-24;
2020-04-10.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200410.1430.006.html
