淹水和盐胁迫对降香黄檀植株生理生态特性的影响
2020-07-21姜百惠苗灵凤
姜百惠,丁 扬,苗灵凤,杨 帆
(海南大学 生态与环境学院, 海南 海口 570228)
降香黄檀是慢生树种,在自然生长条件下心材形成较慢. 一棵20年树龄的此树,茎粗大约17~20 cm,其心材约2~5 cm[5]. 由于人类活动以及对其经济和药用价值的过渡开发,此树种已被我国列入重点保护野生植物[2]. 此外,降香黄檀能形成根瘤,在生物固氮和土壤改良上亦发挥着重要的生态作用[8-9]. 因此,扩大其种植范围,是平衡利用与保护,充分发挥其综合效益的可行之举. 在海南有很多滩涂、河流库塘等淡水湿地资源;在一些海岸区域也分布着由于海水漫灌导致的高盐土地,当这些高盐土地遭遇强降水等事件时亦会形成短时间渍水现象,使生长于此地的植物面临盐-水复合胁迫,但此时的盐浓度较降水之前因雨水稀释而降低. 针对降香黄檀的研究主要集中在活性成分的鉴定及药理学研究,非生物胁迫相关研究较少. 目前有学者在温度[10]等方面对降香黄檀展开研究,而针对水淹、盐,特别是两者复合胁迫的研究尚未见报道,关于降香黄檀如何响应水淹、盐,水淹-盐复合胁迫尚不清楚,需要开展此方面研究.
植物的固着性决定了其在生活史期间面临各种各样的环境干扰时,不能采取及时有效的空间逃避策略. 为了经受住短期或者长期干扰,植物采取了从胁迫信号感知与转导、基因选择性表达、蛋白质合成与修饰、代谢状态调整直到表型改变等一系列的应对策略. 这些应对策略因植物种类和耐受性差异而不同,大致涉及胁迫规避、短时间内代谢调整来忍受胁迫,或者通过生理、表型、结构等一系列变化长期适应胁迫等类型.在水淹条件下,陆生植物可以通过糖酵解加速、酶促或非酶促抗氧化物质积累等代谢状态的调整短时间应对水淹导致的根部氧气匮乏以及由此带来的部分根系功能障碍,有些植物还能通过形成不定根、通气组织等诱导结构来改变氧气匮乏状态甚至适应水淹环境[11]. 植物在应对土壤盐分导致的渗透胁迫时,也会积累抗氧化物质以及有机渗透保护物质,如脯氨酸、糖等,来保护细胞结构和细胞代谢的相对稳定[12-13]. 不管是处于水淹环境还是土壤高盐环境,植物根系导水率都会下降,进而影响地上部分组织的水分状态. 叶片水势Ψl和相对含水量(Relative Water Content, RWC)2个与植物水分状态相关的生理指标,经常被用在植物逆境研究中,来反映该植物对不利条件的响应情况[14]. 有研究表明根系导水率的下降会引起Ψl的下降,进而引起叶片气孔关闭,影响气体交换能力[15]. 光合作用是植物最重要的代谢过程之一,逆境胁迫下植物净光合速率除了受光合元件影响之外,还会受到气孔导度gs的影响,而gs除了与Ψl有关外[16],还与脱落酸(ABA)有关,后者对气孔的运动具有调节作用. 因此,植物在应对水淹或盐胁迫时,气孔的运动平衡着碳固定于水分散失之间的微妙平衡,对植物应对胁迫至关重要. 除了ABA之外,生长素(IAA)、玉米素核苷(ZR)以及赤霉素(GA3)等植物激素也广泛用于植物逆境研究中[17].
笔者设计4组实验针对3个问题展开研究:1)降香黄檀幼苗对水淹、盐及两者组合胁迫的耐受性;2)降香黄檀幼苗如何在光合、水分以及激素等生理水平响应水淹、盐及两者组合胁迫;3)不同条件下的响应差异.
1 材料与方法
1.1 研究材料将产于海南乐东的一年生降香黄檀实生苗在距根10 cm处剪断后,栽种于塑料盆(上部直径 × 高 × 下底直径 = 18.5 × 20 × 14 cm)中,土壤条件为:红壤/河沙/椰糠(体积比为2∶2∶1). 栽种之后置于海南大学实验基地(20.02 °N, 110.35 °E)遮阴环境下萌发,待幼芽萌发5 cm左右后置于正常光照条件生长,保证充分的水分和养分. 40 d之后,于2018年11月1日筛选长势基本一致,株高在15 cm左右的幼苗200株,用于后续实验处理.
1.2 实验处理胁迫实验于2018年11月2日正式开始. 实验共分为4个处理,每个处理50株苗,分5个重复,每个重复10株苗,实验共200株苗. 对照组(CKM),每2 d浇一次水,每次浇水至盆底恰好有液体渗出为止;水淹组(WM),将苗盆置入10 L塑料桶中,淹水深度为距离土壤表面5 cm,实验期间每天加水维持这个水淹高度;盐胁迫组(SM),每2天浇一次200 mM NaCl溶液,每次浇至溶液从盆底部流出,继续浇100 mL,以保证土壤盐浓度维持相对稳定;水淹-盐复合胁迫组(SWM),将苗盆置入与WM相同的塑料桶内,加入100 mM NaCl溶液,淹水高度为5 cm.为了避免SWM处理时水分蒸发引起的溶液浓度逐渐升高,设置一个与胁迫处理相同的塑料桶,加入与SWM相同的盐溶液,每2 d记录一次水位下降高度. 将这些蒸发的水分补充到SWM处理后,余下的继续使用50 mM NaCl溶液补充至实验开始水位(距离土壤表面5 cm). 所有处理的植株随机放置在有塑料薄膜防雨的实验大棚内.
1.3 不同处理下的成活率及形态指标测定实验第30 d,统计各处理组植株存活状况,具体统计方式如下:针对盐胁迫SM和水淹-盐SWM处理的植株自第30 d解除胁迫,然后恢复10 d后统计存活率. 恢复第一天,浇大量清水,将盐分浓度降低,其后与对照组的处理方式一样,每2 d浇一次水. 针对水淹WM的植株,在第30 d统计成活率后继续水淹实验,在第130 d时解除水淹,10 d后开始统计存活率.
在实验开始前和第30植株进行拍照. 第30 d时测量株高、叶面积大小,每个处理10个重复. 叶面积测量使用便携式叶面积仪LI-3000C(LI-COR, USA),选择自顶端起第2片复叶的最顶尖一只叶片进行测量,按照使用说明进行操作.
引理1.1[8] 设f是拓扑空间X到拓扑空间Y的连续函数,若B为X的可数既约闭集,则clYf(B)为Y的可数既约闭集。
1.4 叶片净光合速率和气孔导度测定在实验进行第6 d使用装配有02B红蓝光源的便携式光合仪LI-6400(LI-COR, USA)测定各处理组植株叶片净光合速率Pn和气孔导度gs. 测定时选择自顶端起第2片完全展开的羽状复叶的顶端叶片在上午8∶00~9∶30期间进行,仪器参数设置如下:进气速度500 μmol·s-1,光量子通量密度1 200 μmol/(m-2·s-1). 每个处理5个重复,每个重复1株苗.
1.5 叶片水势和相对含水量测定在清晨5∶00~6∶30期间使用WP4C露点水势仪(LI-COR, USA)依照其使用说明进行测定叶片水势Ψl测定. 测定时选择不同处理条件下植株顶端第2片复叶的最顶端叶片,每个处理5个生物学重复.
叶片相对含水量RWC的测定依照此公式进行
RWC= (FM-DM)/(TM-DM),
其中,TM(Turgid Mass)代表充分吸收水分后的叶片重量;FM(Fresh Mass)代表叶片鲜重;DM(Dry Mass)代表充分干燥脱水后的叶片重量[14]. 测定时选择植株顶端第2片复叶的第2只叶片,每个处理5个生物学重复.
1.6 植物激素测定在实验第6 d取植株第二片羽状叶片,立即放入液氮保存. 每个处理4个重复,每个重复3株苗. 激素提取和纯化参照Bollmark[18]等的方法进行.参照Wang[19]等使用酶联免疫吸附法(ELISA)进行激素含量测定.
1.7 统计方法与数据可视化不同分组间在株高、叶面积、植物激素上的方差分析(P<0.05),相关分析由R基础函数或RPackage实现;数据可视化由RLanguage、Graphpad Prism(Version 8.2.1,GraphPad Software Inc., San Diego, CA, USA)、Adobe Illustrator(Version 24.0.3 (Mac OS), Adobe Inc., USA)共同实现.
2 实验结果
2.1 不同处理条件下的植物生长情况存活率是判断植物对环境胁迫耐受性最直观且重要的指标. 经过30 d的处理,处于盐胁迫和水淹-盐复合胁迫的降香黄檀幼苗有死亡植株出现,且在单一盐胁迫条件下的成活率为83.33%,高于复合胁迫下的66.67%. 而在对照组和水淹胁迫组,没有植株死亡,不难理解,水淹-盐复合胁迫对降香黄檀幼苗造成的伤害最大(如表1所示). 胁迫处理组的植株在株高和叶面积2个指标上,均显著低于对照组的,如图1所示. 水淹、盐条件下的植株在株高和叶面积上无显著差异,且都显著高于复合胁迫条件下的(P<0.05).
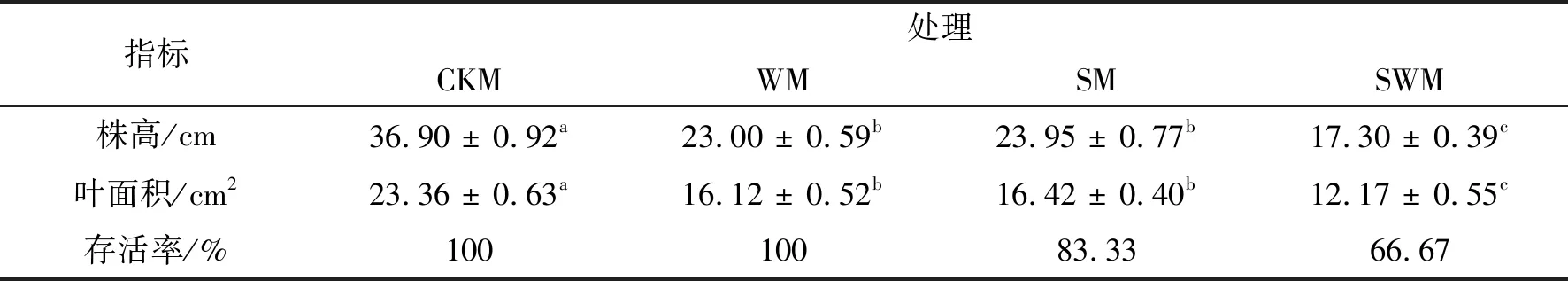
表1 降香黄檀在不同处理条件下第30 d株高、叶面积及存活率统计
除此之外,在盐胁迫、水淹-盐复合胁迫条件下的植株,在实验30 d后,叶片颜色变黄,且在复合条件下的植株部分出现叶片黄斑并萎蔫落叶的现象,如图2所示.

CKMWMSMSWM0 d30 d图1 不同处理条件下降香黄檀幼苗在实验刚开始以及实验第30 d的生长照片
水淹前期阶段,降香黄檀茎干生长缓慢,顶端逐渐木质化不再有新叶萌发. 在水淹50 d左右时,可以观察到绝大多数植株都在水淹的根部有不定根生成,随着水淹的继续,不定根越来越多. 70 d时,所有水淹的植株均形成不定根,且有植株在木质化的茎尖开始有幼芽萌发. 在130 d水淹实验结束时,在所有水淹植株都可以观察到新萌发的幼芽,且长势相对较好,如图2所示.

图2 降香黄檀幼苗在水淹130 d的生长照片
2.2 叶片净光合速率和气孔导度变化在实验第6 d时,胁迫组的植株叶片净光合速率Pn以及气孔导度gs都较对照组的显著下调(P<0.05),如图3所示. 水淹组(WM)和盐处理组(SM)在Pn上无显著差异,且均显著高于水淹-盐复合胁迫组(SWM)的. SM和SWM中的植株在gs上无显著差异,且均显著低于WM组的. 影响净光合速率的因素有很多,可归纳为气孔因素和非气孔因素. 此处,胁迫处理下,gs的下调导致一定程度上Pn的降低.

图3 不同处理条件下降香黄檀幼苗在实验第6 d的净光合速率Pn和气孔导度gs
2.3 叶片水势与相对含水量变化水势和相对含水量的变化反映着不同处理条件下植物叶片的水分状态. 与对照组CKM相比,WM中的植株经历6 d水淹处理后叶片水势Ψl没有显著变化,而盐处理组SM和水淹-盐复合胁迫组SWM中Ψl则显著下降(P<0.05). 此外,SM和SWM处理6 d后,植株Ψl没有显著差异(P<0.05), 如图4所示.
与对照组CKM中植株叶片相对含水量RWC相比,实验进行6 d后,所有处理均降低了降香黄檀幼苗叶片RWC(P<0.05),如图4所示. 且水淹处理后的叶片RWC显著高于盐、水淹-盐复合胁迫处理后的,盐、水淹-盐复合胁迫处理之间在RWC上无显著差异(P<0.05).
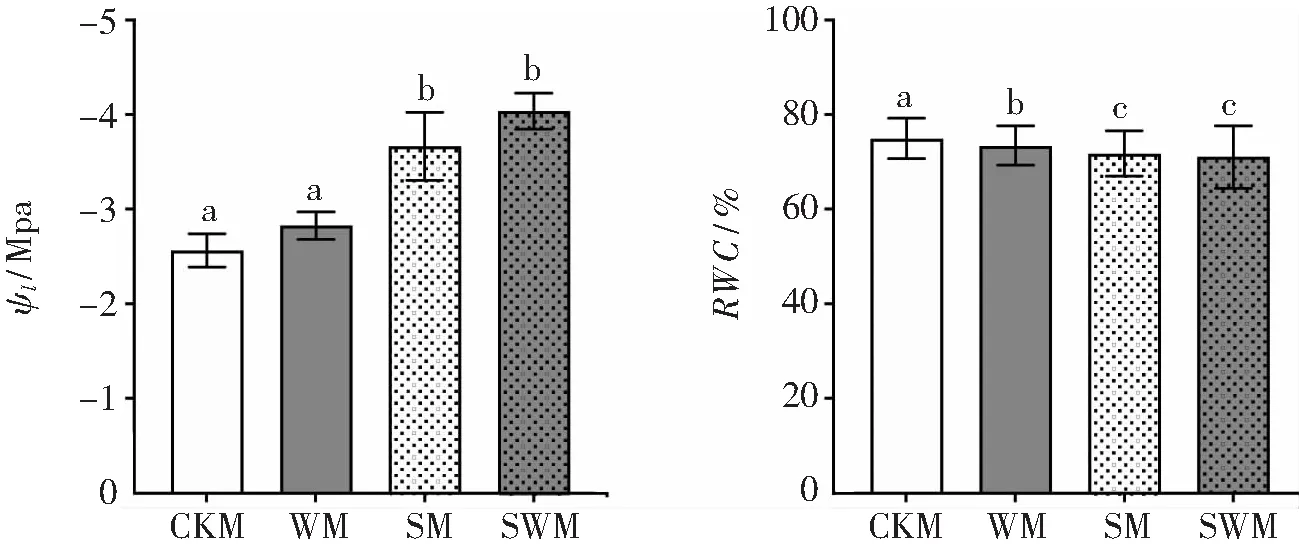
图4 不同胁迫条件下降香黄檀叶片水势Ψl和相对含水量RWC
2.4 气孔导度与净光合速率、叶片水势相关性分析叶片水势对叶片气孔的运动有着调控作用,进而影响叶片gs和Pn. 为了研究其相关程度,以及不同处理条件下,造成Pn及gs差异的主要因素,在此对Pn与gs,以及Ψl与gs之间的相关性做了分析,如图5所示. 结果显示,各处理间的Ψl的差异几乎是导致其gs差异的全部因素(R2=0.984 0),而gs的差异又成了导致其Pn差异的主要因素(R2=0.936 2,P<0.05).导致组间gs差异的因素可能还有激素在不同处理间的差异;导致组间Pn差异的因素除了gs外,还有一些非气孔因素在不同处理间的差异.
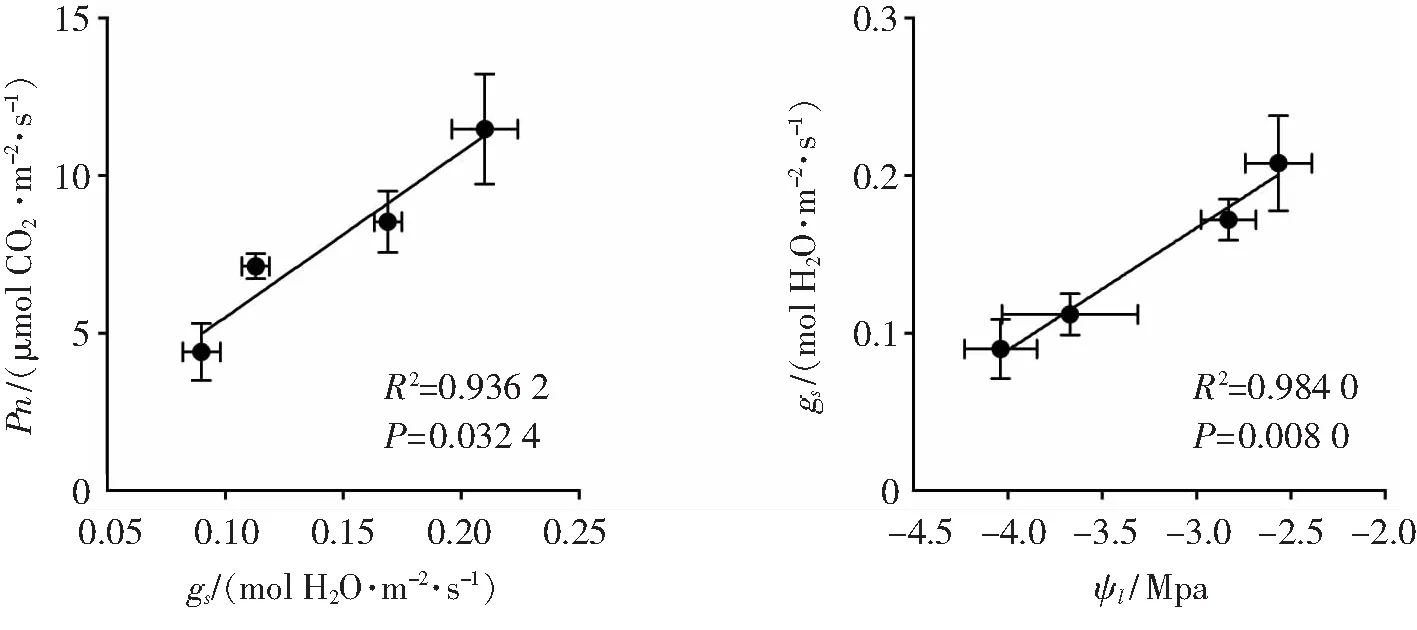
图5 降香黄檀幼苗气孔导度gs与净光合速率Pn以及叶片水势Ψl的相关性
2.5 植物激素水平变化不同类型的胁迫处理对降香黄檀幼苗叶片激素水平的影响存在着差异,如图6所示. 与对照组CKM相比,水淹WM显著降低了其叶片IAA含量,提高了其ABA及GA3含量,而对ZR含量没有显著影响(P<0.05);盐处理SM提高了其叶片IAA,ABA含量,降低了ZR含量,而对GA3含量没有显著影响(P<0.05);水淹-盐复合胁迫对IAA,GA3含量没有显著影响,上调了ABA含量,下调了ZR含量(P<0.05).

图6 不同胁迫处理条件下降香黄檀叶片植物激素水平
具体而言,在SM处理条件下的植株叶片IAA含量显著高于CKM,WM和SWM处理条件下的IAA含量,而SWM处理条件下的IAA含量的又高于WM处理条件下的IAA含量. 虽然水淹降低了IAA含量,盐胁迫上调了该激素含量,但水淹-盐复合处理却与对照组比起来并无显著差异. 因此,不能简单地认为水淹-盐复合胁迫是水淹和盐2种单一胁迫效应的简单叠加. 例如,就ABA含量而言,水淹和盐处理均能提高其含量,然而水淹-盐复合处理对ABA含量上调的影响幅度却小于各自单一胁迫下的. 在ZR水平上,3个胁迫处理之间均无显著差异. 在GA3水平上,水淹处理上调效果明显,其他2个处理对该激素含量变化无显著影响.此外,3个胁迫处理之间的水平存在着显著差异,水淹处理的含量最高,盐处理的最低.
3 讨论
陆生植物在根部水淹的情况下,水分会将土壤空隙中空气排出,土壤微生物活动也会快速消耗剩余氧气,使植物根部处于氧气匮乏状态. 根部有氧呼吸获取的能量是发挥根部功能,进行水分及营养元素吸收与运输的主要能量来源. 为了部分弥补因氧气不足带来的能量匮乏,水淹环境下的根系会启动无氧呼吸来产生能量,但此能量生成效率较低,需要消耗更多的碳水化合物,而且无氧呼吸也会产生很多有毒物质,对根部造成损伤[20]. 这些因素都会导致根系受损及导水率下降,破坏“环境-根系-叶片”水分统一体的平衡,最终也导致了Ψl的降低,进而引起叶片gs和Pn的下降[21]. 过量的有机物消耗再加上受抑制的有机物合成,会引起植物生长受阻. 水淹以及水淹-盐胁迫下的降香黄檀幼苗,gs,Pn和Ψl都显著降低,在株高和叶面积指标上也表明了其生长受到了抑制. 在盐胁迫下,降香黄檀根部会产生生理缺水,引起根系导水率的降低,进而也会导致植株叶片气体交换能力的下降,影响植株的生长.
植物光合作用对植物的生长和发育至关重要,气孔运动与净光合速率密切相关.影响气孔开关的因素除了水分因素之外,ABA也发挥着重要的调控作用. 在此研究中,3种胁迫条件下的叶片ABA含量均显著上升,或许与gs的下降有关系. WM和SM下叶片ABA均显著高于SWM中的,此结果可能源于以下2个因素:1)复合胁迫相对单一胁迫对植株造成的损伤较大,破坏了细胞的代谢,影响了ABA合成及运输等生物过程;2)叶片Ψl和ABA相互协调控制气孔的运动,在复合胁迫时Ψl更低,可能在调控气孔运动中发挥着更多的作用. 除了气孔因素,胁迫造成的叶绿体损伤、叶绿素含量的下降以及磷元素吸收的限制等非气孔因素也会导致光合作用能力的下降[22].
植物激素是植物体内微量但非常重要的一类次生代谢物,在植物生长发育以及环境胁迫的响应中发挥着重要的调控作用[17]. 一般而言,IAA,ZR和GAs 对植物生长具有促进作用,而ABA与之相反. IAA是植物生长素的主要活性成分,主要产生于茎尖和扩展中的幼叶,可通过极性运输自上而下向茎干、根系运输[23],在根部干细胞维持[24]、不定根形成[25]、叶片发育[26]等过程中起着重要的调控作用. 本研究中,水淹条件降香黄檀叶片IAA浓度的降低,可能归因于IAA的叶片和根部再分配,更多的IAA通过极性运输到根部参与响应水淹胁迫的根部形态重塑,之后出现的放大皮孔和不定根等形态的变化可能与此有关. 之前有研究表明IAA极性运输至水淹状态下的根部参与不定根的形成[27].IAA响应盐胁迫的研究较少,其在SM条件下降香黄檀幼苗叶片积累可能是特异性响应盐胁迫的结果;其在SWM条件下的水平与CKM中的无显著差异,且低于SM并高于WM中的水平,可能是水淹和盐2种胁迫因素相互作用的结果. ABA具有倍半萜结构,除了介导气孔运动外,还在植物抗氧化防御[28]、渗透胁迫应答[29]和叶片衰老调控[30]等生理过程中发挥着重要作用. 在水淹、盐以及两者复合胁迫条件下,降香黄檀叶片ABA水平的显著上调(P<0.05),表明其在逆境防御上发挥了作用. 胁迫条件不同导致的上调幅度的差异,说明了ABA响应不同种类非生物胁迫的特异性.
ZR是细胞分裂素的一种,可与生长素协同发挥作用,在促进细胞增殖、调控细胞分化[31]以及延迟蛋白质和叶绿素降解以及不定根生长[32]等方面发挥着重要作用. 许多研究结果表明细胞分裂素可以抑制叶片死亡[33]并促进气孔张开[34],与ABA作用相反. 在水淹胁迫条件下,与对照组相比ZR水平无显著差异,尽在平均值上略微下降;而在盐胁迫和水淹-盐复合胁迫下,ZR水平显著下调(P< 0.05). 结合叶片的气体交换指标的变化,ZR和ABA可能相互作用共同参与了胁迫条件下降香黄檀叶片气孔运动的调控. 此外,亦有研究表明细胞分裂素的过量积累会降低植物的耐盐性[35],降香黄檀在盐胁迫以及水淹-盐胁迫下ZR的下调或许是一种响应策略.
赤霉素通过自身浓度变化调控其信号转导过程中的抑制蛋白DELLA的活性进而调控各种生物学过程[36]:赤霉素浓度较低时,DELLA会与下游关键调控因子结合阻断次霉素信号的传导,例如DELLA可与SCL27作用在拟南芥叶绿体形成、叶片发育中发挥调控作用[37],可结合MYBL2和JAZ1,促进拟南芥花青素合成,提高植物适应[38],还可以下调拟南芥衰老基因的表达来调控其叶片衰老过程[39];赤霉素浓度积累时,DELLA形成蛋白复合体,失去对下游关键因子的抑制作用,如赤霉素可使DELLA降解进而阻止其MYB12,抑制拟南芥根部黄酮醇的合成, 促进其根部发育[40]. GA3是赤霉素的一种,其在不同胁迫条件下的降香黄檀叶片中浓度的差异,与该植物在不同逆境下响应的生物过程差异有关. 降香黄檀叶片GA3在缺氧条件下(WM和SWM)的倾向性积累,表明其参与了根部对低氧胁迫的响应。
降香黄檀幼苗在水淹环境下的存活率和存活时间比在盐和水淹-盐复合条件下表现好,可能采取了以下策略:在前期,通过生理调节来忍受水淹带来的低氧环境,虽然限制了生长,但能存活下来;后期可能通过根部形态重塑—不定根的形成来缓解一部分氧气匮乏状态,减少植株无氧呼吸造成的碳水化合物消耗以及代谢产物的毒副作用. 在水淹后期重新在原本木质化的茎端萌发幼芽,可能源于根部形态的变化. 很多研究都已经证实了水生不定根可以缓解植株在氧气和营养获取等方面的限制,并逐渐适应水淹环境[41-42]. 因此,后期形成的不定根并不能说明降香黄檀是水淹耐受性较强的树种,一些耐水淹植物在水淹开始就长出大量不定根来改变根部通气状态[11]. 不管怎样,降香黄檀能够忍受短期的盐胁迫和长期的水淹环境,可以在一些季节性短时间水淹的环境中扩大种植.
4 小 结
水淹、盐以及复合胁迫对降香黄檀幼苗的生长造成了较大影响. 胁迫条件降低了叶片水势、气孔导度和净光合速率,影响了其碳水化合物的积累,与正常条件下生长的植株相比呈现出较低的株高和较小的叶面积. 就以上指标而言,水淹-盐复合胁迫(100 mM NaCl)对降香黄檀幼苗生长造成的影响最大. 降香黄檀幼苗在叶片激素水平上响应不同胁迫具有特异性,但具体的生理机制还需要进一步研究. 降香黄檀幼苗的存活率在水淹条件(5 cm)依次高于盐胁迫(200 mM NaCl)和水淹-盐复合胁迫条件. 在水淹条件下,降香黄檀幼苗可形成水生不定根,具备一定程度的水淹能耐受能力,可以种植于适宜气候条件下易遭受短时期水淹的区域.
