壳聚糖及其衍生物对连作淮山炭疽病的影响
2020-07-21陈伟益黄东益吴文嫱黄小龙张荣萍
陈伟益,黄东益,吴文嫱,夏 薇,黄小龙,许 云,张荣萍
(海南大学 热带作物学院,海南 海口 570228)
淮山(DioscoreaoppositeTbunb)为薯蓣科薯蓣属草本植物,其块茎含有丰富的淀粉、蛋白质、各种维生素和有益的微量元素,兼有粮食、蔬菜、药用、保健、美容等功能[1].淮山炭疽病是淮山连作过程中需要克服的一大难题,因为连作不仅会导致土壤理化性质变化,而且还会造成土壤病原菌数量过多,致使有益菌减少,从而导致减产、品质下降、发病率提高、经济效益下降等.其中,最具代表性的连作障碍为淮山炭疽病,该病是一种由炭疽菌引起的土传病害,长期连作可使土壤中病原菌的数量积累,在经雨水、灌溉或风力传播后极易引起再次侵染,且其真菌孢子又难以祛除.
淮山炭疽病是一种由炭疽菌引起的土传病害,长期连作使土壤中病原菌的数量积累,经雨水、灌溉或风力传播极易引起再次侵染,真菌孢子又难以祛除.黑鬼淮山成熟期早,口感鲜嫩,产量高但不易采收,且其连作病害常导致产量大幅度下降,为受连作病害影响的代表品种.连作第二年,一般减产20%~30%,重病地块连片落叶或枯死,是制约淮山(山药)可持续发展的难题.
淮山连作病害的防治主要是从农业生态、植物调控、生物、物理、化学等几个方面来进行[7].轮作、间作可调节土壤理化性质,改善土壤的微生物群落;对土壤成分进行测量,按配方施肥,以调节土壤营养;对栽培土壤进行消毒以防线虫、土传病等的危害.化学药剂的效果较好,但对生态环境破坏严重;调理土壤需要较多的人力、物力、时间及先进的技术手段;种植制度的调整需要因地制宜和技术支持,因此如何降低连作病害的影响值得探究.
壳聚糖(chitosans,CS)化学名称为聚葡萄糖胺(1-4)-2-氨基-B-D葡萄糖,又称脱乙酰甲壳素,是由几丁质(chitin)经脱乙酰得到的.壳寡糖(Chitosan Oligosaccharides)又称壳聚寡糖、低聚壳聚糖,是壳聚糖经生物酶技术降解而得到.
壳聚糖及其衍生物对淮山炭疽病的防治效果尚未见报道,其对淮山炭疽病的防治机理暂不明确.为此,本试验采用病原菌离体培养与大田栽培相结合的方式来研究壳聚糖及其衍生物对连作淮山炭疽病的影响,以期为连作淮山的病害防治和淮山产业的发展提供参考.
1 材料与方法
1.1 试验材料试验品种为黑鬼淮山(无搭架);材料有壳聚糖(CS,沪试)、壳寡糖(COS,山东绿陇公司提供)及禾甲安(CTS-N,山东绿陇公司提供,含有4%壳聚糖,2.5%苯扎溴安、10%复合氨基酸、0.1%铜、1.0%锌);从多年连作地块患病植物的体内分离、提纯和鉴定的炭疽病原菌.
1.2 壳聚糖及衍生物对病原菌菌丝伸长的影响
1.2.1 炭疽病原菌的分离、纯化选取田间患病样品,清洗后于病斑与健康组织相间位置切下边长5 mm的方形面积,于70%酒精中消毒20 s,用蒸馏水冲洗3遍,然后于0.1%Hgcl溶液中浸泡60 s,用蒸馏水冲洗3遍,将叶片贴于PDA平板内,28℃培养3~5日,根据菌丝形态特征进行初步筛选,并纯化[13-17].
1.2.2 病原菌验证试验将提纯出来的病原菌做成孢子悬浊液,于28℃振荡培养24 h,然后进行接种.接着将新鲜叶片采下,用解剖针刮伤植物表面,用事先培养好的孢子悬浮液喷洒叶面[18],以无菌吸水纸包裹叶柄,然后将其放入塑封袋防止失水,每3天喷一次无菌水以防止失水.然后再反接回培养皿进行纯化,最后进行检测,若序列基本一致.可以确定此白色菌丝为本地淮山的炭疽病病原菌.
1.2.3 病原菌的鉴定菌丝培养4天左右,进行DNA的提取.采用Chelex法[19]提取病原菌DNA,在560 bp左右出现条带,然后进行一代测序,引物为真菌通用引物.
测序结果拼接序列:ctTCCGTAGGTGAACCTGCGGAGGGATCATTACTGAGTTTACGCTCTACAACCCTTT GTGAACATACCTATAACTGTTGCTTCGGCGGGTAGGGTCTCCGCGACCCTCCCGGCCTCCCGCCTCCGGGCGG GTCGGCGCCCGCCGGAGGATAACCAAACTCTGATTTAACGACGTTTCTTCTGAGTGGTACAAGCAAATAATCA AAACTTTTAACAACGGATCTCTTGGTTCTGGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAAT TGCAGAATTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCGCCAGCATTCTGGCGGGCATGCCTGTTC GAGCGTCATTTCAACCCTCAAGCTCTGCTTGGTGTTGGGGCCCTACAGCTGATGTAGGCCCTCAAAGGTAGTGG CGGACCCTCTCGGAGCCTCCTTTGCGTAGTAACTTTACGTCTCGCACTGGGATCCGGAGGGACTCTTGCCGTAA AACCCCCAATTTTCCAAAGGTTGACCTCGGATCAGGTAGGAATACCCGCTGAACTTAAGCATATcatagagccggagg aa
通过对比可以确定此序列可以代表炭疽菌属,并且其与胶胞炭疽菌(Colletotrichumgloeosporioides)的相似度达到100%,故确定为胶胞炭疽菌.
1.2.4 壳聚糖对病原菌菌丝伸长的影响用菌丝生长速率法测定,在PDA培养基中加入5g/L、7g/L、9g/L、11g/L、13g/L、15g/L的壳聚糖、壳寡糖,并设置CK为1毫升1%的醋酸,各3个重复.将病原菌用打孔器打下直径为6 mm的菌饼,移到培养基中央,封口.28 ℃光照培养,并且每隔12 h测定一次菌落菌丝长度.菌落菌丝长度测量方法[20]:规则菌落直径取平均值,不规则菌落直径取(最长直径+最短直径)/2.计算各个处理的抑菌率,如表1、表2.
抑菌率(growth inhibitory rate GIR)=[1-(d2-菌饼大小)/(d1-菌饼大小)]×100%.
其中d1为CK平板中菌落直径,d2为加有壳聚糖或壳寡糖的平板中菌落直径.
1.2.5 菌丝透射电镜分析经PB固定,酒精、丙酮脱水、丙酮渗透、60 ℃包埋、切片、铀铅双染色,最后进行观察.
1.3 大田病情指数及防治效果的测定选取海南省海口市海南大学海甸校区薯蓣课题组内连作五年以上的和炭疽病发病严重的地块,取土进行浅槽盆栽.于1~2月份进行淮山种薯的处理,每段种薯约50~100 g,将伤口处沾草木灰,于晾干后播种,设8个处理:壳聚糖(CS)2.50 g/L、1.25 g/L、1.00 g/L;壳寡糖(COS)2.50 g/L、1.25 g/L、1.00 g/L;禾甲安(CTS-N)1.00 ml/L,以清水处理为对照CK.进行常规管理,使用有机肥做基肥,并且每月追施一次复合肥料,期间不使用其他任何药品处理.未发病期间每隔2周进行一次处理,并待发病后记录病情指数.
以全株30%以上病叶病斑占全叶面积的比例计算[21-22],其中,0级代表全株无病;1级代表全株10%的叶片感病;2级代表全株11%~30%的叶片感病;3级代表全株31%~45%的叶片感病;4级代表全株46%~60%的叶片感病;5级代表全株61%~80%的叶片感病;6级代表全株81%~95%的叶片感病;7级代表整株叶片几乎全部枯萎或植株死亡.
病情指数=∑(各级病株数×各级级数)/(调查总株数×7)×100.
防治效果=(对照区病情指数-处理病情指数)/对照区病情指数×100.
1.4 数据分析采用Excel、SAS、Origin等软件进行数据分析与整理.
2 结果与分析
2.1 壳聚糖及壳寡糖对炭疽病病原菌的抑制作用图1为不同浓度的壳聚糖及壳寡糖对炭疽病病原菌的抑菌率变化曲线,从图1可以看出,处理后炭疽病病原菌的抑制率先升高后降低,浓度对抑菌率的影响较大.图1-A表明,15 g/L壳聚糖的抑菌率最高,5 g/L处理最低,第24小时抑菌率分别达到69.5%和47.5%,差异显著,抑菌效果可持续36 h左右.图1-B表明,壳寡糖的抑菌率比壳聚糖的抑菌率更高,持续效果更长,处理后24 h其抑菌率达到64%~71%,处理后96 h仍能保持13.31%~39.98%的抑菌率,15 g/L处理的抑菌率持续最长,0.5~0.7g/L处理抑菌率持续最低,差异显著.


A壳聚糖抑菌率变化曲线 B壳寡糖抑菌率变化曲线图1 不同浓度壳聚糖处理对炭疽病病原菌的抑菌率变化曲线 [注:图中不同字母表示其差异性(p≤0.05)]

图2 壳寡糖处理后第96小时的炭疽病病原菌示意图
图2为11 g/L的壳寡糖处理后第96天的炭疽病病原菌的示意图,由图2可以看出,与CK相比,在壳寡糖处理后菌丝的生长受到抑制且菌丝颜色变黄,菌落形态不规则.
图3为15 g/L的壳聚糖和壳寡糖分别处理后炭疽病病原菌的微观结构示意图,从图3可以看出,壳寡糖处理后,菌丝形态变化明显,内含物变少,菌丝壁变厚;对照组菌丝形态规则,内含物丰富,代谢物较多;壳寡糖处理后,菌丝形态出现扭曲.
2.2 壳聚糖及壳寡糖对连作淮山炭疽病的防治效果图4为处理后淮山炭疽病的病情发展曲线,图4表明,发病后病情指数随时间快速升高,处理浓度对病情发展有较大影响.其中,2.5 0g/L壳聚糖和1.00 ml/L禾甲安处理的病情指数持续最低,CK处理清水持续最高,差异显著.
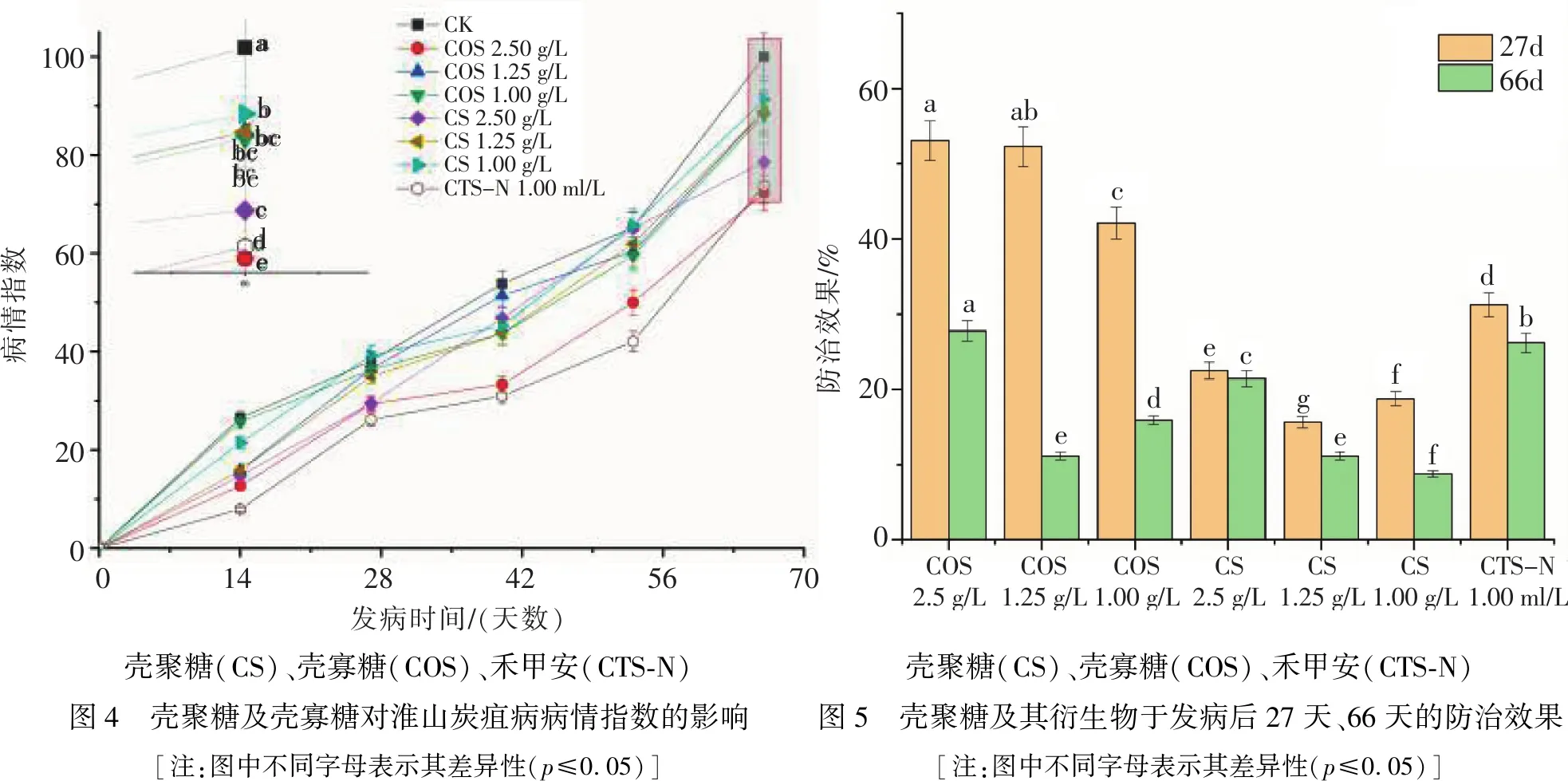
100806040200病情指数01428425670发病时间/(天数)abbcbcbccdeCKCOS2.50g/LCOS1.25g/LCOS1.00g/LCS2.50g/LCS1.25g/LCS1.00g/LCTS-N1.00ml/L6040200防治效果/%aabaedccgeeffdb27d66dCOS2.5g/LCOS1.25g/LCS2.5g/LCS1.25g/LCS1.00g/LCTS-N1.00ml/LCOS1.00g/L壳聚糖(CS)、壳寡糖(COS)、禾甲安(CTS-N)图4 壳聚糖及壳寡糖对淮山炭疽病病情指数的影响[注:图中不同字母表示其差异性(p≤0.05)]壳聚糖(CS)、壳寡糖(COS)、禾甲安(CTS-N)图5 壳聚糖及其衍生物于发病后27天、66天的防治效果[注:图中不同字母表示其差异性(p≤0.05)]
图5为发病后第27天、66天的防治效果,图5表明,壳寡糖的防治效果优于壳聚糖及禾甲安的防治效果,且其效果随处理浓度的降低而降低,2.50 g/L壳寡糖与1.00 ml/L禾甲安的防治效果持续最长,差异显著.
如图6,处理过后,2.50 g/L壳聚糖处理中炭疽病病斑数较CK处理的数量明显减少,在2.5 g/L壳寡糖处理中,其病斑几乎不可见.

CK(左),壳寡糖(COS中),壳聚糖(CS右)图6 同处理后淮山叶片示意图
3 讨论与结论
3.1 讨 论本试验初步得出,壳聚糖及壳寡糖可以抑制病原菌菌丝伸长,改变菌丝结构,处理24 h后抑菌率分别达到69.5和71%,抑菌持效期分别达36 h和84 h以上.抑制效果最好的为15 g/L壳寡糖,96 h后抑菌率仍可达39.98%;用壳聚糖、壳寡糖、禾甲安喷施处理连作淮山后,能有效抑制淮山大田炭疽病的发生,2.50 g/L壳寡糖和1.00 ml/L禾甲安处理的病情指数持续最低,在发病后第27天和第66天,防治效果依次为53.10、31.25和27.77、26.19.
壳聚糖及其衍生物对淮山连作炭疽病的防治具有显著效果,2.50 g/L壳寡糖的防治效果最好.尹恒[17]等指出,壳寡糖对油菜菌核病的最佳浓度为50 g/L;康云艳[18]等指出,0.4 mg/L壳寡糖降低了菜薹立枯病的危害;叶磊等提出[19]由于壳聚糖及壳寡糖分子量的不同而导致了其效果存在差异.本试验得出的抗病最佳浓度与前人的结论存在差异,这可能是由于病原菌的种类或壳聚糖及壳寡糖的分子量或脱乙酰度的不同而导致的.
壳聚糖及壳寡糖对炭疽病病原菌有显著的抑制效果,15 g/L壳寡糖 48小时的抑菌率达到49.55%.胡国元[20]等得出:15 g/L壳寡糖在48 h时对烟草赤星病病原菌的抑制效果最优,达到94.74%以上,这与本试验研究的结果相同.马增新[21]通过4种青霉菌处理在离体实验中得出,壳聚糖的抑菌效果优于壳寡糖,但是对不同种菌的影响存在一定差异,其对炭疽病病原菌的抑菌率低于其对赤星病病原菌的抑菌率,这可能是由于菌种的不同而导致的.
壳聚糖抑菌持效期低于相同浓度的壳寡糖抑菌持效期.通过对病原菌的离体培养得出,一周一次施用壳寡糖或禾甲安即可保证其防治效果;与其衍生物相比,壳聚糖对病原菌的持效期较短,易导致二次侵染或病害的大发生,一周内需要处理多次或适当调高处理浓度,才能保证其防治效果.但刘宝平等[22]对水稻白叶枯和细条病的研究证明,壳聚糖抑菌效果会随浓度的增加而增加,但达到某一浓度后,浓度继续增加其效果则会下降,因此壳聚糖的浓度增加需要有一定的理论支持.
壳聚糖及壳寡糖可通过改变细胞膜的通透性来改变细胞壁结构,从而影响细胞的正常新陈代谢,最终达到对病原菌菌丝伸长的抑制效果,这与Liu J[23-25]等人的研究结果一致.壳聚糖及其衍生物还可抑制孢子萌发[26],阻止患病植株病情的剧烈恶化以及二次扩散,从而达到对淮山炭疽病的防治.
3.2 结 论本实验表明:壳聚糖及其衍生物对淮山炭疽病的防治有显著效果,2.50 g/L壳寡糖的防治效果最好,达50%以上,15 g/L壳寡糖的抑菌率最高,96 h后抑菌率仍可达39.98%,壳聚糖及壳寡糖可通过抑制病原菌菌丝的伸长而改变菌丝结构,实现对连作淮山炭疽病的防治,其他防治机理尚有待后续研究.
