异甘草酸镁对刀豆蛋白A诱导的急性肝衰竭小鼠模型的影响
2020-07-21高钰迪张向颖张晓慧段钟平
高钰迪,田 原,张向颖,张晓慧,段钟平,任 锋,陈 煜
首都医科大学附属北京佑安医院,a.疑难肝病及人工肝中心,肝衰竭与人工肝治疗研究北京市重点实验室;b.北京市肝病研究所,北京 100069
急性肝衰竭是由病毒感染、化学物质损伤及自身免疫反应等多种原因引起的严重临床症候群,是多种肝脏疾病的终末阶段。其起病急、病死率高,内科综合治疗效果不佳,外科治疗限制因素多,是严峻的全球性健康问题,其中肝脏的免疫反应是发病机制的关键[1]。刀豆蛋白A(ConA)是提取自大刀豆的植物血凝素,同时具有刺激T淋巴细胞增殖的特性,其诱导的免疫性肝损伤模型可以较好地模拟病毒性肝炎、自身免疫性肝病等肝脏疾病的免疫学机制,是目前应用非常普遍的肝病模型之一[2]。异甘草酸镁(MgIG)是第四代甘草酸类药物,具有优良的抗炎、抗氧化作用,广泛应用于肝病的临床治疗[3-5]。研究[6-7]表明MgIG可通过调节多种信号转导通路缓解多种因素所致肝损伤,而对ConA诱导免疫性肝损伤的急性肝衰竭模型的作用尚无较深入研究。本研究通过MgIG对ConA诱导急性肝衰竭小鼠模型的影响,进一步探究其对急性肝衰竭发病机制中肝脏免疫反应可能的保护机制,为急性肝衰竭的内科临床诊治及新一代甘草酸药物的临床应用提供新思路。
1 材料与方法
1.1 材料 健康BALB/C小鼠,雄性,8~12周,体质量20~25 g,购自维通利华生物有限公司,在首都医科大学附属北京佑安医院饲养。MgIG药物由江苏省正大天晴股份有限公司提供;ConA购自美国西格玛公司(Sigma);TUNEL试剂盒购自美国罗氏生物制药公司(Roche);caspase3活性试剂盒购自碧云天生物公司(Beyotime);预混液相芯片试剂盒购自德国默克公司(Merck)。
1.2 小鼠免疫性肝损伤模型建立 90只小鼠随机分为4组,分别为对照组、MgIG对照组,每组各10只;ConA模型组、MgIG+ConA预处理组,每组各35只(其中的15只用来计算总生存率)。12 h禁食处理后,对照组小鼠腹腔注射PBS缓冲液(pH=7.20)处理;MgIG对照组小鼠采用腹腔注射(30 mg/kg)MgIG[8];ConA模型组小鼠尾静脉注射ConA(20 mg/kg)建模;MgIG+ConA预处理组小鼠于ConA建模前2 h给予MgIG(30 mg/kg)腹腔注射预处理,根据转氨酶升高水平判断建模效果。
1.3 标本采集 模型建立后12 h,戊巴比妥钠麻醉后处死小鼠,取眼球静脉血1.5 ml,3000 r/min离心10 min获取上层血清,-80 ℃保存,送检首都医科大学临床检测中心测定ALT及AST水平。肝脏组织剪去肝叶边缘,取5 mm3经4%多聚甲醛固定制作石蜡切片待用。取3 mm3于液氮保存制作冰冻切片待用。
1.4 肝脏标本HE染色 模型建立后,取肝组织浸泡于4%多聚甲醛中,石蜡包埋,制备5 μm厚度切片,二甲苯脱蜡,梯度乙醇浸泡,苏木素及伊红水溶液染色,光学显微镜以100及200倍数观察,并进行病理评分。评分标准如下:肝小叶结构完整,未见肝细胞肿胀变性、坏死及炎症细胞浸润,计1分;肝小叶结构基本完整,肝细胞局限性变性、点状坏死,偶见炎症细胞浸润,计2分;肝小叶结构改变,肝细胞弥散性变性、肿胀、碎片状坏死,局限性炎症细胞浸润,计3分;肝小叶结构紊乱,肝细胞变性肿胀明显,亚大块或大块坏死,大量炎症细胞浸润,计4分。
1.5 TUNEL法检测肝细胞凋亡 冰冻切片于4%多聚甲醛中固定30 min,0.1% triton-X 100溶液透化,PBS缓冲液冲洗3次,加入荧光标记的TUNEL混合物,DAPI复染核。荧光显微镜下观测,凋亡细胞呈现红色荧光,细胞核为蓝色荧光,Image J软件计算细胞数目。
1.6 caspase3蛋白活性测定 肝脏组织加入裂解液,冰浴匀浆后离心置于冰上,裂解物4 ℃下18 000×g离心15 min,将上清液移至预冷离心管中。按试剂盒指导手册操作,加入检测缓冲液和Ac-DEVD-pNA混匀,37 ℃下孵育2 h,测定样品A405,根据标准曲线计算相应的蛋白活性。
1.7 蛋白印迹法检测caspase3蛋白表达 肝组织置于1 ml组织裂解液中,电动匀浆器匀浆,4 ℃下3000 r/min离心5 min取上清液,-80 ℃储存。BCA蛋白定量法根据吸光度计算蛋白质浓度。SDS-PAGE凝胶电泳,30 V电压下转膜12 h至PVDF膜,5%牛奶封闭,1∶1000第一抗体孵育过夜;TBST洗膜,1∶2000第二抗体孵育1.5 h。洗膜后加入增强化学发光液曝光。扫描胶片,Image J软件分析目标条带灰度值。
1.8 液相芯片法测定小鼠血清炎症因子 模型建立后,取小鼠外周血以3000 r/min的速度4 ℃下离心10 min,分离上层血清,使用预混液相芯片试剂盒,按试剂盒指导手册操作,Luminex 200系统上机检测。
1.9 伦理学审查 本研究方案经由首都医科大学实验动物伦理委员会审批,符合实验室动物管理与使用准则。
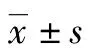
2 结果
2.1 小鼠生存率 从ConA模型组与MgIG+ConA预处理组小鼠中各随机选取15只,共观察72 h。ConA模型组小鼠于给药6 h后开始死亡,共死亡9只;MgIG+ConA预处理组小鼠于给药12 h后开始死亡,共死亡3只。直接概率法计算ConA模型组小鼠总生存率为40%,MgIG+ConA预处理组小鼠总生存率为80%(图1)。
2.2 小鼠ALT和AST水平 ConA模型组小鼠转氨酶水平较对照组显著上升(P值均<0.05),经MgIG预处理小鼠转氨酶水平较ConA模型组小鼠明显降低(P值均<0.05)(表1)。结果表明MgIG对ConA诱导的小鼠免疫性肝损伤存在保护作用。
2.3 小鼠肝脏组织学变化 模型建立后,根据建模效果,选取对照组及MgIG对照组各8只、ConA模型组与MgIG+ConA预处理组各12只进行下一步实验。取肝脏组织经HE染色后观察小鼠肝组织。对照组小鼠及MgIG对照组小鼠肝组织结构清晰,肝细胞形态规整,呈多边形,围绕中心静脉规则排布围成肝小叶,肝组织无淤血。经ConA处理12 h后,小鼠肝小叶内淤血明显,肝组织呈大块及亚大块坏死,肝细胞肿胀、排列紊乱,大量炎症细胞浸润。MgIG预处理组较之ConA模型组,肝组织淤血减轻,肝组织坏死区域明显减小,仅有少量炎症细胞浸润,细胞形态大致正常(图2,3)。对照组、MgIG对照组、ConA模型组及MgIG+ConA预处理组病理评分分别为1.0±0.2、1.2±0.3、3.7±0.6、2.3±0.5,4组间比较差异有统计学意义(F=2.7,P<0.05),对照组与MgIG对照组间比较无统计学意义(P>0.05),余各组间比较结果均具有统计学意义(P值均<0.05)。

表1 各组小鼠血清转氨酶水平
2.4 小鼠肝组织TUNEL染色 冰冻切片染色后,观察小鼠肝组织,计数胞核深染红色荧光的细胞所占比例。对照组与MgIG对照组凋亡细胞较少,凋亡细胞所占比例差异无统计学意义(P>0.05)。ConA模型组小鼠肝细胞凋亡水平明显升高,经MgIG+ConA预处理的小鼠肝细胞凋亡减少,对照组、MgIG对照组、ConA模型组及MgIG+ConA预处理组中每100个细胞中凋亡细胞数值分别为0.2±0.1、0.1±0.1、7.8±1.3、2.2±0.4,4组间比较差异有统计学意义(F=27.6,P<0.001)。对照组与MgIG对照组间比较无统计学意义(P>0.05),余各组间比较结果均具有统计学意义(P值均<0.05)(图4)。
2.5 小鼠肝脏caspase-3总蛋白表达及其活性 肝组织匀浆后采用免疫印迹法检测caspase-3总蛋白表达水平,caspase-3活性试剂盒测定其蛋白活性。与对应组内参β-actin的相对值比较,4组小鼠caspase-3总蛋白表达水平无明显差异。在caspase-3活性检测中,对照组及MgIG对照组caspase-3活性较低,ConA干预组小鼠肝组织caspase-3蛋白活性明显升高,经MgIG预处理后,caspase-3活性较之ConA组下降,对照组、MgIG对照组、ConA模型组及MgIG+ConA预处理组中caspase-3活性分别为0.813±0.022、0.930±0.033、1.347±0.042、1.060±0.053,4组间比较差异均有统计学意义(F=51.072,P<0.001),对照组与MgIG对照组间比较无统计学意义(P>0.05),余各组间比较结果均具有统计学意义(P值均<0.05)(图5)。以上数据表明MgIG预处理降低了ConA干预后肝细胞凋亡蛋白的活化水平。
2.6 小鼠血清促炎性细胞因子水平 模型建立后,取小鼠外周血离心分离血清,预混试剂盒及Luminex 200系统检测小鼠血清IL-1β和TNFα表达水平。结果表明,对照组及MgIG对照组血清促炎性细胞因子水平较低,ConA建模后小鼠血清中促炎性细胞因子IL-1β和TNFα与对照组比较明显上升(P值均<0.05),而MgIG预处理降低了ConA诱导的促炎性因子水平上升,与ConA模型组比较,差异均有统计学意义(P值均<0.05)(表2)。结果表明MgIG可显著降低ConA诱导的小鼠血清中促炎性细胞因子IL-1β和TNFα水平。
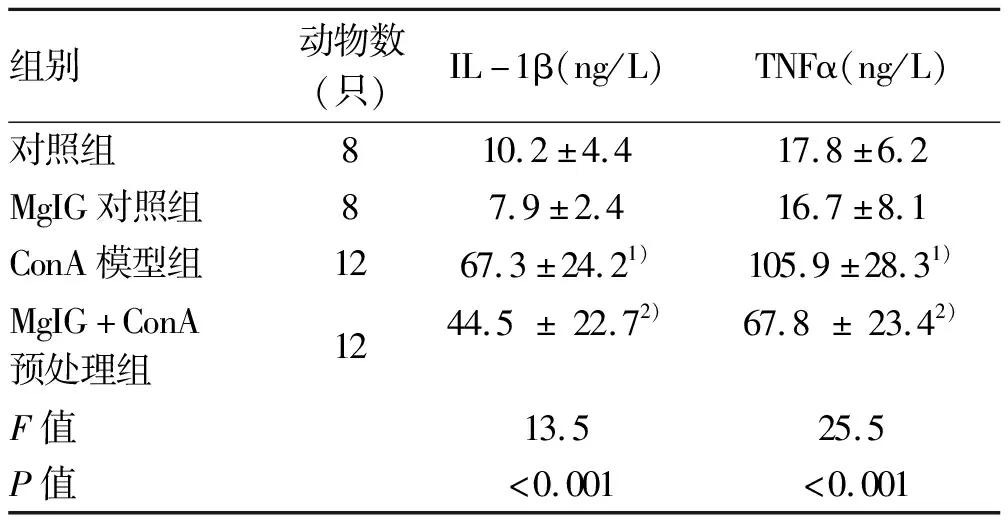
表2 4组小鼠血清促炎性细胞因子水平
3 讨论
急性肝衰竭是由多种因素导致的肝脏解毒、合成、排泄及生物转化功能损伤和失代偿,是高度凶险的临床症候群,以凝血功能障碍、黄疸、肝性脑病为主要表现,起病急骤,病死率极高。在我国,急性肝衰竭的主要病因为病毒性肝炎、药物性肝损伤、自身免疫性肝病及遗传代谢性肝病等,肝细胞病理呈大块或亚大块状坏死,存活肝细胞严重变性。治疗方式以内科综合治疗基础上对症治疗为主,尚缺乏特效药物及手段,近年来人工肝治疗及肝移植逐渐应用于临床,但其设备要求高,肝源稀少限制了急性肝衰竭整体治疗效果[1,4]。急性肝衰竭损伤过程中,肝脏炎症的发生发展发挥了关键性作用,包括Kupffer细胞在内的大量免疫细胞分泌多种细胞因子,大量促炎性介质引发的细胞因子风暴介导肝脏内的免疫反应,加重肝脏炎症,是促进肝细胞损伤的重要环节[9]。细胞凋亡及坏死是肝衰竭的典型病理表现,Kupffer细胞等免疫细胞释放的TNFα和IL-6可激活STAT3信号通路并诱导caspase家族蛋白的表达,导致细胞凋亡[10]。IL-1β与TNFα也是损伤肝脏细胞的重要促炎因子,应用抗TNFα抗体可显著缓解ConA诱导的肝损伤[11]。而ConA具有选择性刺激T淋巴细胞增殖作用,诱导肝脏免疫反应激活,募集CD4+T淋巴细胞、Kupffer细胞等功能性免疫细胞聚集于肝门区,释放大量炎症因子攻击肝组织,导致肝细胞凋亡、坏死,肝组织受损[2,12-13]。其诱导的免疫性肝损伤可以较好地模拟病毒性肝炎、自身免疫性肝病及肝衰竭病理生理过程中的肝内免疫反应。
MgIG是第四代甘草酸类药物,结构类似糖皮质激素,研究[14-16]表明其抗炎、降酶效果好,对病毒性肝炎、药物性及酒精性肝病等多种肝脏疾病具有较好疗效,可通过调节MAPK、核因子-кB等炎症反应相关通路缓解肝脏炎症。本研究结果显示MgIG可显著降低ConA诱导肝损伤小鼠血清转氨酶水平,减少肝组织坏死,明显改善肝功能。蛋白印迹结果及caspase-3活性检测共同表明,MgIG可抑制ConA处理后肝组织凋亡相关蛋白caspase-3的活化,进一步通过TUNEL染色法证明其减少了肝细胞凋亡。结果表明,MgIG可以降低ConA诱导的凋亡相关蛋白caspase-3的激活,减少肝细胞凋亡可能是其缓解肝衰竭的机制之一。
Kupffer细胞等免疫细胞及其分泌的多种细胞因子和血清中炎症细胞因子如IL-1β和TNFα与肝衰竭预后呈正相关。本研究通过液相芯片法检测小鼠外周血细胞因子表达水平,结果显示MgIG明显改善ConA诱导后小鼠血清促炎性细胞因子IL-1β和TNFα水平,表明降低促炎性细胞因子分泌是MgIG缓解肝脏炎症的可能机制,并由此缓解ConA诱导的肝损伤。
综上所述,MgIG可明显缓解ConA诱导的小鼠急性肝衰竭,其机制可能为通过抑制肝细胞凋亡及降低促炎性细胞因子分泌水平缓解肝脏炎症反应。本课题组将进一步深入研究MgIG对免疫性肝损伤的保护作用,探讨其对免疫细胞亚群的调节及其具体的分子机制。
