HCV感染者直接抗病毒药物治疗前后CD8+T淋巴细胞衰老和功能相关指标的变化
2020-07-21张沛欣边培育叶传涛郑煦暘贾战生
张沛欣,边培育,叶传涛,郑煦暘,范 超,张 颖,贾战生,周 云
空军军医大学第二附属医院 传染科,西安 710038
HCV是黄病毒属单股正链噬肝RNA病毒,会引起高比例的慢性丙型肝炎(超过80%)。它是导致肝纤维化、肝硬化、肝细胞癌的主要原因,在许多国家是肝移植最常见的指征。HCV感染后,机体能够产生固有免疫和适应性免疫反应。固有免疫作用包括抗原递呈细胞和自然杀伤细胞引起的细胞毒作用,导致感染细胞裂解和自然杀伤细胞分泌IFNγ等细胞因子,抑制HCV复制。适应性免疫作用则产生病毒特异性细胞毒性T淋巴细胞,特异性地识别和裂解感染细胞,产生病毒特异性抗体,中和细胞外的病毒颗粒。本研究小组[1]此前发现,沉默信息调节因子2相关酶1(sirtuin1,SIRT1)在HCV感染者CD4+T淋巴细胞上表达增高,抵抗细胞衰老。SIRT1在CD8+T淋巴细胞上的表达情况尚无研究。大量研究表明,HCV特异性CD8+T淋巴细胞免疫功能障碍是机体无法彻底清除病毒,导致持续感染的主要原因,其机制包括天然免疫的不足、病毒逃逸突变、抑制性受体的表达、CD4+辅助性T淋巴细胞免疫辅助功能受损、细胞因子的负性调节作用等[2]。本研究拟检测并比较HCV感染者经直接抗病毒药物(DAA)治疗前后CD8+T淋巴细胞衰老、负性调节因子相关指标的变化,并探讨其临床意义。
1 资料与方法
1.1 研究对象 选取2017年1月-2018年12月于空军军医大学第二附属医院就诊的HCV感染者及治愈者的血清和外周血单个核细胞(PBMC),诊断标准依据《2016年欧洲肝病学会丙型肝炎治疗指南》[3]。实验分为HCV感染者、HCV治愈者和健康对照组。抗HCV治疗采用索磷布韦联合达卡他韦方案。治愈者指慢性丙型肝炎患者完成12周抗病毒治疗,达到病毒学应答,HCV RNA均低于检测下限,肝功能指标ALT、AST正常。
1.2 试剂与方法
1.2.1 主要试剂 流式抗体CD3、CD4、CD8、CD57,SIRT1等购自美国BD公司;反转录PCR(RT-PCR)的 p53、p21引物购自上海生工公司;用于磁珠分选细胞的CD8+T淋巴细胞分离试剂盒购自德国美天旎公司,RNA提取试剂盒、反转录试剂盒,定量反转录PCR(qRT-PCR)试剂盒购自德国Qiagen公司,Luminex液相悬浮芯片检测由上海华盈生物医药科技有限公司提供。RPMI1640等常规细胞培养基、无抗生素无血清的OPT-MEM Ⅰ培养液、胎牛血清购自美国Gibco公司。
1.2.2 流式细胞术检测CD8+T淋巴细胞SIRT1、CD57、PD-1、Tim-3的表达 Ficoll-Pague密度梯度离心法分离外周血中的PBMC,洗涤后加入CD8、CD57、PD-1表面抗体,4 ℃避光孵育30 min后洗涤,1500 r/min离心5 min 后弃上清。SIRT1、Tim-3为胞内染色,用Inside Stain kit中的固定液4℃固定30 min,1500 r/min离心5 min后弃上清;加破膜液180 μl,1500 r/min离心5 min后弃上清。加50 μl 破膜液,加SIRT1、Tim-3抗体,室温避光孵育30 min,1500 r/min离心5 min后弃上清,加流式缓冲液,上机检测。
1.2.3 RT-PCR检测p53、p21 mRNA的表达 以CD8+T淋巴细胞分离试剂盒分离PBMC中的CD8+T淋巴细胞,用TRIzol提取RNA,逆转录成cDNA,通过RT-PCR检测各组细胞衰老相关信号p53、p21 mRNA的表达水平。设计GAPDH、p53、p21分子的qRT-PCR引物,GAPDH上游引物:5′-GGTGAAGGTCGGAGTCAACG-3′,下游引物:5′-CAAAGTTGTCATGGATGHACC-3′;p53 上游引物:5′-AGCGCTTCGAGATGTTCCGA-3′,下游引物:5′-TTCAGGTGGCTGGAGTGAGC-3′;p21 上游引物:5′-GGGATGTCCGTCAGAACCCA-3′,下游引物:5′-CACCCTCCAGTGGTGTCTCG-3′。RT-PCR反应条件: 95 ℃ 5 min,进入循环95 ℃ 10 s,60 ℃ 5 s,共循环42次,60 ℃ 5 s,65 ℃ 5 s,95 ℃ 30 s。生成扩增曲线及熔解曲线,得出Ct值,各目的基因的表达量与内参基因GAPDH进行标准化,得到各基因的相对表达量。
1.2.4 Luminex液相悬浮芯片检测外周血衰老相关的分泌表型(senescence associated secretory phenotype,SASP)为检测3组人群SASP,按照Luminex液相悬浮芯片检测试剂盒操作手册制备样品和标准品,取微珠在振荡器上 1400 r/min,振荡30 s,使用RD2-1稀释微珠;用振荡器1400 r/min,再次震荡30 s,每孔50 μl加入96孔板中;取50 μl准备好的标曲、样品和 Blank 加入对应孔中,850 r/min振荡,避光,室温孵育2 h。洗涤,每孔加入50 μl稀释好的Biotin Antibody Cocktail,850 r/min振荡,避光,室温孵育1 h。洗涤后每孔加入50 μl稀释好的Streptavidin-PE,850 r/min振荡,避光,室温孵育30 min,洗涤后送入已校正的Luminex 200机器中读值。
1.3 伦理学审查 本研究经空军军医大学第二附属医院医学伦理委员会批准(批号:TDLL-2016142),并与患者及健康对照者签署知情同意书。

2 结果
2.1 一般资料 共纳入HCV感染者26例,HCV治愈者22例,健康对照者20例。各组男女比例及年龄、HCV RNA定量、基因分型和肝功能指标见表1。
2.2 外周血CD8+T淋巴细胞计数 流式细胞仪检测健康对照组12例、HCV组18例、HCV治愈组15例3组人群PBMC中CD8+T淋巴细胞的水平,3组间差异无统计学意义(F=0.081,P=0.922)(图1)。
2.3 CD8+T淋巴细胞上SIRT1、CD57、PD-1、Tim-3的表达水平 流式细胞仪检测健康对照组12例、HCV组18例、HCV治愈组15例3组人群CD8+T淋巴细胞上SIRT1、CD57、PD-1、Tim-3的表达水平(图2)。SIRT1在3组间差异有统计学意义(F=6.712,P=0.003),与健康对照相比,HCV组SIRT1表达水平明显升高(P<0.001),经治疗后,HCV治愈组表达水平下降,且与HCV组相比差异有统计学意义(P<0.05),HCV治愈组与健康对照组比较,SIRT1表达水平差异无统计学意义(P>0.05)。CD57在3组间差异无统计学意义(F=0.203,P=0.817)。PD-1在3组间差异有统计学意义(F=4.202,P=0.022),与健康组相比,PD-1在HCV组明显升高(P=0.008),经治疗后略有下降,HCV治愈组与健康对照组、HCV组比较差异均无统计学意义(P值均>0.05)。Tim-3在3组间差异有统计学意义(F=4.575,P=0.016),与健康对照组相比,Tim-3在HCV组(P=0.005)和HCV治愈组(P=0.047)均升高,HCV组和HCV治愈组比较差异均无统计学意义(P>0.05)。
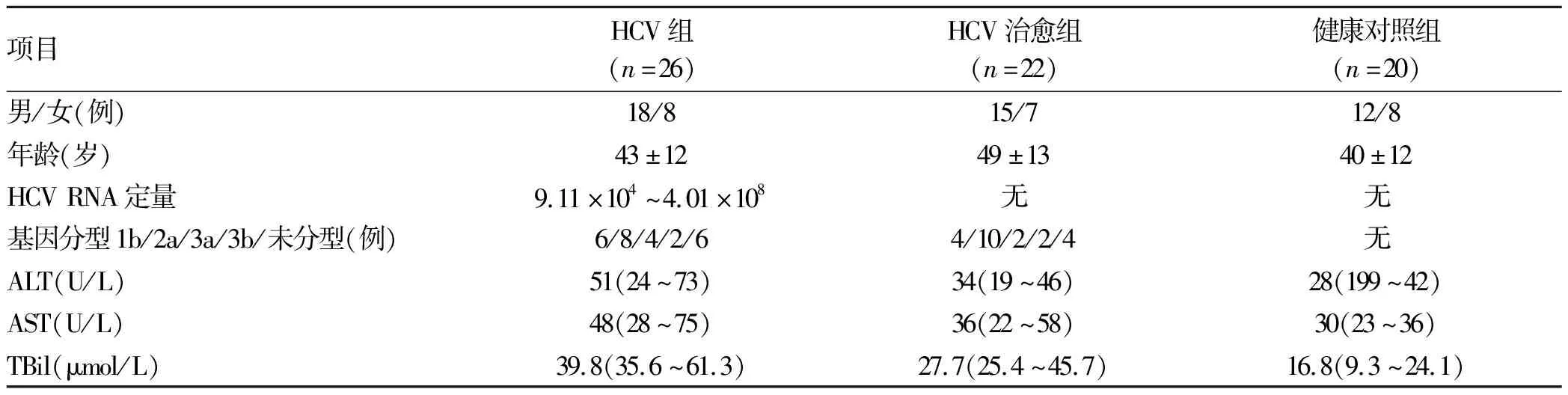
表1 各组一般临床资料
2.4 CD8+T淋巴细胞上p53及p21的表达水平 RT-PCR检测健康对照组、HCV组及治愈组3组人群CD8+T淋巴细胞上p53及p21的表达,每组8例(图3)。结果显示,p53表达倍数变化在3组间差异有统计学意义(F=11.144,P<0.001),HCV组及HCV治愈组p53表达水平较健康对照组明显下降(P值均<0.001)。p21表达倍数变化在3组间差异有统计学意义(F=6.594,P=0.006),HCV组及HCV治愈组p21表达水平较健康对照组明显下降(P值均<0.05)。
2.5 外周血SASP相关分子的表达水平 Luminex液相悬浮芯片检测外周血SASP,包括IL-2、IL-6、CXCL1 GRO、TNFα(图4)。其中健康对照组20例,HCV组21例,治愈组22例,IL-2、CXCL1 GRO在3组间差异均无统计学意义(F值分别为0.748、0.616,P值均>0.05)。IL-6在3组间差异有统计学意义(F=3.920,P=0.025),HCV组较健康对照组明显升高(P=0.007),HCV治愈组与HCV组、健康对照组比较差异无统计学意义(P>0.05)。TNFα在3组间差异有统计学意义(F=6.337,P=0.003),HCV组较健康对照组和HCV治愈组均明显升高(P值均<0.05),HCV治愈组与健康对照组比较差异无统计学意义(P>0.05)。
3 讨论
研究[4]发现肝硬化的HCV患者CD8+T淋巴细胞功能受损,CD8+T淋巴细胞亚群比例改变。通过DAA治疗后,其受损的CD8+T淋巴细胞功能并无好转,表现为CD107a及穿孔蛋白减少。DAA治疗对于提高炎性因子和降低抑制性分子TGFβ并无效果。在慢性HCV感染过程中,肝纤维化的严重性与CD8+T淋巴细胞的功能亢进相关,经DAA治疗后,即使病毒已清除,这种效应仍持续存在。本试验检测了DAA治疗前后,CD8+T淋巴细胞计数在健康对照者、HCV感染者、HCV治愈者3组人群中并无差异。
Sirtuin蛋白是一组具有烟酰胺腺嘌呤二核苷酸依赖性的组蛋白去乙酰基转移酶,参与机体一系列生物学活动,在调控衰老和寿命方面发挥重要作用。SIRT1通过多种信号通路参与炎症反应、新陈代谢、细胞增殖、凋亡和衰老等过程。SIRT1与衰老关系密切,且在衰老细胞中表达减少。p53作为重要的抑癌基因,在多种细胞损伤应激反应中通过引起细胞周期阻滞和细胞凋亡来维持基因组的稳定性。作为SIRT1主要底物,p53的功能发挥取决于其活性,p53的乙酰化在癌基因诱导细胞衰老和复制性衰老中都起关键作用,且能被 SIRT1抑制[5]。SIRT1对p53的去乙酰化可阻止其对衰老的诱导。p21是p53最经典的靶基因,亦是细胞周期抑制因子。在DNA 损伤、缺氧及癌基因激活等刺激下,p53对细胞周期G1监测点的调控主要由p21介导[6]。p21的过表达则可导致细胞周期阻滞,并出现一系列衰老征象,如衰老相关β-半乳糖苷酶活性增加,细胞扁平、胀大等。有研究[7]发现,持续感染将导致CD8+T淋巴细胞衰老,在HCV慢性感染者中,CD4+T淋巴细胞的端粒长度和肝硬化的进展与临床预后不佳相关。笔者团队[1]此前也发现HCV感染者CD4+T淋巴细胞比健康对照者端粒长度短,衰老细胞更多,但SIRT1的表达比健康对照者更高。有学者[8]研究了在HCV感染者的肝组织中T淋巴细胞周期性蛋白抑制剂p21、p27、p16,发现随着纤维化程度增加,p21表达增加。也有学者[9]发现HCV特异性CD4+T淋巴细胞和 CD8+T淋巴细胞高表达PD-1。HCV感染者CD4+T淋巴细胞和CD8+T淋巴细胞中后期分化的T淋巴细胞明显增多,提示免疫衰老。此外,还发现血浆中病毒载量与T淋巴细胞上CD57、PD-1的表达水平呈正相关。
本研究中HCV组与健康对照组相比,外周CD8+T淋巴细胞上SIRT1表达上升,经过治疗,HCV治愈组SIRT1表达水平下降,且与HCV组相比差异有统计学意义,与健康对照组无显著性差异。衰老标志分子CD57在3组间无统计学差异。HCV感染组及治愈组CD8+T淋巴细胞上p53、p21水平较健康对照组下降。推测在HCV感染后,外周循环CD8+T淋巴细胞衰老,导致SIRT1反应性增高,抑制p53、p21的表达,HCV治愈后,CD8+T淋巴细胞衰老状态部分恢复,SIRT1水平下降至与健康对照组无差异,但p53、p21表达水平低。衰老T淋巴细胞的增殖功能被抑制,有促炎的特征并且分泌高浓度的促炎因子,也称作SASP,其与免疫功能有关[10]。
本研究中HCV组与健康对照组相比,外周CD8+T淋巴细胞上PD-1、Tim-3表达水平上升,经治疗后,HCV治愈组表达下降,但是HCV治愈组与HCV组相比无统计学差异。与本研究一致的,DAA治疗清除HCV对CD8+T淋巴细胞功能和线粒体损伤恢复作用有限,PD-1和Tim-3在治疗前后无统计学差异[11]。使用PD-1/PD-L1阻滞剂和Tim-3阻滞剂后,HCV特异性CD8+T淋巴细胞仍有增殖能力。此前有研究[12]分析了慢性HCV感染者CD4+和CD8+T淋巴细胞的衰竭状态和促炎因子,发现PD-1在HCV肽刺激的CD4+T淋巴细胞上表达上升,Tim-3在HCV肽刺激的CD8+T淋巴细胞上表达上升。而促炎因子IL-2、TNFα、IL-17A和IL-6在T淋巴细胞培养中显著下降。研究者认为慢性HCV感染导致CD4+T和CD8+T淋巴细胞功能衰竭,病毒持续感染。而本研究分析了HCV感染者外周血SASP,其中IL-2、CXCL1 GRO在3组人群中均无统计学差异,IL-6、TNFα在HCV治愈组比健康对照组升高,HCV治愈组和HCV组相比稍有下降,其中TNFα有统计学差异。有研究[13]证实慢性丙型肝炎患者血清 IL-6水平均明显高于健康对照组,在以索磷布韦为基础的抗HCV治疗12周后,慢性丙型肝炎患者血清IL-6水平均较基线明显降低;升高表达的IL-6 可发挥促进淋巴细胞增殖、拯救衰竭细胞功能的作用[14]。有研究[15]对使用DDA治疗4周就获得持续病毒性应答(SVR)和复发的HCV感染者与基线和治疗终点的CD8+T淋巴细胞进行分析,发现PD-1阳性的CD8+T淋巴细胞及细胞毒性能力和获得早期SVR相关,与本研究一致的是,Tim-3、TNFα在早期获得SVR的CD8+T淋巴细胞上表达升高。
综上,本研究分析了HCV感染者DAA治疗前后CD8+T淋巴细胞衰老、功能相关指标的变化。发现与健康对照组相比,HCV感染者CD8+T淋巴细胞衰老,HCV组CD8+T淋巴细胞上SIRT1表达水平升高,HCV治愈后,CD8+T淋巴细胞衰老状态部分恢复,SIRT1水平下降至与健康对照组无差异,p53、p21在HCV组和HCV治愈组表达水平均降低;HCV感染者CD8+T淋巴细胞上PD-1、Tim-3表达水平升高,分泌的IL-6和TNFα表达水平升高。DAA治疗后衰老缓解,T淋巴细胞功能部分恢复,HCV治愈组CD8+T细胞PD-1和IL-6、TNFα的水平与健康对照组无统计学差异。
