乙醇酸法脱菜籽酚及硫苷的工艺研究及对蛋白品质的影响
2020-07-20张逸濛杨瑞金
张逸濛,杨瑞金
(1.江南大学食品学院,江苏无锡 214122; 2.江南大学食品科学与工程国家重点实验室,江苏无锡 214122)
油菜籽作为我国重要的一种油料作物,含有38%~45%的脂肪,20%~25%的蛋白质和20%~25%的碳水化合物。油菜籽富含多酚,在所有油料作物中,油菜籽的多酚含量居于第一位,同时其含有丰富的植物甾醇[1]。同时,油菜籽中含有一定的抗营养因子,如硫苷、植酸、单宁等,也一定程度限制了油菜籽的发展[2]。其中硫苷全称为硫代葡萄糖苷,其本身无毒,存在于植物的液泡中,但当细胞发生破裂时,硫苷会被位于细胞中的硫苷酶催化释放出异硫氰酸酯、恶唑烷硫酮和腈类等有毒物质[3]。
目前,水媒法作为一种条件温和、环保的提油技术,在工业上正逐渐代替压榨法成为一种新型提油手段。水媒法是以水为媒介,并辅以乙醇、食用级酶或超声波等处理以提取食用油的方法[4]。在水媒法的提油过程中,有占原料蛋白68.71%±1.42%的蛋白残留在水相中,因此有必要对提油后的水相蛋白进行回收,以提高资源利用率。然而,在用传统碱溶酸沉法回收蛋白时,蛋白易与水相中的多酚发生结合并部分氧化成醌类物质[5-6],从而导致蛋白颜色偏深、纯度较低且整体功能性质劣于大豆蛋白。同时,由于硫苷的存在,菜籽蛋白的利用也存在一定的安全问题。文献报道的脱酚方法主要有溶剂萃取法、微波辅助提取法、超声辅助提取法、超临界萃取法等。其中,溶剂萃取法对设备要求较低、工艺流程简单,并且符合绿色节能环保的理念,有较大的工业化应用价值。许瑞如等[7]采用微波法提取桔梗根多酚,在微波功率210 W、料液比1∶30 g/mL、微波时间60 s、乙醇浓度50%、提取次数为2次时多酚提取率达6.49 mg/g。王成涛等[8]通过甲醇乙醇混合法脱酚并制备棉籽蛋白,确定的最佳工艺条件为:甲醇-乙醇混合比例1∶1,混合溶剂体积分数90%,萃取温度55 ℃,每次萃取时间25 min,料液比1∶3 g/mL,分3次进行。在最佳工艺条件下制备的脱酚棉籽蛋白游离棉酚含量为157 mg/kg。吕丹丹[9]采用乙醇超声辅助法对核桃多酚进行提取,在最优条件下核桃脱酚蛋白较未脱酚蛋白溶解度、乳化活性和乳化稳定性、起泡性和泡沫稳定性分别上升了9.3%、25.31%、17.93%、24.49%和89.58%。王风雷等[10]用70%乙醇提取荠菜中硫苷,发现在料液比1∶25 g/mL,80 ℃反应30 min时硫苷提取率为56.2 mg/g。
为提高蛋白品质,以乙醇酸法同时提取菜籽中的多酚和硫苷的工艺目前尚未见报道。有本研究首先对整粒菜籽进行脱酚、脱硫苷的处理,减少处理时蛋白溶出的同时脱除油菜籽中多酚和硫苷,再以节能环保的水媒法为提取方法,对提油后得到的水相蛋白进行提取,并对比脱酚前后油菜籽蛋白质的颜色、纯度、功能性质的不同,旨在对水媒法利用油菜籽副产物及改善副产物品质方面提供有益的参考和借鉴。
1 材料与方法
1.1 材料与仪器
油菜籽 市售,产于江苏盐城;芥子酸(sinapic acid) 纯度≥99.0%,美国Sigma公司;黑芥子硫苷酸钾(sinigrin) 纯度≥99.0%,美国Sigma公司;福林酚 美国Sigma公司,使用前稀释10倍;乙醇、碳酸钠、氯化钯、羧甲基纤维素钠、硫酸钾、硫酸铜、氢氧化钠、盐酸、硫酸 分析纯,国药集团化学试剂有限公司。
LE2002E电子天平 梅特勒-托利多仪器(上海)有限公司;DK-S2电热恒温水浴锅 上海精宏实验设备有限公司;DGG-9070A电热恒温鼓风干燥箱中国上海森信实验仪器有限公司;DFY-500摇摆式高速中药粉碎机 浙江温岭市林大机械有限公司;TGL-16M冷冻离心机 上海卢湘离心机仪器有限公司;723N可见分光光度计 上海精密科学仪器有限公司;M348834旋涡振荡器 德国IKA公司;UltraScan Pro1166高精度分光测色仪 美国Hunterlab公司。
1.2 实验方法
1.2.1 工艺流程
乙醇酸法脱除多酚和硫苷:称取50 g的新鲜菜籽于干燥锥形瓶中,加入250 mL的乙醇酸溶液(乙醇∶水=4∶6,pH=5),在80 ℃的温度下于恒温水浴摇床中反应1 h,摇床转速设置为150 r/min。
水相蛋白的提取:经粉碎后的菜籽按照田凌宇[14]的方法对菜籽进行水媒法提油。收集水媒法提油后得到的水相,由于水媒法提取菜籽油得到的水相pH=11左右,因此可以直接酸沉。用1 mol/L的盐酸溶液将pH调至水媒法菜籽蛋白的等电点5.0,4 ℃酸沉30 min,于冷冻离心机中以5000r/min的转速离心15 min,滤去上清液,收集沉淀。在沉淀中添加适量去离子水,将pH调至7.5后继续离心,重复一次这样的操作,收集得到的蛋白沉淀。复溶后冷冻干燥得到菜籽蛋白粉。
1.2.2 单因素实验
1.2.2.1 乙醇浓度对多酚和硫苷含量的影响 按照1.2.1的方法,在菜籽50 g,料液比1∶5 (g/mL),pH调节至5,80 ℃反应1 h的条件下,分别设置乙醇浓度为10%、20%、30%、40%、50%、60%、70%、80%、90%进行实验,离心后取上清液,分别测定多酚和硫苷含量。
1.2.2.2 料液比对多酚和硫苷含量的影响 按照1.2.1的方法,在菜籽50 g,乙醇浓度为40%,pH调节至5,80 ℃反应1 h的条件下,分别设置料液比为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6、1∶7 (g/mL)进行实验,离心后取上清液,分别测定多酚和硫苷含量。
1.2.2.3 pH对多酚和硫苷含量的影响 按照1.2.1的方法,在菜籽50 g,乙醇浓度为40%,料液比为1∶5,80 ℃反应1 h的条件下,分别在pH为2、3、4、5、6、7的条件下进行实验,分别测定多酚和硫苷含量。
1.2.2.4 反应温度对多酚和硫苷含量的影响 按照1.2.1的方法,在菜籽50 g,乙醇浓度为40%,pH调节至5,料液比为1∶5,反应1 h的条件下,分别在温度为50、60、70、80、90 ℃的条件下进行实验,离心后取上清液,分别测定多酚和硫苷含量。
1.2.2.5 反应时间对多酚和硫苷含量的影响 按照1.2.1的方法,在菜籽50 g,乙醇浓度为40%,pH调节至5,料液比为1∶5,80 ℃的条件下,分别反应0.5、1、1.5、2 h,离心后取上清液,分别测定多酚和硫苷含量。
1.2.2.6 反应次数对多酚和硫苷含量的影响 按照1.2.1的方法,在菜籽50 g,乙醇浓度为40%,料液比为1∶5,pH调节至5,80 ℃反应1 h的条件下,分别反应1、2、3、4次,离心后取上清液,分别测定多酚和硫苷含量。
1.2.3 多酚含量的测定
1.2.3.1 标准曲线的绘制 参照吴梨[11]的方法,略作修改。准确称取芥子酸2.00 mg,用50%的甲醇准确定容至10.00 mL,配制成浓度为0.20 g/L的芥子酸溶液,再用50%的甲醇稀释至浓度分别为0.04、0.08、0.12、0.16、0.20(g/L)的芥子酸标准液。取0.40 mL上述浓度的标准液分别加入3.90 mL福林酚工作液,混合均匀后加入3.00 mL饱和碳酸钠溶液,混合均匀后于25 ℃的恒温水浴锅中反应1.5 h,显色后于725 nm处测定它们的吸光度。以多酚(芥子酸)含量为横坐标,吸光度为纵坐标绘制标准曲线,得到的标准曲线方程见式(1):
y=5.696x+0.029,R2=0.997
式(1)
式中,x代表提取液中多酚含量,y代表吸光度。
1.2.3.2 多酚含量的测定 取0.40 mL菜籽多酚提取液,加入3.90 mL福林酚工作液,混合均匀后加入3.00 mL饱和碳酸钠溶液,混合均匀后于25 ℃的恒温水浴锅中反应1.5 h,显色后于725 nm处测定它们的吸光度。菜籽多酚提取量用mg(芥子酸含量)/g(油菜籽干重)表示。
1.2.3.3 多酚脱除率的测定 参照李笑笑[12]的方法,稍作修改。准确称取1.00 g乙醇酸处理过并粉碎的菜籽粉于离心管中,加入10 mL 80%的丙酮,混匀后在超声中反应30 min,超声后于冷冻离心机中以7000 r/min离心10 min,取上清液,所有提取过程重复两次,合并提取液,测定提取液中多酚含量。多酚脱除率计算式见式(2):

式(2)
1.2.4 硫苷含量的测定
1.2.4.1 标准曲线的绘制 准确称取黑芥子硫苷酸钾(sinigrin)10.00 mg,用去离子水准确定容至10 mL,配制成浓度为1 g/L的硫苷溶液,再用去离子水稀释至浓度分别为0.1,0.2,0.3,0.4,0.5,0.6,0.7(mg/mL)的硫苷标准液。分别取1 mL上述标准液加入0.15%的羧甲基纤维素钠(CMC)溶液2 mL,摇匀后加入0.1%的氯化钯显色液,混合均匀后于25 ℃的恒温水浴锅中反应2 h,显色后于540 nm处测定它们的吸光度[13]。以sinigrin含量为横坐标,540 nm处的吸光值为纵坐标绘制标准曲线,得到的标准曲线方程见式(3):
y=0.747x+0.007,R2=0.993
式(3)
式中,x代表提取液中硫苷含量,y代表吸光度。
1.2.4.2 硫苷含量的测定 将提取液于冷冻离心机中以6000 r/min离心10 min,取上清液1 mL加入0.15%的羧甲基纤维素钠(CMC)溶液2 mL,摇匀后加入0.1%的氯化钯显色液,混合均匀后于25 ℃的恒温水浴锅中反应2 h,并测定吸光值。菜籽硫苷提取量用mg(黑芥子硫苷酸钾含量)/g(油菜籽干重)表示。
1.2.4.3 硫苷脱除率的测定 取10.00 g新鲜菜籽,用中药粉碎机研磨成粉末,用石油醚脱脂8 h。准确称取脱脂菜籽粉0.15 g于10 mL比色管中,在沸水浴中干蒸10 min以灭酶活性,再加入约90 ℃的沸水继续干蒸20 min,于离心机中以6000 r/min离心10 min,再取上清液适量用上述相同方法显色并测定吸光度。未脱酚菜籽中硫苷含量用μmol(上清液中黑芥子硫苷含量)/g(油菜籽干重)表示。以同样方法,计算出脱酚后菜籽中硫苷含量。硫苷脱除率计算公式见式(4):

式(4)
1.2.5 蛋白样品相关性质的测定
1.2.5.1 蛋白色泽的测定 采用色度仪测定,每个样品重复4次。根据Xu等[15]的研究方法加以改善,测量值表示为L*(亮度),a*(红色/绿色)和b*(黄色/蓝色)。白度计算公式见式(5):
白度=100-[(100-L*)2+a*2+b*2]1/2
式(5)
1.2.5.2 蛋白纯度的测定 本研究中所有有关蛋白纯度的测定,均参照GB 5009.5-2010中第一法凯氏定氮法[16]。菜籽蛋白转化系数为5.75。
1.2.5.3 持水(油)力的测定 将脱酚前后的蛋白粉各准确称取0.50 g置于10 mL离心管中,加入5 mL去离子水(大豆油),于40 ℃水浴锅中静置30 min,静置完成后以5000 r/min进行离心20 min,用滴管小心吸去上层的水(大豆油),称重。持水(油)力计算公式见式(6):
持水(油)力=(离心后离心管加沉淀的质量-离心管加干燥样品的质量)/菜籽蛋白的质量
式(6)
1.2.5.4 乳化性和乳化稳定性的测定 乳化性和乳化稳定性的测定参考Pearce[17]的方法并稍作改进,用pH=7.0的磷酸盐缓冲溶液配置15 mL 0.2%的蛋白溶液,加入5 mL大豆油,用高速搅拌器在15000 r/min下搅拌1 min。在0和10 min时分别在离心管底部吸去50 μL液体加至5 mL的0.1%的SDS溶液中,以SDS溶液为空白,于500 nm下测定吸光值。乳化性(EAI)和乳化稳定性(ESI)的计算公式分别见式(7)和(8)。
式(7)
式(8)
式中N为稀释倍数;φ为水相体积分数(v/v);C为蛋白质浓度(g/mL);A0、A1为乳状液在0、10 min的吸光值。
1.2.5.5 起泡和起泡稳定性的测定 用pH=7.0的去离子水配置20 mL 1.0%的蛋白溶液,在室温下搅拌30 min,用高速搅拌器在10000 r/min下搅拌1 min。搅拌结束后立即转移至50 mL量筒中,立即测定此时泡沫的体积V1,起泡性(FC)的计算公式见式(9)。
FC(%)=V1×100/20
式(9)
将上述量筒中的液体于室温静置30 min,记录30 min时泡沫的体积V2。起泡稳定性(FS)的计算公式见式(10)。
FS(%)=V2×100/V1
式(10)
1.2.6 不同处理工艺菜籽多酚的分布 在乙醇浓度40%,料液比1∶5 (g/mL),pH=5,80 ℃水浴摇床反应的条件下,分别用乙醇酸脱酚30 min一次、60 min一次和60 min三次,对原料进行水媒法提油并对水相进行蛋白回收,得到三种不同酚含量的蛋白R2、R3、R4,不进行脱酚直接对原料提油提蛋白后得到R1蛋白,此四种蛋白用于对比不同酚含量下的蛋白品质。
1.3 数据处理
所有的结果表示均为平均值±标准偏差(SD),所有样品均进行三次平行实验。数据分析通过SPSS 19.0进行ANOVA分析评估显著性差异。用Origin 2018和Excel软件进行作图。
2 结果与分析
2.1 同步脱酚和硫苷工艺的优化
2.1.1 乙醇浓度对多酚和硫苷提取量的影响 由图1可知,多酚提取量随乙醇浓度的提高先增大后减小,当乙醇浓度到达40%时,多酚提取量达到最高值5.89 mg/g;同样的,硫苷提取量的走势与多酚几乎一致,硫苷提取量随乙醇浓度的提高先增大后减小,当乙醇浓度为40%时硫苷达到最高提取量18.31 mg/g。植物类多酚常与植物中其他大分子结合形成稳定的化合物[18],当乙醇浓度过低时,导致水溶性物质的浸出,干扰多酚的测量;乙醇浓度过高时,溶剂极性太低,不足以破坏多酚和蛋白质以及其他大分子的连接,降低了多酚的回收率。而硫苷本身是一种稳定的化合物,当其接触与其极性相似的乙醇溶液时,便会从中释放出来[19];由于是对整粒菜籽进行脱除,而硫苷酶主要位于菜籽内部,因此硫苷酶不会释放,硫苷也不易被分解。故而选择40%的乙醇溶液对菜籽中的多酚硫苷进行脱除。
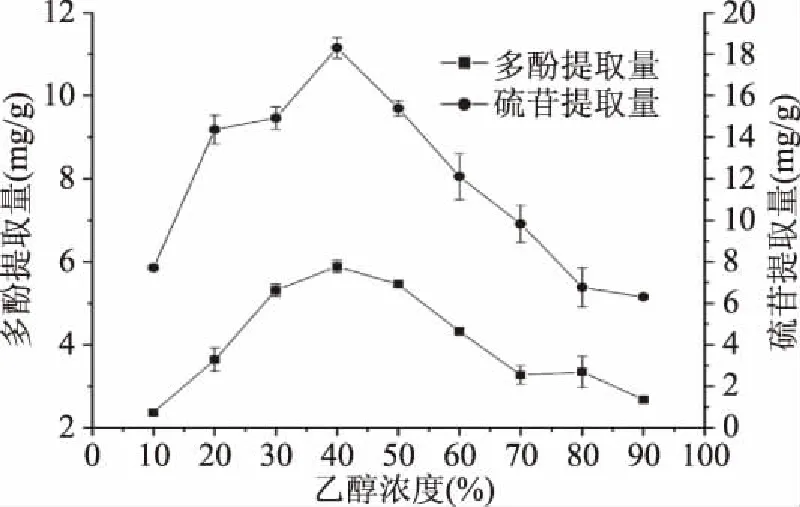
图1 乙醇浓度对多酚和硫苷提取量的影响Fig.1 Effect of ethanol concentration on the yield of polyphenols and glucosinolates
2.1.2 料液比对多酚和硫苷提取量的影响 由图2可知,多酚提取量随料液比的增大先增大后基本保持不变,基本稳定在提取量为6.50~7.00 mg/g左右,在料液比为1∶6时,菜籽多酚提取量最高为6.75 mg/g;硫苷提取量随着料液比的提高先上升后下降,菜籽硫苷提取量在料液比1∶5时达到最高值18.73 mg/g。在料液比为1∶6时,多酚已基本溶出,继续添加乙醇溶液对硫苷提取量没有正面的效果;而在料液比为1∶5时,硫苷已基本全部溶出。从节约试剂、降低成本的角度考虑,采用1∶5的料液比作为菜籽多酚和硫苷的最佳提取条件。
5.3 检查调整。对整机上各紧固螺丝、螺帽进行检查,发现松动要及时紧固;对主离合器、插秧离合器、秧针与导轨的间隙、秧针与苗箱的间隙等进行检查调整。
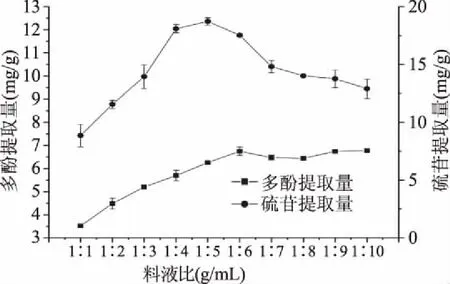
图2 料液比对多酚和硫苷提取量的影响Fig.2 Effect of solid-liquid ratio on yield of polyphenols and glucosinolates
2.1.3 pH对多酚和硫苷提取量的影响 由图3可知,当pH从2调到3时,多酚提取量有小幅的减小,进而将pH调到5时,多酚提取量又有一定量的增加,达到最高点pH=5时多酚提取量为6.18 mg/g,当pH继续升高至中性时,多酚提取量又有降低的趋势;在pH从2~6时,硫苷提取量趋于定值,基本稳定在(17.00~18.00) mg/g之间,最大值为pH=5时硫苷提取量为17.73 mg/g,当pH继续升高至中性时,硫苷提取量明显降低。这是由于植物细胞的通透性可以被酸度影响,并适当抑制多酚氧化酶和内源硫苷酶的活性[20],这使得多酚和硫苷等有效活性物质更易溶出,并且抑制了多酚酶促氧化反应和硫苷内分解反应的发生。当pH过低可能会使菜籽中其他大分子溶出,并且增加了脱酚脱硫苷的成本,因此在pH=5的弱酸性环境下菜籽中的多酚硫苷更易溶出且不易被分解。
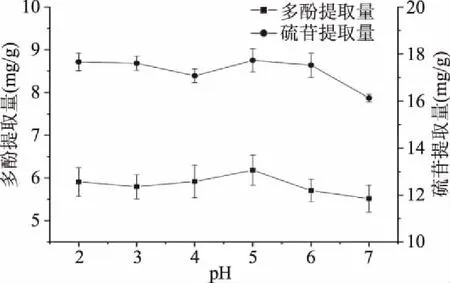
图3 pH对多酚和硫苷提取量的影响Fig.3 Effect of pH on yield of polyphenols and glucosinolates
2.1.4 提取温度对多酚和硫苷提取量的影响 由图4可知,提取温度是乙醇摇床提取菜籽多酚和硫苷提取量的重要因素之一。在温度从50 ℃上升到90 ℃时,多酚和硫苷的提取量均不断增加,其中(70~80) ℃,多酚和硫苷溶出量明显增加,原因是随着温度的增加,分子运动加快,多酚和硫苷类物质不断的向溶液中扩散。温度到达80 ℃之后,多酚和硫苷的溶出小幅增加,原因是80 ℃时溶剂中的小分子已接近饱和,且温度过高可能会使一些热不稳定成分分解破坏,因此变化不明显。一直以来人们认为多酚和硫苷等物质是热不稳定性物质,当温度过高时可能会分解[21-22],但观察图4可知,90 ℃是多酚和硫苷的含量基本与80 ℃时的一致,说明菜籽中的多酚和硫苷在90 ℃以内都有良好的热稳定性,提高温度并不会使这些物质大量分解。考虑到能源节约的问题,选择80 ℃为菜籽多酚和硫苷脱除反应的温度,此时多酚和硫苷的提取量分别为6.06和17.74 mg/g。
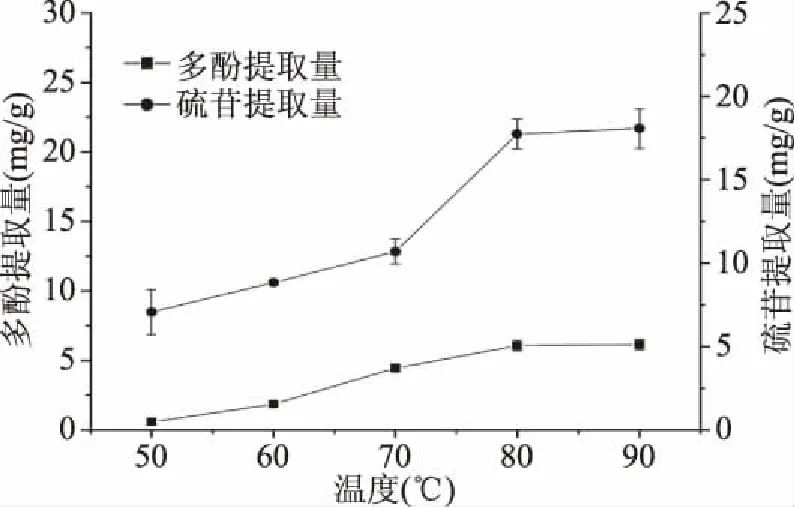
图4 温度对多酚和硫苷提取量的影响Fig.4 Effect of temperature on yield of polyphenols and glucosinolates
2.1.5 提取时间对多酚和硫苷提取量的影响 由图5可知,在反应的2 h内,多酚和硫苷的提取量不断增加。在反应的前1 h内,多酚和硫苷提取量的增长趋势均比较明显,反应达到1 h时多酚和硫苷的提取量分别达到较高值5.63和17.51 mg/g。当反应继续进行时,随后的1 h多酚和硫苷的增幅均不明显。这是由于在反应前1 h时,多酚和硫苷的扩散速度较快,有效物质从固体表面向溶质内部扩散[23],随着扩散的进行,浓度差的减小导致扩散推动力的减小,导致扩散速度减缓,溶剂的吸收量接近饱和,提取量不再上升。
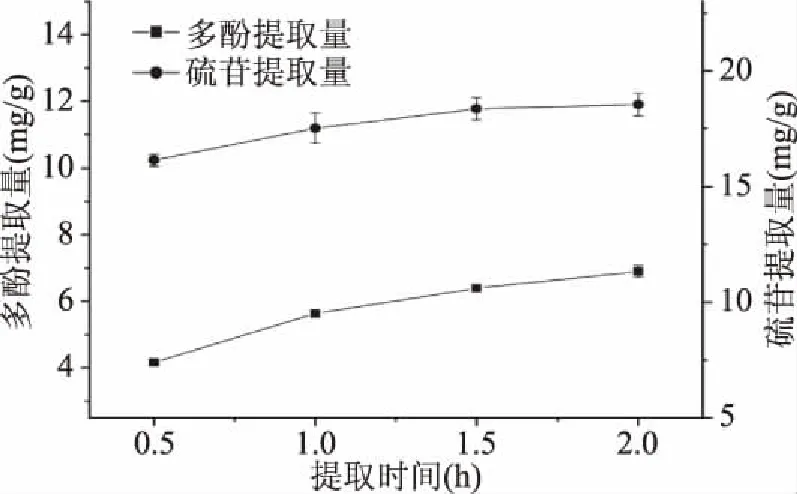
图5 提取时间对多酚和硫苷提取量的影响Fig.5 Effect of time on yield of polyphenols and glucosinolates
2.1.6 提取次数对多酚和硫苷提取量的影响 由图6可知,随着提取次数的增加,硫苷和多酚的提取量不断增加,提取次数对提取量的影响较小。当提取次数为三次时,菜籽多酚总提取量为7.92 mg/g,菜籽硫苷总提取量为30.17 mg/g。提取次数超过3次时,菜籽多酚和硫苷提取量的增幅趋于平缓,考虑到经济节能,因此不再增加提取次数。

图6 提取次数对多酚和硫苷提取量的影响Fig.6 Effect of frequency on yield of polyphenols and glucosinolates
2.1.7 最佳工艺下菜籽多酚和硫苷的脱除率 根据所做的单因素实验,最佳脱除菜籽多酚及硫苷的条件为:乙醇浓度40%,料液比1∶5,pH=5,提取温度80 ℃,反应时间60 min,反应次数为3次,此工艺下多酚提取量为(8.14±0.42) mg/g,硫苷提取量为(32.28±2.32) mg/g。该工艺较其他传统脱酚的工艺相比,乙醇浓度较低,一定程度地降低了料液比,也避免了强酸条件,符合工艺的节能环保、经济可持续的理念。同时,菜籽多酚和菜籽硫苷的提取量曲线趋势基本一致,说明菜籽多酚和硫苷在用乙醇酸的处理工艺中可以同步脱除。
在最优条件下对菜籽进行脱酚和脱硫苷的工艺,脱除率见表1。根据NY/T 1795-2009《双低油菜籽等级规格》的国标中要求[24],含油量范围在37%~41%之间的油菜籽中的硫苷含量低于45 μmol/g,该油菜籽属于低硫苷油菜籽,对于人类和牲畜的健康影响小。由表1可知,脱酚前硫苷含量为94.54 μmol/g,脱酚后硫苷含量为14.51 μmol/g,符合低硫苷菜籽的标准,对人体的健康危害小。

表1 乙醇处理后多酚和硫苷的脱除率Table 1 Removal rate of polyphenols and glucosinolates after ethanol treatment
2.2 脱酚对蛋白质品质的影响
2.2.1 不同处理工艺菜籽多酚的分布 不同工艺得到的蛋白粉样品编号、脱酚液及蛋白中的多酚含量见表2。
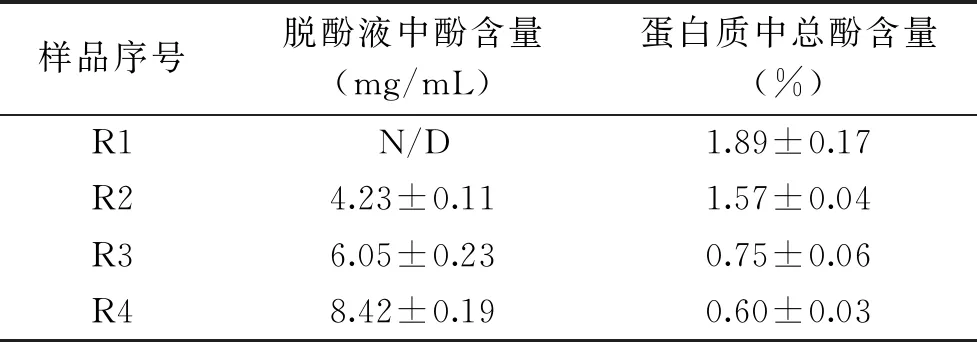
表2 不同处理工艺菜籽多酚的分布Table 2 Distribution of rapeseed polyphenol in different treatments

表3 脱酚程度对蛋白质色泽的影响Table 3 Effect of degree of polyphenol removal on protein colour
2.2.3 纯度 由图7所示,随着脱酚程度的增加,蛋白粉的纯度有所提高,纯度由R1的57.24%逐渐上升至R4的63.63%,可见乙醇酸的脱酚处理使得菜籽蛋白的纯度提高6.39%。原因是乙醇酸处理造成菜籽表面的多酚、硫苷等物质在溶剂中富集,在水媒法提油过程进入水相的多酚、硫苷含量减少,导致蛋白和酚类及其他小分子的结合减少,酸沉后蛋白质的纯度得以提高。
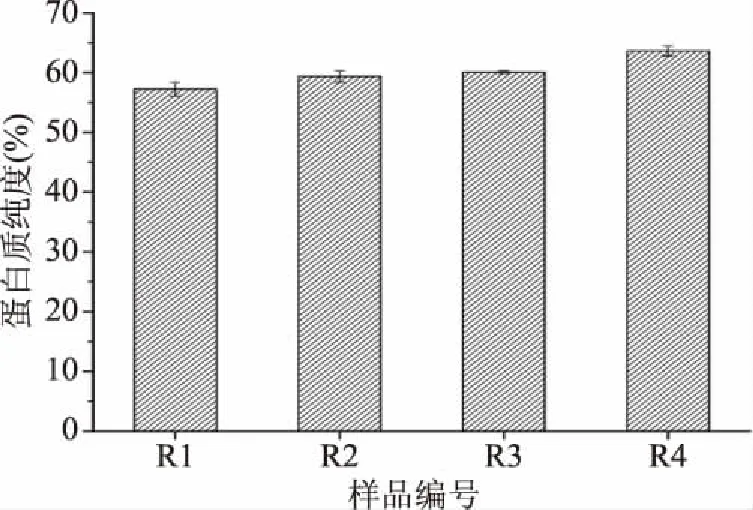
图7 脱酚程度对蛋白质纯度的影响Fig.7 Effect of degree of polyphenol removal on protein purity
2.2.4 功能性质 对比观察表4中数据,经过乙醇酸处理过后得到的菜籽蛋白较未用乙醇酸处理得到的菜籽蛋白具有更好的持水力、持油力、乳化性、乳化稳定性、起泡性和起泡稳定性,并且在上述几个指标上基本符合脱酚程度越高,增长幅度越明显的趋势。然而溶解度随着酚含量的上升有小幅度的下降同时远低于大豆蛋白的溶解度。按照最佳工艺处理过后水相蛋白的持水力、持油力、乳化性、乳化稳定性、起泡性、起泡稳定性较未处理蛋白分别提高59.31%、26.26%、52.17%、121.29%、60.78%、41.42%,而溶解度较未处理蛋白降低9.85%。用乙醇酸反应60 min进行三次处理后得到的菜籽蛋白在所有功能性质的指标上均高于未用乙醇酸处理的菜籽蛋白。
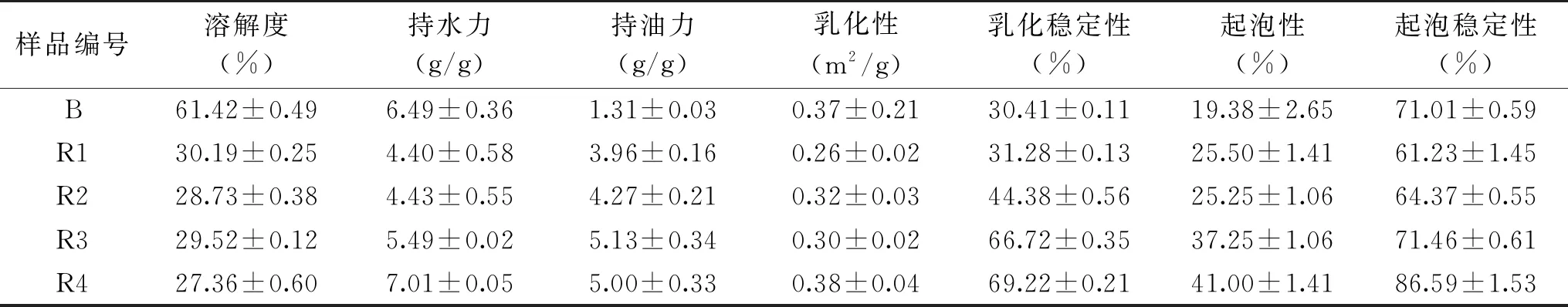
表4 脱酚程度对蛋白质功能性质的影响Table 4 Effect of degree of polyphenol removal on protein function and properties
一般来说,增加蛋白质产品中酚的含量会降低蛋白质的溶解度[27]。尽管未经处理的蛋白质中的多酚含量最高,但它却拥有比用酸乙醇处理后较高的溶解度,一方面可能是溶剂诱导蛋白质变性的结果,未经溶剂处理的蛋白质以及蛋白质多酚复合物的天然形态会与醇处理后蛋白质及其复合物有一定性质上的差异。另一方面,由溶剂引起的物理化学变化例如残余巯基的阻隔性,也可能是造成这些差异,导致不溶性的原因。
蛋白质的持水、持油能力与蛋白质的特殊构象相关,脱酚后持水、持油能力的提高可能是热处理使蛋白质的特殊构象发生改变,使极性氨基酸残基或是非极性侧链暴露在分子表面,与水/油分子的结合能力增强。蛋白质的乳化性质指的是蛋白质促进油和水结合的能力,脱酚后蛋白质乳化和乳化稳定性的提高可能是由于高温和乙醇处理使蛋白质的结构发生改变,从而使更多的疏水基团暴露在蛋白质分子的表面,使蛋白质的表面疏水性上升,表面张力下降,同时也可能是脱酚降低了蛋白质和多酚结合能力,使优质蛋白暴露出来[28]。蛋白质和多酚结合能力的下降也可能导致蛋白质中羧基、氨基这类具有较强起泡性能的表面活性物质暴露,使得起泡力和起泡稳定性增强[29]。
同时,对比大豆分离蛋白,未对原料进行脱酚处理得到的菜籽蛋白在持水力、乳化性、起泡稳定性上均显不足,但是菜籽蛋白经过脱酚处理后,除了溶解度之外,菜籽蛋白的各项功能性质均优于大豆蛋白。因此,基于脱酚菜籽蛋白的功能性质,可将其运用到肉制品、烘焙制品等中去,这也为日后脱酚菜籽蛋白的应用前景提出了研究方向。
3 结论
用乙醇酸法处理菜籽原料对菜籽中多酚和硫苷的脱除效果,并对处理后的菜籽原料进行水媒法提油,对副产物水相进行蛋白的回收,研究发现酚类的脱除对水媒法水相蛋白的颜色、纯度、功能性质有改善。研究结果表明,由单因素实验得到的乙醇酸法脱除菜籽多酚和硫苷的最佳提取工艺条件为乙醇浓度40%,料液比1∶5,pH=5,提取温度80 ℃,反应时间60 min,反应次数为3次,此工艺下多酚提取量为(8.14±0.42) mg/g,多酚脱除率为51.86%±2.31%。该工艺下硫苷提取量为(32.28±2.32) mg/g,硫苷脱除率为84.66%±0.76%,硫苷脱除后达到低硫苷菜籽的标准。
对原料进行粉碎,并对水媒法提油后得到的水相进行酸沉蛋白。结果表明,蛋白质的颜色变浅,白度由未处理42.93±0.94上升到乙醇酸法处理后的50.01±1.72;纯度上升,乙醇酸法处理后的水相蛋白纯度比未处理前提高6.39%;持水力、持油力、乳化性、乳化稳定性、起泡性、起泡稳定性均随着蛋白质中酚的减少而提高:处理过后水相蛋白的持水力、持油力、乳化性、乳化稳定性、起泡性、起泡稳定性分别提高59.31%、26.26%、52.17%、121.29%、60.78%、41.42%,而溶解度较未处理蛋白降低9.85%。同时,与大豆蛋白的功能性质进行对比后,发现脱酚菜籽蛋白的功能性质除溶解度外均优于大豆蛋白,提供了日后脱酚菜籽蛋白的应用方向。
