铁皮石斛两个DEAD-box RNA解旋酶基因克隆及特征分析
2020-07-20李元敏梁小燕颜永刚李依民
李元敏,李 慧,梁小燕,高 静,沈 霞,颜永刚,李依民,张 岗
(陕西中医药大学 药学院,陕西省秦岭中草药应用开发工程技术研究中心,西安 712046)
解旋酶(Helicase)是所有生命体中普遍存在的、具有促进双链DNA/RNA解链的驱动蛋白。根据蛋白序列结构域的差异,解旋酶被分为两个主要的超家族SFⅠ和SFⅡ,其中RNA Helicase(RH)在后者中占比较大[1]。第二个基序具有的氨基酸残基天冬氨酸-谷氨酸-丙氨酸-天冬氨酸(D-E-A-D)特征的一类RH命名为DEAD-box RNA Helicase(DEAD-box RH)[2]。研究表明,DEAD-box RH主要作为RNA分子伴侣,参与RNA转录与翻译及其他加工修饰等一系列代谢过程[3]。
目前,已有大量关于病毒[4]、细菌[5]和动物[6]DEAD-box RH的研究报道,主要涉及RNA复制周期、细胞增殖和分化等功能,临床医学研究揭示RH与肿瘤发生、癌症发展等密切相关。近年来,该基因在植物分子生理学与植物细胞生理学的研究受到关注。如OsRH2和OsRH34在调控水稻株高、花粉与种子发育方面起重要作用[7]。AtRH7是模式植物拟南芥在冷胁迫下生长发育所必需的条件[8]。蕨类问荆的EaRH1基因序列分析揭示其与植物体生理、生化和非生物胁迫应答等相关[9]。植物RH基因研究涉及的药用物种数量目前较局限,大多是关于玉米[1]、水稻[7]、番茄[10]等农作物抗逆生理的研究。
兰科铁皮石斛DendrobiumofficinaleKimura et Migo为多年生植物,以茎入药,具有益胃生津、滋阴清热的功效[11]。其化学成分以多糖、生物碱类为主,同时药理研究揭示其降低血糖、抗肿瘤、调节机体免疫力等方面的作用机制[12]。前期,课题组构建铁皮石斛cDNA文库进行功能基因研究[13],两条EST C377、C468与植物RH家族成员序列相似性较高。鉴于RH在植物细胞生理过程中的重要作用,本研究利用RACE首次克隆获得铁皮石斛RNA解旋酶DoRH1和DoRH2基因全长,并进行序列结构分析及特性预测,为后续该基因在石斛中的分子功能研究奠定基础。
1 材料与方法
1.1 材 料
野生植物材料于2017年10月采自浙江金华,经陕西中医药大学张岗教授鉴定为兰科石斛属铁皮石斛D.officinaleKimura et Migo。铁皮石斛幼苗正值营养生长时期,株高(10±2)cm,取5株幼苗根、茎、叶不同部位样品,重复3次,置液氮速冻后超低温保存。
1.2 总RNA提取和cDNA合成
利用RNA试剂盒(北京艾德莱)、RQ1无RNase活性DNA 酶(Promega,美国)、NanoDropTM2000分光光度计(Thermo Fisher,美国),依次进行总RNA的提取、DNA杂质的消除以及RNA质量和纯度检测的操作,利用1.2%琼脂糖凝胶电泳鉴定RNA完整性。使用M-MLV Reverse Transcriptase kit(Promega,美国)合成cDNA第一链。
1.3 RACE克隆
通过序列分析可知C377编码的肽段N端和C段均不完整,因此需进行对其两端进行RACE克隆,C468序列编码的肽链片段在C末端含有58个氨基酸,所以只需操作5′-RACE克隆。使用RACE cDNA Amplification Kit(Clotech,Japan)设计基因特异引物(表1),然后利用设计所得特异引物分别与试剂盒中相应的UPM引物依次组合进行RACE反应。

表1 引物及其序列Table 1 Primers and sequence
1.4 序列分析
使用在线相关分析工具对DoRH1和DoRH2基因进行核酸及蛋白序列分析。在 NCBI的BLASTx和ORF Finder分别对cDNA序列分析;用ExPASy Proteomics Server的一系列程序工具对2个基因编码蛋白质的结构域和基元分析;使用Protparam和SOPMA相互对比分析蛋白理化特性和二级结构;SignalP 4.1和TMHMM推测其是否存在信号肽序列或跨膜域的个数;Plant-mPLoc预测亚细胞定位。使用DNASTAR 6.0软件中的MegAlign程序对同家族蛋白之间进行多序列比对;借助MEGA 6.0软件构建系统进化树。
1.5 qPCR分析
2 结果与分析
2.1 基因克隆
经过两次巢式RACE反应,C377F2、C468R2′与UPM组合扩增分别获得预期单条带(图1),经克隆测序获得长1 578、1 595 bp的两条序列,均包含完整的开放阅读框(open reading frame,ORF),无需进行RT-PCR验证。分别拼接相应的RACE产物和原始EST得到两条cDNA序列分别长为1 648 bp和1 851 bp。通过BLASTx比对发现两条序列与已注册的多种植物RH家族成员基因的一致性评价较高(>83%),故此定名分别为DoRH1和DoRH2,提交GenBank获得注册号分别为KT957555和KT957556。序列分析显示,DoRH1与DoRH2两序列的完整ORF分别长1 287 bp、1 500 bp,其中二者的 5′-UTR和3′-UTR分别为75 bp和 286 bp及62 bp和289 bp;且在两条序列中均含有真核生物特有的polyA尾巴结构,起始密码子附近碱基序列分别为AGAATGG、GTCATGA,DoRH1符合KOZAK规则[16]。

M.DL 2000; 1.DoRH1-5′ RACE;2.DoRH1-3′RACE;3.DoRH2-5′RACE
2.2 蛋白理化特性分析
Compute pI/MW预测DoRH1和DoRH2基因编码蛋白的分子式分别为C2135H3405N581O641S23和C2458H3903N695O737S14,相对分子质量分别为48 206和55 432,等电点分别为5.51和8.65;DoRH1和DoRH2蛋白所带正电残基(Arg+Lys)为51和68,负电残基(Asp+Glu)为68和64。两个蛋白的不稳定系数(Instability index)为41.01和39.56,脂肪系数(Aliphatic index)为94.49和82.08,亲水性系数(Grand average of hydropathicity)为-0.197和-0.430。SOPMA分析表明,DoRH1和DoRH2的二级结构主要由延伸链(16.59%和16.63%)、α-螺旋(45.09%和32.46%)、随机卷曲(31.07%和42.69%)及β-转角(7.24%和8.22%)组成。
2.3 蛋白结构域预测
利用InterProScan与PROSITE的在线分析预测结果一致表明(图2), DoRH1和DoRH2蛋白均含有3个保守的RH结构域,分别为 Q_MOTIF(DEAD-box RNA解旋酶Q基序)、 HELICASE_ATP_BIND_1(超家族1和2解旋酶ATP结合型-1结构域)、HELICASE_CTER(超家族1和2解旋酶C末端结构域)。PROSITE SCAN分析表明,两个蛋白均含有不同氨基酸位点的蛋白家族基元(表2)。使用SignalP 4.1和TMHMM在线分析一致表明,两个蛋白信号肽或跨膜域,同时Plant-mPLoc预测两个蛋白均定位在细胞核。
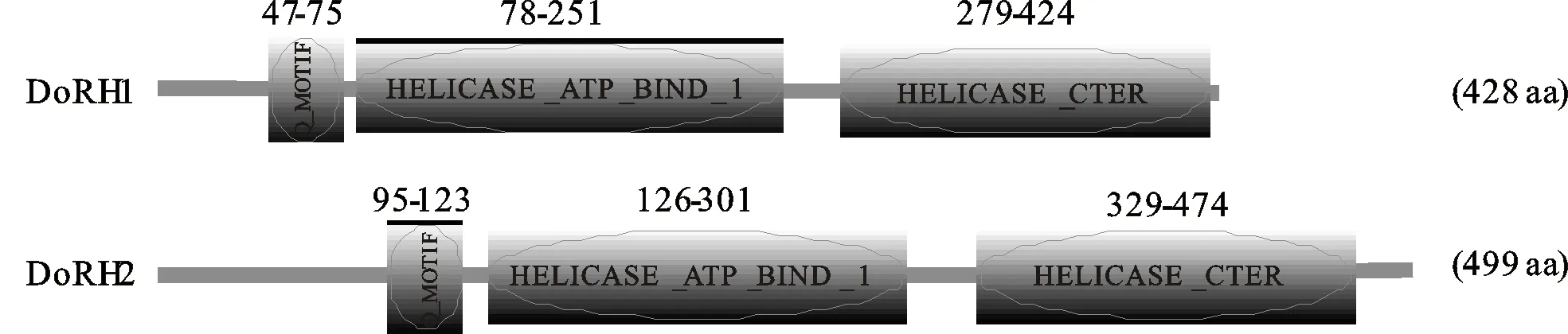
图2 DoRH1和DoRH2蛋白的PROSITE分析Fig.2 PROSITE analyses of DoRH1 and DoRH2 proteins

表2 DoRH1和DoRH2蛋白序列的保守基元Table 2 Conserved motifs of DoRH1 and DoRH2 proteins
2.4 蛋白多序列比对
借助DNAStar 6.0软件中的MegAlign对RH家族的两个目的蛋白和其他植物蛋白进行多序列比对(图3-A、3-B)。数据分析显示,DoRH1与葡萄Vitisvinifera(XP_002268833)、可可Theobromacacao(EOY29499)、番木瓜Caricapapaya(XP_021912509)和芝麻Sesamumindicum(XP_011070464)的相似性分别高达94%、95%、95%和95%。DoRH2与中华猕猴桃Actinidiachinensisvar.chinensis(PSS18057)、葡萄Vitisvinifera(XP_002268823)、苦瓜Momordicacharantia(XP_002279117)和柑桔Citrussinensis(XP_006466042)等蛋白的相似性分别高达86%、85%、84%和84%。此外,两个蛋白各有3个保守的RH结构域,符合DEAD-box RNA helicases家族的结构特点。
2.5 蛋白分子进化关系
为分析铁皮石斛DoRH1、DoRH2基因编码蛋白的分子进化关系,采用MEGA 6.0软件邻接法(Neighbour-Joining)从利用phytozome数据库选取拟南芥、水稻、大豆和雷蒙德氏棉等4种植物的部分DEAD-box RNA helicase蛋白家族成员[17],构建分子进化树。对比拟南芥进化树发现Ⅲ支中AT2G45810(AT2G45810.1)、AT4G00660(AT4G00660.1、AT4G00660.2)、AT3G61240(AT3G61240.1、AT3G61240.2)分别被命名为ATRH6、ATRH8、ATRH12;Ⅳ支中AtRH20 (AT1G55150.1) DEAD-box解旋酶是酵母Dbp2 DEAD-box解旋酶的直系同源物,同支水稻基因LOC_Os01g68320.1、LOC_Os01g68320.2、LOC_Os01g10050.1、LOC_Os01g10-050.2均具有相同的Dbp2基因,系Dbp2 DEAD-box解旋酶[18]。从图4可以看出,所选RH蛋白被聚成Ⅰ、Ⅱ、Ⅲ、Ⅳ 4小支;目标DoRH1、DoRH2蛋白分别聚在Ⅲ、Ⅳ支。

Vv.葡萄;Cp.番木瓜; Si.芝麻;Tc.可可豆;Do.铁皮石斛;Acc.中华猕猴桃;Cs.柑桔;Mc.苦瓜;实线为2个RH结构域,1.DEAD-box RNA解旋酶Q基序谱;2.超家族1和2解旋酶ATP结合型-1结构域;3.超家族1和2解旋酶C末端结构域
2.6 组织表达特异性分析
分别提取铁皮石斛根、茎、叶各样品总RNA,借助qPCR检测2个基因的不同组织表达特性。由图5可见,DoRH1和DoRH2基因转录本在3种组织中的相对表达量有差异,但基因表达趋势类似,二者均在根中高丰度表达。DoRH1在根中的相对表达量为叶中的1.26倍,而在茎中为叶中的0.76倍;DoRH2在根中的相对表达量为叶中的3.26倍,茎中与叶中的表达量近似,仅叶中的1.04倍。
3 讨 论
DEAD-box RNA解旋酶通过NTP(大多为ATP)水解产生能量来修饰RNA,广泛参与RNA生物化学反应各个过程,在细胞核内主要参与核糖体发生、转录和mRNA前体剪接,胞质中主要参与miRNA加工、无义突变介导的mRNA降解、蛋白翻译和细胞器特异的RNA代谢等[19]。目前已有玉米[1]、水稻[7]和拟南芥[8]等植物中DEAD-box RNA解旋酶家族基因的系统研究,揭示其在植物生长发育和生理适应中的作用。本研究首次从铁皮石斛中分离到DoRH1和DoRH2基因全长,与GenBank中已注册的植物DEAD-box RNA解旋酶家族成员基因一致性很高,2个基因编码蛋白各有3个保守域,如DEAD-box RNA解旋酶Q基序,符合其家族高度保守的特征[1]。2个蛋白预测都定位在细胞核,可能参与细胞核生化反应,与已报道中DEAD-box RNA解旋酶主要作用于核RNA加工的研究相符合[20]。

以AT、LOC_Os、Glyma和GRMZM起始的符号分别为拟南芥、水稻、大豆和雷蒙德氏棉的RH基因注册号

图5 q-PCR分析 DoRH1和 DoRH2基因的组织表达Fig.5 Tissue-specific expression of DoRH1 and DoRH2 genes using q-PCR analysis
进化树分析2个铁皮石斛RH基因分别聚为Ⅲ、Ⅳ两大支,Ⅲ支中ATRH6会受低温诱导,ATRH8是马铃薯属病毒VPg(Viral genome-linked protein)蛋白感染过程中所需要的一个宿主因子,帮助病毒复制,若敲除后会使植物体不仅在表型上与野生型无异,还会在被病毒侵染过程产生抗性[19]。Ⅳ支中AtRH20与Dbp2蛋白功能在tombusvirus家族TBSV病毒(Tomatobushystuntvirus)的复制中具有高度相似性,均促进RNA病毒复制[21];据报道在该病毒天然宿主植物番茄、模式植物拟南芥以及菠菜植株体内感染TBSV病毒后,植物的表型均发现明显的发育畸变,生长发育迟缓,叶量浓密,叶子尺寸变小且卷曲,基部叶片褪绿呈紫色,果实产量大大降低且多无籽[22]。因此,推测DoRH1、DoRH2参与石斛特殊生境下的生理适应,其具体作用方式仍需要深入研究。
解析基因功能多样性的首要工作是对基因表达差异的研究。DEAD-box RNA helicase家族成员的基因表达具有组织表达、时空表达或响应胁迫等特点,功能涉及到植物生长发育和抗逆生理性等多方面[23]。拟南芥中有多个DEAD-box家族基因参与抗逆,其中AtRH38和AtRH42是对温度胁迫反应最具典型的代表[19]。对玉米配子体细胞质雄性不育系分析发现,ZmRH2表达在叶、根和雌穗3个器官中无明显差异,而对于花丝和花粉器官中的表达明显可育系高于不育系S-Mo17rf3rf,说明ZmRH2参与可育系花粉发育调控[1]。PRH75基因在菠菜下胚轴、根和顶芽等器官中表达水平较高,在叶子发育进程中明显下降,表明PRH75与叶细胞的快速增殖和分裂有关[24]。在本研究中,qPCR对DoRH1和DoRH2基因检测分析发现,DoRH1不具有器官表达差异,推测参与在石斛各器官本底的生长发育;DoRH2在各器官中表达丰度差异明显,依次为根>茎>叶,推测在根中发挥重要的调控作用。由此可见,多基因家族成员通过协同表达调控发挥基因功能。当然,更具体确切的作用机制还需进一步研究。铁皮石斛作为珍稀传统名贵中药材,临床疗效显著,具有可观的经济价值;但其生长环境条件特殊,表现出一定的生理适应。后续通过RNAi或过表达研究DoRH1和DoRH2的分子作用,为石斛资源可持续控制与利用提供 支撑。
