畜禽粪便堆肥高温保氮菌Aliibacillus thermotolerans BM62的筛选及复壮
2020-07-20高君峰王泽懿刘文越狄鲁滨张胜美常可鑫
高君峰,徐 杰,王泽懿,刘文越,狄鲁滨,张胜美,陈 舒,常可鑫
(东北农业大学资源与环境学院,黑龙江 哈尔滨 150030)
畜禽粪便堆肥高温期氨挥发严重,导致堆肥中氮损失并造成环境污染[1-3]。将NH3转化为控制氨挥发一直是堆肥研究的热点。氨氧化细菌是堆肥中将NH3转化为N的关键微生物,但其大多数为中温菌,只能在降温期发挥作用。而且,其难培养特性导致很少纯种被分离纯化,限制了其个体生理代谢的研究。针对此问题,本实验筛选到一株高温微好氧氨氧化细菌,经鉴定此菌株为芽孢杆菌科(Bacillaceae)的一个新属,命名为Aliibacillus thermotolerans BM62。
菌种在长期的保藏过程中必然会受外界因素或自发突变的影响,导致其某些优良性能不同程度的衰退[4]。不可避免的菌种退化会严重影响菌种的特性和质量,从而对相关的理论研究和实际生产应用带来严重阻碍或经济损失。因此合适有效的复壮措施研究一直是菌种资源保藏和利用过程中的必要工作[5]。相关研究表明,氨氧化细菌由于反复迭代等原因,其氨氧化能力衰退明显[6]。而且,由于氨氧化细菌自身具有生长速率低、世代周期长、其培养物易受异养菌感染而不易分离纯化等原因,目前为止获得的氨氧化细菌纯培养种类极少[7-9],导致有关氨氧化细菌,尤其是高温异养氨氧化细菌的菌种复壮技术鲜有报道。针对于此,本实验同时提供此株高温微好氧氨氧化细菌Aliibacillus thermotolerans BM62的复壮方法,为畜禽粪便堆肥的保氮处理提供持续的微生物源。
1 材料与方法
1.1 筛菌堆肥实施及筛菌过程
1.1.1 筛菌样品堆肥实施
堆肥原料为牛粪和水稻秸秆,分别取自哈尔滨香坊区幸福乡和香坊农场。干燥的水稻秸秆剪成1~2 cm长的小段,与牛粪按照1∶3.5的质量比(干重)混合均匀。堆肥中总C/N质量比约为30∶1,水分含量约为65%。堆肥发酵堆规格为1.5 m(长)×1.5 m(宽)×1.2 m(高)。在不同堆肥(温度)时期取样,4℃保存备用。
1.1.2 氨氧化菌BM62的筛选过程
从4个不同温度(45、50、58、65℃)的堆肥样品中分别称取5 g样品,分别置于装有45 mL的无菌水100 mL的锥形瓶中振荡30 min制成菌悬液。将菌悬液分别抽取10 mL分别置于装有150 mL富集培养基的锥形瓶中50℃恒温振荡培养,转速为150 r/min。
从培养4 d后的锥形瓶中分别吸取0.5 mL培养菌液采用涂布法分别接种于平皿(划线分离培养基)中,置于50℃培养箱中微好氧倒置培养7 d。挑取单菌落,采取平板划线法纯化单菌落。
将纯化的单菌落接种于装有10 mL氨氧化细菌检测培养基的试管中振荡微好氧培养2 d,培养温度为50℃,转速为150 r/min。采用格里斯试剂法进行检测,阳性结果呈浅粉至深玫瑰紫色变化,表明该菌株具有氨氧化能力;阴性结果无颜色变化,表明该菌株无氨氧化能力。据此筛选出高温微好氧氨氧化细菌株,将菌种接入斜面培养后,移入冰箱4℃条件下保藏。
菌株Aliibacillus thermotolerans BM62分离自58℃堆肥样品。
1.1.3 本实验所需复壮氨氧化菌种Aliibacillus thermotolerans BM62代系为子五代。
1.2 培养基配方
氨氧化菌富集培养基:(NH4)2SO45 g,KCl 4 g,MgSO42.5 g,CaCl21.85 g,NaCl 3 g,NaHCO342 g,蛋白胨30 g,牛肉膏20 g,pH值=8,蒸馏水1 000 mL;
氨氧化菌划线分离培养基(C-2培养基)[6]:(NH4)2SO45 g,KCl 4 g,MgSO42.5 g,CaCl21.85 g,NaCl 3 g,NaHCO342 g,蛋白胨60 g,牛肉膏 40 g,琼脂20 g,蒸馏水1 000 mL;
氨氧化细菌检测培养基:(NH4)2SO45 g,KCl 4 g,MgSO42.5 g,CaCl21.85 g,NaCl 3 g,NaHCO37.5 g,蛋白胨 5 g,牛肉膏1 g,琼脂20 g,蒸馏水1 000 mL;
复壮驯化培养基Ⅰ:称取堆肥样品5 g,置于250 mL锥形瓶中加入150 mL蒸馏水制成培养悬液,调节pH值=8,3个平行样,瓶身分别标记A1、A2、A3;
复壮驯化培养基Ⅱ:称取堆肥样品5 g,另加入4 g牛肉膏和6 g蛋白胨,置于250 mL锥形瓶中加入150 mL蒸馏水制成培养悬液,3个平行样,瓶身分别标记6A1、6A2、6A3;
复壮驯化培养基Ⅲ:称取堆肥样品5 g,另加入8 g牛肉膏和12 g蛋白胨,置于250 mL锥形瓶中加入150 mL蒸馏水制成培养悬液,3个平行样,瓶身分别标记12A1、12A2、12A3;
氨氧化细菌种子培养基[6]:(NH4)2SO45 g,KCl 4 g,MgSO42.5 g,CaCl21.85 g,NaCl 3 g,NaHCO342 g,蛋白胨60 g,牛肉膏40 g,pH值=8,蒸馏水1 000 mL;
氨氧化细菌检测培养基[6]:(NH4)2SO45 g,KCl 4 g,MgSO42.5 g,CaCl21.85 g,NaCl 3 g,NaHCO37.5 g,蛋白胨 5 g,牛肉膏1 g,pH值=8,蒸馏水1 000 mL。
1.3 检测试剂(格里斯试剂[10])
A液:对氨基苯磺酸溶液:称取4 g对氨基苯磺酸溶于700 mL水和300 mL冰乙酸中,混匀置于棕色瓶,室温保存。B液:N-1-萘基乙二胺盐酸盐溶液:称取N-1-萘基乙二胺盐酸盐加入1 L的60%的乙酸溶液中混匀,置于棕色瓶中,4℃保存,保质期为7 d。
检测时加入样液(培养液)5 mL,格里斯试剂先加A液2 mL充分混匀,再加B液1 mL充分混匀。待测样品变为玫紫色或玫红色说明样液中菌种的氨氧化能力强;待测样品变为浅粉色说明样液中菌种的氨氧化能力较强;待测样品变为淡黄色说明样液中菌种的氨氧化能力较弱;待测样品无颜色变化说明样液中菌种近乎无氨氧化能力。
1.4 氨氧化细菌菌种复壮
1.4.1 菌株驯化培养
将待复壮的菌株Aliibacillus thermotolerans BM62(子二代)接种于氨氧化细菌种子培养基,50℃、100 r/min培养,培养到浓度为D600=0.1~0.15得到种子液,种子液按体积比种子液∶复壮驯化培养基1∶10接入复壮驯化培养基中,50℃、100 r/min条件下恒温振荡培养到浓度为D600=0.1~0.15后,取上清菌液按体积比上清菌液∶氨氧化细菌检测培养基1∶10接入氨氧化细菌检测培养基,50℃、100 r/min条件下恒温振荡培养3 d。利用格里斯试剂显色法进行氨氧化能力检测。
1.4.2 驯化培养后细菌的分离纯化
(a)平皿涂布培养:取氨氧化能力显色试验结果呈玫红色和玫紫色的复壮培养菌液,进行平皿涂布培养,平皿涂布培养基为氨氧化细菌固体培养基,50℃恒温静止倒置培养5 d;
(b)平皿划线培养:选取步骤(a)所得平皿涂布培养中菌落长势良好的平皿,挑取独立菌落在氨氧化细菌固体培养基上进行平皿划线培养,50℃恒温静止倒置培养5 d;
(c)单菌落检测:单菌落划线平皿中挑选出长势良好的平皿,挑取独立菌落接入氨氧化细菌种子培养基,50℃、100 r/min条件下恒温振荡培养2 d得种子液,调整种子液浓度为D600=0.1~0.15,按体积比种子液∶氨氧化细菌检测培养基为1∶10接种至氨氧化细菌检测培养基,50℃、100 r/min条件下恒温振荡培养3 d,利用格里斯试剂显色法进行单菌落氨氧化能力显色检测。
1.4.3 复壮有效菌种的氨氧化活性测定
取单菌落氨氧化能力显色检测结果呈玫红色即氨氧化能力强的菌落,将其在步骤1.4.2中(c)得到的种子液按体积比种子液∶氨氧化细菌种子培养基为1∶10接种至氨氧化细菌种子培养基,50℃、100 r/min条件下恒温振荡培养2 d后,调整到浓度为D600=0.1~0.15,按照体积比培养液∶氨氧化细菌检测培养基为1∶10接种至氨氧化细菌检测培养基,50℃、100 r/min条件下恒温振荡培养3 d,测定亚硝酸盐含量,评估其氨氧化活性。
氨氧化活性的计算方法:
亚硝酸钠标准曲线绘制:用分光光度计在波长540 nm处比色。以光密度(OD)为横坐标,亚硝酸根浓度为纵坐标,绘制标准曲线。测定复壮有效菌株在氨氧化细菌检测培养基培养3 d后540 nm处的吸光度值,根据亚硝酸钠的标准曲线方程得出其亚硝酸钠浓度,用亚硝酸钠浓度值代表相应菌株的氨氧化活性值。
1.5 菌株BM62的鉴定
1.5.1 菌落形态观察
将菌株BM62划线接种于C-2培养基,50℃培养5 d,观察菌落形态。
1.5.2 菌体形态观察
利用电子扫描显微镜(model CX31-2;Olympus)观察菌株BM62菌体形态。
1.5.3 化学分类分析
菌株BM62的细胞化学分析,包括:G+C%含量、脂肪酸成分、极脂组成、呼吸醌类型和肽聚糖的特征氨基酸,以上指标均由德国菌种保藏中心(DSMZ)测定。
1.5.4 分子鉴定及同源性比较分析
将菌株BM62保藏斜面送至上海生工测定其16S rDNA序列。将测得的该菌株的16S rDNA序列利用Blast软件中的nucleotide blast与GenBank、EMBL及DDBJ等数据库中的已知序列进行比对,得出菌株BM62与其它相关的菌株的16S rDNA序列相似性。再用ClustalW2软件包(http://www.ebi.ac.uk/Tools/clustalw2/)进行多序列匹配排列。采用MEGA version 6.0软件构建系统发育树[11]。选择 最 大 似 然 法(maximum-likelihood)[12]对 系统进化树进行估算,通过1 000次取样确定其Bootstrap值。
2 结果与分析
2.1 菌株BM62的筛选过程
从不同温度的堆肥样品中共分离纯化获得45株异养氨氧化细菌,其中12株分离自45℃堆肥样品,9株分离自50℃堆肥样品,16株分离自58℃堆肥样品,8株分离自65℃堆肥样品。其中分离自58℃堆肥样品的菌株BM62的氨氧化能力显色实验的颜色变化最为明显,呈深紫色(图1)。随后对菌株BM62进行氨氧化能力的定量检测,其在氨氧化细菌检测培养基中培养18 h后NO2-浓度为3.81 mg/L,与M é vel等[13]在深海热泉口分离的一株异养嗜热氨氧化菌的氨氧化能力相当。因此,本实验对此株嗜热异养氨氧化细菌BM62进行进一步的鉴定研究。

图1 菌株BM62的氨氧化能力检测显色
2.2 菌株BM62的鉴别特征
菌株BM62具芽孢,革兰氏染色阴性,菌体细胞呈杆状,长约2~2.5 μm,宽约0.3~0.6 μm,具鞭毛(图2)。微好氧,接触酶阳性和氧化酶阴性。该菌株在50℃的生长和氨氧化能力最强。在C-2培养基上培养5 d,菌落直径扩展约为2 mm,菌落呈边缘整齐的圆形,菌落质地湿润、光滑(图 3)。
16S rRNA分子鉴定结果显示,该菌株的16S rRNA序列(登记号KT999394)与其最近的菌株Alteribacillus persepolensis HS136T的16S rRNA序列相似性仅有94.53%[14],根据现有界定新种属的规定,16S rRNA序列相似性在90%~95%为新属[15],这就表明菌株BM62T很有可能是具有氨氧化能力的新属细菌。因此,本实验室继续对该菌株做了更加系统详尽的菌株鉴定试验,主要鉴定结果如下:G+C(36.5%);主要脂肪酸为 iso-C16∶0;主要极脂组成为双磷脂酰甘油(diphosphatidylglycerol)、磷脂(phospholipid)和磷脂酰甘油(phosphatidylglycerol);呼吸醌为MK-7(100%);二氨基庚二酸(meso-diaminopimelic acid)为肽聚糖的特征氨基酸,这些主要的生理生化指标均显示菌株BM62T与其最相近的其他菌株有明显差异。菌株BM62T与其遗传关系最近的3株细菌的主要性状比较见表1和表2,BM62T的系统进化树见图4。据此,拟将菌株BM62划分为芽孢杆菌科(Bacillaceae)的新属,命名为Aliibacillus thermotolerans。该菌株现已保存在DSMZ(德国)和CGMCC(中国),保藏号分别为 DSM 101851T和 CGMCC 1.15790T。
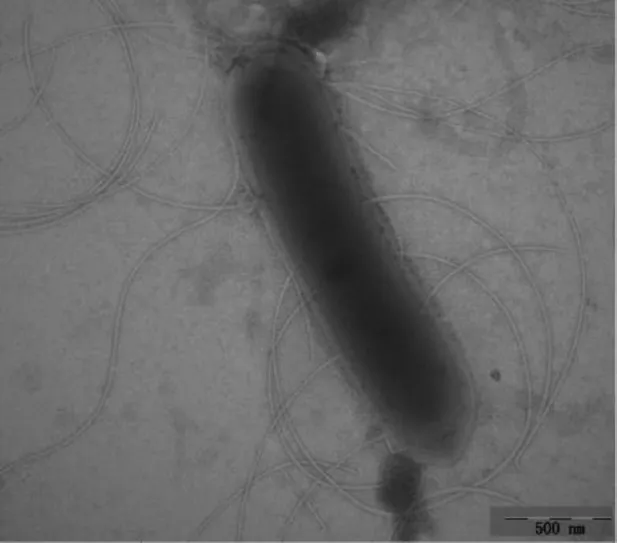
图2 菌株BM62T菌体透射电镜照片
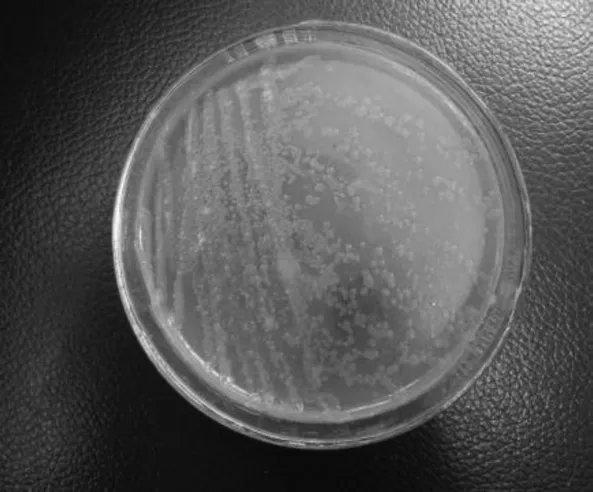
图3 菌株BM62培养5 d后的菌落

表1 菌株BM62与其遗传关系最近的3株细菌的主要性状比较

表2 菌株BM62与其遗传关系最近的3株细菌的主要脂肪酸组分和含量 (%)
由于对菌株BM62的研究过程中需要不断地反复迭代,在此过程中发现其氨氧化能力衰退明显。鉴于该菌株具有难得的高温氨氧化特性,保持其稳定的氨氧化能力意义重大。目前有关氨氧化细菌,尤其是高温异养氨氧化细菌的菌种复壮技术鲜有报道,因此本实验同时对菌株BM62氨氧化能力的复壮技术进行探讨。
2.3 驯化复壮后菌株的显色情况
将菌株BM62制成种子液,接种到不同处理的复壮培养基中,驯化培养后进行氨氧化能力显色检测,结果见表3。
结果显示,未经复壮的BM62的氨氧化能力显色实验呈浅红色,经复壮驯化后的菌株中呈玫红色和玫紫色的复壮培养菌液共有3瓶,瓶身标记分别为A1、A2、A3,均为未添加外源营养的复壮驯化培养基Ⅰ培养,其余添加不同含量有机质的6瓶复壮培养液(瓶身标记分别为6A1、6A2、6A3、12A1、12A2、12A3)显色检测结果较淡或几乎不显色,说明添加外源有机营养(牛肉膏、蛋白胨)并不利于此株氨氧化细菌的氨氧化能力复壮,因此这6瓶复壮培养液不进行后续实验。
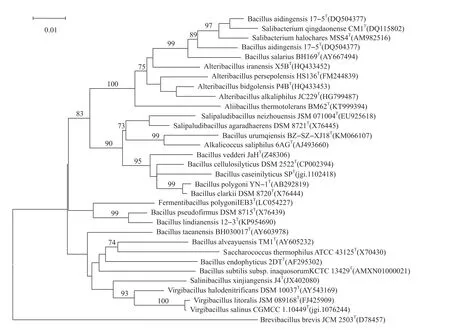
图4 菌株BM62与其进化关系相近种属的系统进化树(最大似然法)
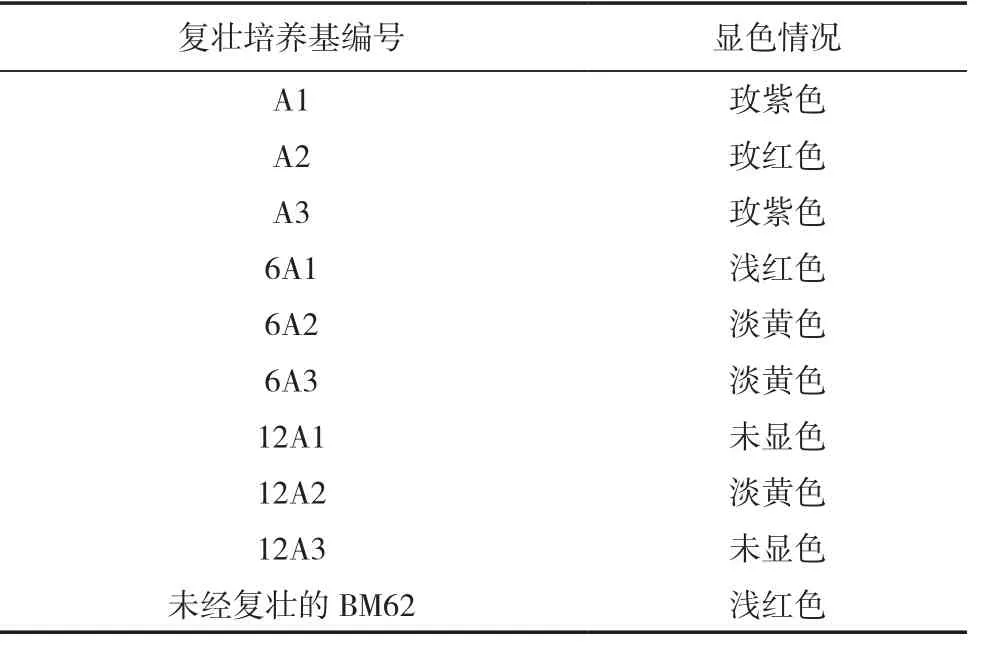
表3 菌株BM62驯化复壮后氨氧化能力检测显色
2.4 驯化复壮后的分离纯化
将氨氧化能力显色实验呈玫红色和玫紫色编号为A1、A2、A3的培养液分别进行平皿涂布培养及平皿划线培养,其培养情况见表4。经平皿涂布培养后,选择其中15个大而独立的菌落,编号分别为A1-1-1、A1-1-2、A1-1-3、A1-2-1、A1-2-2、A1-2-3、A2-2-1、A2-2-2、A2-2-3、A2-3-1、A2-3-2、A2-3-3、A3-1-1、A3-1-2、A3-1-3,进一步进行划线培养纯化。

表4 菌株BM62驯化复壮后的分离纯化情况
2.5 驯化复壮后的单菌落氨氧化能力检测
从15个单菌落划线平皿中挑选出6个菌落长势良好的平皿,编号分别为A1-1-1、A2-2-1、A2-2-2、A2-3-3、A3-1-1、A3-1-2, 每 个 平 皿分别挑取2个大而独立的菌落接入氨氧化细菌种子培养基,共得到12瓶复壮后的种子液,分别编号 为 AF1、AF2、AF3、AF4、AF5、AF6、AF7、AF8、AF9、AF10、AF11、AF12,调整种子液浓度为D600=0.1~0.15,接种至氨氧化细菌检测培养基,振荡培养3 d后进行氨氧化能力显色检测,结果见表5。单菌落氨氧化能力显色检测结果呈玫红(紫)色的即氨氧化能力强的菌落共6个,编号分别为 AF1、AF2、AF6、AF7、AF8、AF10。
2.6 复壮有效菌种的氨氧化活性测定
分别测定该6株优选菌株在氨氧化细菌检测培养基培养3 d后在540 nm处的吸光值,根据亚硝酸钠的标准曲线方程得出其亚硝酸钠浓度,用亚硝酸钠浓度值代表相应菌株的氨氧化活性值,结果见表6。
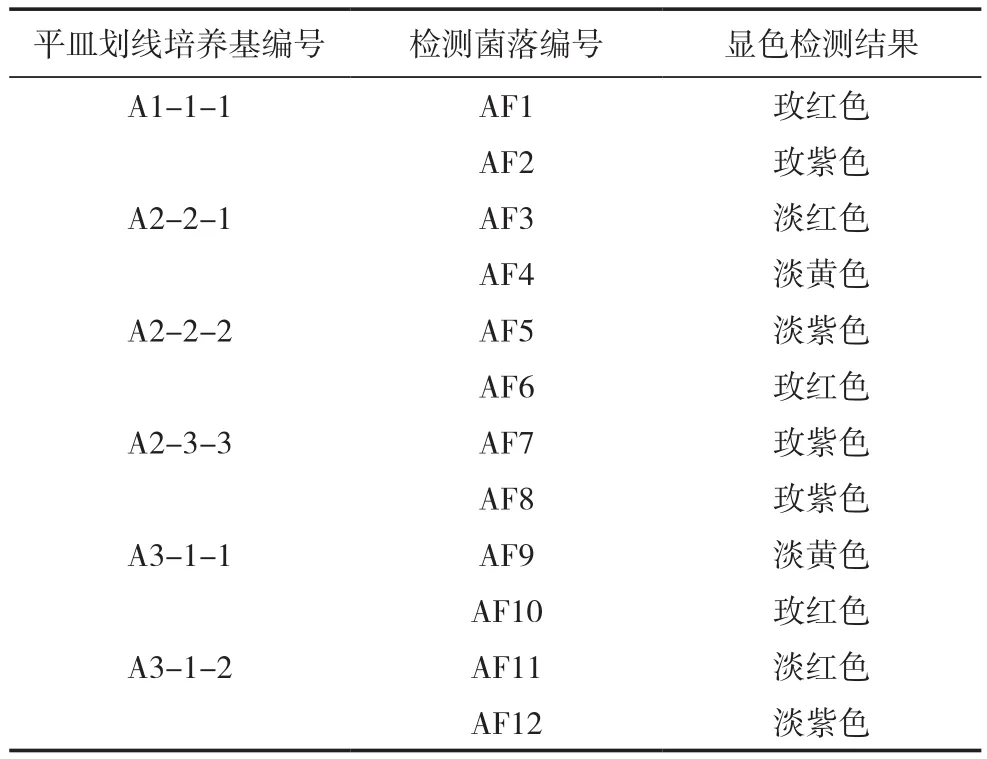
表5 单菌落氨氧化能力检测显色
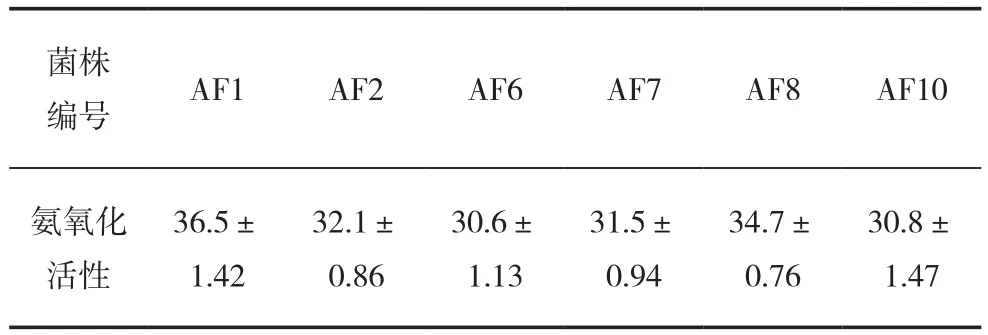
表6 复壮优选6菌株培养3 d后的氨氧化活性(mg/L)
其中菌株AF1和AF8的氨氧化活性分别为36.5和34.7 mg/L,与菌株BM62退化前的氨氧化能力(用同样的方法检测计算得35.0 mg/L)相当,AF1和AF8为此方法筛选所得复壮有效菌种。
3 讨论
高温堆肥是实现畜禽粪便减量化、无害化和资源化的有效措施[19-20]。然而,NH3挥发为主的氮素严重损失是目前畜禽粪便高温堆肥技术面临的瓶颈问题。NH3快速转化为是目前公认的降低堆肥中氮素损失的技术途径之一,氨氧化细菌可以将NH3氧化成NO2-,从而减少堆肥过程中的氨挥发,是畜禽粪便堆肥中的理想保氮微生物[6]。Aliibacillus thermotolerans BM62是本实验室在牛粪水稻秸秆堆肥高温期分离得到的一株耐高温异养氨氧化细菌,经鉴定此菌株为芽孢杆菌科(Bacillaceae)的一个新属。该菌株在50℃生长活力和氨氧化能力最强,最重要的是,该菌株具有微好氧特性,可以完全适应堆肥高温阶段的低溶氧环境。许多相关报道表明,NH3挥发主要发生在堆肥的高温期,在此阶段的释放量可占到总挥发量的60%~70%[21-22],然而绝大多数的氨氧化细菌均为中温好氧菌,它们只能在堆肥降温期发挥作用。由此可见,菌株Aliibacillus thermotolerans BM62适应堆肥高温阶段的氨氧化能力使其具有极高的理论研究价值和实际生产意义。
然而,研究过程中发现,Aliibacillus thermotolerans BM62在传代过程中的氨氧化能力退化较为明显,因此对其功能复壮工作也显得尤为必要和急迫。常用的菌种复壮方法有菌种纯化、更换适宜的培养基、控制菌种的传代次数、采用适宜的保藏方法等[4]。由于菌株BM62具有氨氧化菌不易培养的特性[8,23],其对培养基成分要求相对较高,因此,相对于其他的复壮措施,更换适宜培养基的方法更加有利于提高菌株BM62的复壮效果。菌株BM62在传代中的功能退化,除了菌株自身遗传学和细胞学原因以外,人工培养基成分与堆肥原环境营养的差异也是重要影响因素。本实验的复壮结果也表明,菌株BM62在不加任何外源有机物的堆肥原环境复壮培养基的复壮效果最佳,而添加外源有机物的堆肥原环境营养对该菌株的复壮并没有明显的促进作用。由此可以推测,堆肥原环境的样品中含有促进菌株BM62生长和维持氨氧化能力的必需营养物质,而这些营养物质的具体成分还有待于进一步检查验证。
4 结论
本实验在堆肥高温期样品中筛选得到一株高温异养氨氧化细菌BM62,经鉴定该菌株为厚壁菌门(Firmicutes)芽孢杆菌科(Bacillaceae)的一个新属细菌,暂命名为Aliibacillus thermotolerans BM62。
本研究同时提供了该株氨氧化细菌BM62的简单易行的氨氧化能力复壮方法。
菌株BM62在不加任何外源有机物的堆肥原环境复壮培养基的复壮效果最佳,经复壮培养后,该菌株氨氧化活性为34.7~36.5 mg/L,与其退化前氨氧化能力(35.0 mg/L)相当。
